名校
解题方法
1 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
Ⅰ.(1)下列反应中,属于吸热反应的是___________ 。
A.C和CO2高温下反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
计算可得:H2(g)+Cl2(g)=2HCl(g) △H=___________ kJ·mol-1。
②通过盖斯定律可计算。已知在25 ℃、101 kPa时:
I.2Na(s)+ O2(g)=Na2O(s) △H=—414 kJ·mol-1
O2(g)=Na2O(s) △H=—414 kJ·mol-1
II.2Na(s)+O2(g)=Na2O2(s) △H=—511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。
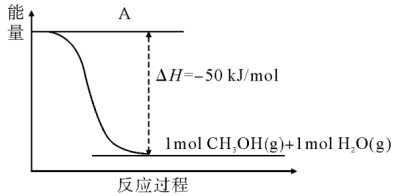
①补全图:图中A处应填入___________ 。
②该反应需要加入铜—锌基催化剂。加入催化剂后,该反应的△H___________ (填“增大”、“减小”或者“不变”);若上述反应中产物为液态水,则该反应的△H___________ (填“变大”、“变小”或者“不变”)。
II.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,根据要求回答相关问题:
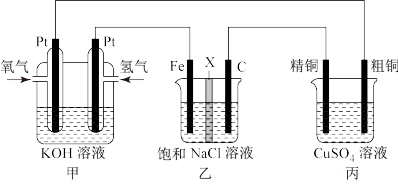
(1)若在标准状况下,甲装置有448 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为___________ 。
(2)若用隔膜法电解饱和食盐水生成NaClO,则X应用___________ 交换膜(填“阳离子”或“阴离子”)。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将___________ (填 “增大”、“减小”或者“不变”)。
Ⅰ.(1)下列反应中,属于吸热反应的是
A.C和CO2高温下反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
| 化学键种类 | H—H | Cl—Cl | H—Cl |
| 键能(kJ/mol) | 436 | 247 | 434 |
计算可得:H2(g)+Cl2(g)=2HCl(g) △H=
②通过盖斯定律可计算。已知在25 ℃、101 kPa时:
I.2Na(s)+
 O2(g)=Na2O(s) △H=—414 kJ·mol-1
O2(g)=Na2O(s) △H=—414 kJ·mol-1II.2Na(s)+O2(g)=Na2O2(s) △H=—511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。

①补全图:图中A处应填入
②该反应需要加入铜—锌基催化剂。加入催化剂后,该反应的△H
II.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,根据要求回答相关问题:

(1)若在标准状况下,甲装置有448 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为
(2)若用隔膜法电解饱和食盐水生成NaClO,则X应用
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
您最近一年使用:0次
名校
2 . 下列说法正确的是
| A.当反应体系放热时其焓减小,ΔH为负值 |
| B.化学键断裂的能量是化学变化中能量变化的主要原因 |
| C.一个化学反应,不管是一步完成的还是分几步完成的,其反应热是不相同的 |
| D.苛性钠固体溶于水属于放热反应 |
您最近一年使用:0次
2021-07-07更新
|
232次组卷
|
3卷引用:黑龙江省大庆市铁人中学2020-2021学年高一下学期期末考试化学试题
名校
3 . 硅单质及其化合物应用范围很广。请回答下列问题:
(1)工业上用石英和焦炭可以制得粗硅。已知:
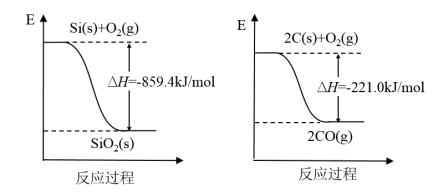
写出用石英和焦炭制取粗硅的热化学方程式_______ 。
(2)制备硅半导体材料必须先得到高纯硅:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
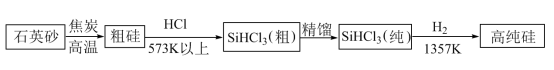
写出由纯SiHCl3制备高纯硅的化学反应方程式_______ 。整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和一种单质,写出该反应的化学方程式_______ 。
(3)对于反应2SiHCl3(g)⇌SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
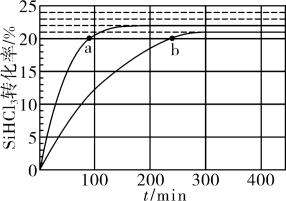
①323K时,反应的平衡转化率α=_______ 。平衡常数K323K=_______ (保留2位有效数字)。
②下列说法正确的是_______
A.平均分子量不变时,该反应一定达到平衡状态
B.a、b处反应速率:v(a)>v(b)
C.改进催化剂可以缩短达到平衡的时间
D.温度体积一定,加入SiHCl3可以提高SiHCl3的转化率
③已知SiHCl3分解反应速率v=v正-v逆=k正﹒x2(SiHCl3)-k逆﹒x(SiH2Cl2)﹒x(SiCl4),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算b处v正/v逆=_______ 。(保留2位小数)
(1)工业上用石英和焦炭可以制得粗硅。已知:

写出用石英和焦炭制取粗硅的热化学方程式
(2)制备硅半导体材料必须先得到高纯硅:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

写出由纯SiHCl3制备高纯硅的化学反应方程式
(3)对于反应2SiHCl3(g)⇌SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。

①323K时,反应的平衡转化率α=
②下列说法正确的是
A.平均分子量不变时,该反应一定达到平衡状态
B.a、b处反应速率:v(a)>v(b)
C.改进催化剂可以缩短达到平衡的时间
D.温度体积一定,加入SiHCl3可以提高SiHCl3的转化率
③已知SiHCl3分解反应速率v=v正-v逆=k正﹒x2(SiHCl3)-k逆﹒x(SiH2Cl2)﹒x(SiCl4),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算b处v正/v逆=
您最近一年使用:0次
4 . Ⅰ.钢铁容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一、可采用电化学防护技术减缓海水中钢铁设施的腐蚀,下图是钢铁桥墩部分防护原理示意图。
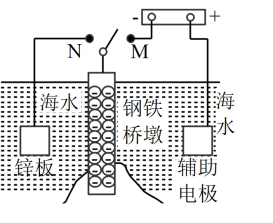
(1)K 与 M 连接时钢铁桥墩的电化学防护方法为___________ 。
(2)K与N连接时,钢铁桥墩为___________ 极(填"正"、"负"、"阴"或"阳"),电极反应式为___________ 。
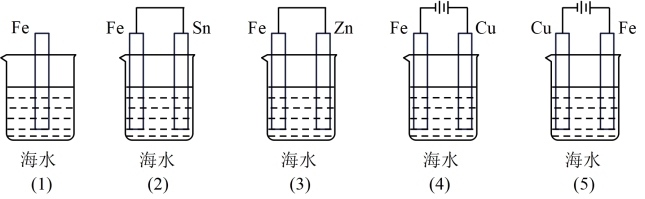
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是___________ 。
(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是__________ 。
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。
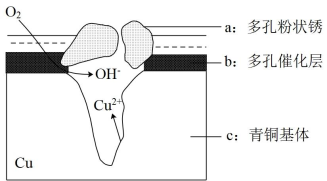
(1)腐蚀过程中,负极是___________ (填图中字母"a"或"b"或"c");
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为___________ 。
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为___________ L(标准状况)。

(1)K 与 M 连接时钢铁桥墩的电化学防护方法为
(2)K与N连接时,钢铁桥墩为
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是

(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。

(1)腐蚀过程中,负极是
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
2021-06-17更新
|
180次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题
名校
5 . NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题,研究NOx之间的转化也具有重要意义。
用水吸收NOx的相关热化学方程式如下:
(1)2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq)ΔH=-116.1kJ·mol-1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l)ΔH=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=____ kJ·mol-1。
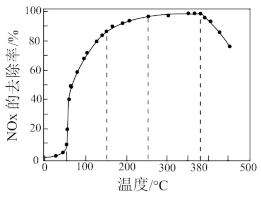
(2)已知反应2NO(g)+2CO(g) N2(g)+2CO2(g)。v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m=
N2(g)+2CO2(g)。v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m=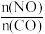 的关系如图所示。
的关系如图所示。

①达到平衡后,仅升高温度,k正增大的倍数__ (填“>”“<”或“=”)k逆增大的倍数。
②下列说法正确的是___ 。
A.投料比:m1<m2<m3
B.汽车排气管中的催化剂可提高NO的平衡转化率
C.当投料比m=2时,NO转化率比CO转化率小
D.当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
(3)已知:N2O4(g) 2NO2(g)ΔH>0将一定量N2O4气体充入刚性密闭容器中,控制反应温度为T1。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g)
2NO2(g)ΔH>0将一定量N2O4气体充入刚性密闭容器中,控制反应温度为T1。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g) 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=___ (对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(如图所示)。

反应相同时间NOx的去除率随反应温度的变化曲线如图所示。
在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升的主要原因是___ ;后来上升缓慢的主要原因是___ ;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___ 。
用水吸收NOx的相关热化学方程式如下:
(1)2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq)ΔH=-116.1kJ·mol-1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l)ΔH=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=
(2)已知反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)。v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m=
N2(g)+2CO2(g)。v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m=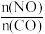 的关系如图所示。
的关系如图所示。
①达到平衡后,仅升高温度,k正增大的倍数
②下列说法正确的是
A.投料比:m1<m2<m3
B.汽车排气管中的催化剂可提高NO的平衡转化率
C.当投料比m=2时,NO转化率比CO转化率小
D.当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
(3)已知:N2O4(g)
 2NO2(g)ΔH>0将一定量N2O4气体充入刚性密闭容器中,控制反应温度为T1。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g)
2NO2(g)ΔH>0将一定量N2O4气体充入刚性密闭容器中,控制反应温度为T1。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g) 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(如图所示)。

反应相同时间NOx的去除率随反应温度的变化曲线如图所示。
在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升的主要原因是

您最近一年使用:0次
名校
6 . 硫是一种重要的非金属元素,正交硫(Orthogonal sulfur)是硫稳定存在的唯一形式,单斜硫是硫的同素异形体之一。下列说法不正确 的是
已知:①S(正交,s)+O2(g)=SO2(g)ΔH1=-296.83kJ•mol-1
②S(单斜,s)+O2(g)=SO2(g)ΔH2=-297.16kJ•mol-1
③S(单斜,s)=S(正交,s)ΔH3
已知:①S(正交,s)+O2(g)=SO2(g)ΔH1=-296.83kJ•mol-1
②S(单斜,s)+O2(g)=SO2(g)ΔH2=-297.16kJ•mol-1
③S(单斜,s)=S(正交,s)ΔH3
| A.硫黄是一种黄色晶体,不溶于水 |
| B.正交硫比单斜硫稳定 |
| C.ΔH3=-0.66kJ•mol -1, |
| D.1mol S(单斜,s)和1mol O2(g)的总能量高于1mol SO2(g)的能量 |
您最近一年使用:0次
2021-05-20更新
|
462次组卷
|
6卷引用:黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(理)试题
黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(理)试题重庆市普通高中学业水平选择性考试2021届高三第三次联合诊断检测化学试题河南省确山县第二高级中学2021-2022学年高三上学期期中考试化学试题云南省富源县第一中学2020-2021学年高二上学期9月月考化学试题(已下线)第03讲 盖斯定律(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)湖北省红安县第一中学2022-2023学年高二上学期9月考试化学试题
名校
7 . 合成气(CO、H2)是一种重要的化工原料气。合成气制取有多种方法,如煤的气化、天然气部分氧化等。回答下列问题:
I.合成气的制取
(1)煤的气化制取合成气
已知:①H2O(g)=H2O(l)△H=-44kJ/mol;②部分物质的燃烧热如下:
则反应C(s)+H2O(g)=CO(g)+H2(g)的△H=___ kJ/mol。
(2)天然气部分氧化制取合成气
如果用O2(g)、H2O(g)、CO2(g)混合物氧化CH4(g),欲使制得的合成气中只有CO、H2且二者物质的量之比为1︰2,则原混合物中H2O(g)与CO2(g)的物质的量之比为___ 。
Ⅱ.利用合成气合成乙醇
在一定温度下,向容积为2L的恒容密闭容器中投入2molCO和4molH2,发生反应2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)。
CH3CH2OH(g)+H2O(g)。
(1)写出该反应的平衡常数表达式K=__ 。
(2)下列物理量不再发生变化时,说明该反应达到平衡状态的是___ (填序号)。
a.压强 b.密度 c.平均摩尔质量 d.CO(g)与H2O(g)体积分数比
(3)反应起始压强记为P1、平衡后记为P2,平衡时H2的转化率为___ (用含P1、P2的代数式表示)。
I.合成气的制取
(1)煤的气化制取合成气
已知:①H2O(g)=H2O(l)△H=-44kJ/mol;②部分物质的燃烧热如下:
| 物质 | C(s) | CO(g) | H2(g) |
| 燃烧热(kJ/mol) | -393.5 | -283.0 | -285.8 |
(2)天然气部分氧化制取合成气
如果用O2(g)、H2O(g)、CO2(g)混合物氧化CH4(g),欲使制得的合成气中只有CO、H2且二者物质的量之比为1︰2,则原混合物中H2O(g)与CO2(g)的物质的量之比为
Ⅱ.利用合成气合成乙醇
在一定温度下,向容积为2L的恒容密闭容器中投入2molCO和4molH2,发生反应2CO(g)+4H2(g)
 CH3CH2OH(g)+H2O(g)。
CH3CH2OH(g)+H2O(g)。(1)写出该反应的平衡常数表达式K=
(2)下列物理量不再发生变化时,说明该反应达到平衡状态的是
a.压强 b.密度 c.平均摩尔质量 d.CO(g)与H2O(g)体积分数比
(3)反应起始压强记为P1、平衡后记为P2,平衡时H2的转化率为
您最近一年使用:0次
名校
8 . (1)在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9 kJ的热量。该反应的ΔH ___________ 0 (填“>”或“<”),对于石墨和金刚石,___________ 更稳定。
(2)用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
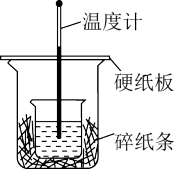
①从实验装置上看,图中尚缺少的一种玻璃用品是___________ 。
②大烧杯上如不盖硬纸板,测得的反应热数值___________ (填“偏大、偏小、无影响”)。
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的反应热的数值会___________ (填“偏大”、“偏小”、“无影响”)。
(3)在25℃、101 kPa下,1g CH3OH(l)完全燃烧生成CO2和液态水时放热22.68 kJ。写出表示CH3OH燃烧热的热化学方程式___________ 。
(4)已知几种化学键的键能如表所示:
则反应Cl2(g)+ 3F2(g) 2ClF3(g) 的ΔH =
2ClF3(g) 的ΔH =___________ kJ/mol
(5)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)=4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) =2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 = -1251 kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:___________ 。
(2)用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是
②大烧杯上如不盖硬纸板,测得的反应热数值
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的反应热的数值会
(3)在25℃、101 kPa下,1g CH3OH(l)完全燃烧生成CO2和液态水时放热22.68 kJ。写出表示CH3OH燃烧热的热化学方程式
(4)已知几种化学键的键能如表所示:
| 化学键 | Cl—Cl | F—F | Cl—F |
| 键能/ (kJ/mol) | 242 | 159 | 172 |
则反应Cl2(g)+ 3F2(g)
 2ClF3(g) 的ΔH =
2ClF3(g) 的ΔH =(5)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)=4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) =2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 = -1251 kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:
您最近一年使用:0次
名校
解题方法
9 . 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
I.探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
(1)CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1
CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1
(2)CO(g)+2H2(g) CH3OH(g)△H2=-90.4kJ·mol-1
CH3OH(g)△H2=-90.4kJ·mol-1
(3)CO(g)+H2O(g) CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
△H3=____ kJ·mol-1。
II.工业上可以由水煤气合成甲醇:CO(g)+2H2(g) CH3OH(g)一定条件下,向密闭容器中通入2molCO和4molH2,发生上述反应。
CH3OH(g)一定条件下,向密闭容器中通入2molCO和4molH2,发生上述反应。
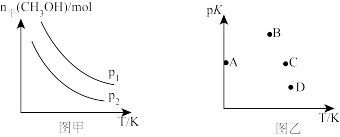
图甲中,压强p2___ p1(填“>”“<”或“=”),原因是___ 。
②图乙中,能正确反映A状态随温度升高pK(pK=-lgK)数值变化的点是___ 。
③该反应的正逆反应速率表达式:v正=k正·c(CO)·c2H2),v逆=k逆·c(CH3OH),k正、k逆为反应速率常数。在一定条件下,加入催化剂,反应速率常数___ (填“增大”、“减小”或“不变”下同);降低温度, 的值
的值___ 。
III.由CO2制备甲醇的过程可能涉及如下两个反应。
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H2
CH3OCH3(g)+3H2O(g)△H2
将3molCO2和3molH2混合后通入某恒温恒容密闭容器中发生上述反应,一段时间后达到平衡,测得容器压强为60MPa,容器中CH3OCH3为0.2mol,H2O为1mol,此时CH3OH的物质的量为___ ,反应Ⅰ的Kp=___ MPa-2(列出计算式,无需化简)。
I.探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
(1)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1
CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1(2)CO(g)+2H2(g)
 CH3OH(g)△H2=-90.4kJ·mol-1
CH3OH(g)△H2=-90.4kJ·mol-1(3)CO(g)+H2O(g)
 CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3△H3=
II.工业上可以由水煤气合成甲醇:CO(g)+2H2(g)
 CH3OH(g)一定条件下,向密闭容器中通入2molCO和4molH2,发生上述反应。
CH3OH(g)一定条件下,向密闭容器中通入2molCO和4molH2,发生上述反应。
图甲中,压强p2
②图乙中,能正确反映A状态随温度升高pK(pK=-lgK)数值变化的点是
③该反应的正逆反应速率表达式:v正=k正·c(CO)·c2H2),v逆=k逆·c(CH3OH),k正、k逆为反应速率常数。在一定条件下,加入催化剂,反应速率常数
 的值
的值III.由CO2制备甲醇的过程可能涉及如下两个反应。
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1反应Ⅱ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)△H2
CH3OCH3(g)+3H2O(g)△H2将3molCO2和3molH2混合后通入某恒温恒容密闭容器中发生上述反应,一段时间后达到平衡,测得容器压强为60MPa,容器中CH3OCH3为0.2mol,H2O为1mol,此时CH3OH的物质的量为
您最近一年使用:0次
解题方法
10 . 央广网消息:2020年大庆油田生产天然气46.6亿立方米,实现了“十连增”,在大战大考中交出了“当好标杆旗帜、建设百年油田”的新答卷。天然气的主要成分甲烷是一种重要的化工原料,广泛应用于民用和化工业生产中。回答下列问题:
(1)利用CH4超干重整CO2技术可得到富含CO的化工原料。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g)。∆H1=+196 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ∆H2=-484 kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ∆H3=-566 kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H=_______ 。
(2)在两个相同钢性密闭容器中充入CH4和CO2发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),CH4和CO2的分压均为20 kPa,加入催化剂Ni/α-Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图1所示。
2CO(g)+2H2(g),CH4和CO2的分压均为20 kPa,加入催化剂Ni/α-Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图1所示。

图1
①A点处v正_______ B点处v逆(填“<”、“>”或“=”)。
②用单位时间内气体分压的变化来表示反应速率,即v= ,T2℃下,上述反应0~2min内平均反应速率v(CH4)=
,T2℃下,上述反应0~2min内平均反应速率v(CH4)=_______ kPa·min-1。(分压=总压×物质的量分数)
③上述反应达到平衡后,下列变化一定能使平衡向正向移动的是_____
A.通入惰性气体使容器内压强增大 B.正反应速率加快
C.平衡常数K变大 D.增大催化剂表面积
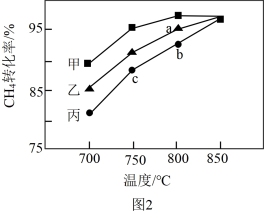
(3)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得甲烷转化率随温度变化如图2所示。三种催化剂作用下,反应活化能最大的是_______ (填“甲”、“乙”或“丙”);CH4的转化率b点高于c点的原因是_______ 。
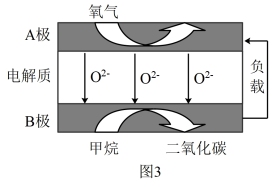
(4)我国科学家设计的新型甲烷燃料电池能量密度高、成本低,其工作原理如图3所示。B极电极反应式为_______ 。
(1)利用CH4超干重整CO2技术可得到富含CO的化工原料。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g)。∆H1=+196 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ∆H2=-484 kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ∆H3=-566 kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H=
(2)在两个相同钢性密闭容器中充入CH4和CO2发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g),CH4和CO2的分压均为20 kPa,加入催化剂Ni/α-Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图1所示。
2CO(g)+2H2(g),CH4和CO2的分压均为20 kPa,加入催化剂Ni/α-Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图1所示。
图1
①A点处v正
②用单位时间内气体分压的变化来表示反应速率,即v=
 ,T2℃下,上述反应0~2min内平均反应速率v(CH4)=
,T2℃下,上述反应0~2min内平均反应速率v(CH4)=③上述反应达到平衡后,下列变化一定能使平衡向正向移动的是
A.通入惰性气体使容器内压强增大 B.正反应速率加快
C.平衡常数K变大 D.增大催化剂表面积
(3)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得甲烷转化率随温度变化如图2所示。三种催化剂作用下,反应活化能最大的是

(4)我国科学家设计的新型甲烷燃料电池能量密度高、成本低,其工作原理如图3所示。B极电极反应式为

您最近一年使用:0次



