名校
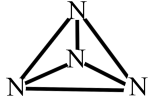
1 . 已知:①N4分子的结构式如图所示;②N—N键的键能为167kJ·mol-1,N≡N键的键能为942kJ·mol-1;③N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ·mol-1。则反应N4(g)+6H2(g)=4NH3(g)的△H为
2NH3(g) △H=-92.2kJ·mol-1。则反应N4(g)+6H2(g)=4NH3(g)的△H为
 2NH3(g) △H=-92.2kJ·mol-1。则反应N4(g)+6H2(g)=4NH3(g)的△H为
2NH3(g) △H=-92.2kJ·mol-1。则反应N4(g)+6H2(g)=4NH3(g)的△H为
| A.-1066.4kJ·mol-1 | B.+1066.4kJ·mol-1 |
| C.+697.6kJ·mol-1 | D.-697.6kJ·mol-1 |
您最近一年使用:0次
2021-09-10更新
|
558次组卷
|
4卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高二上学期第一次月考化学试题
黑龙江省哈尔滨市第六中学2021-2022学年高二上学期第一次月考化学试题重庆市第一中学校 2021-2022学年高二上学期入学摸底考试化学试题新疆阜康市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题02 化学变化中的能量变化(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)
名校
2 . 下列说法或表示正确的是
| A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)→C(金刚石) ΔH=+1.9kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,若将含1molCH3COOH的醋酸溶液与含1molNaOH的溶液混合,放出的热量小于57.3kJ |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1 |
您最近一年使用:0次
2021-09-07更新
|
1951次组卷
|
10卷引用:大庆市肇州县肇州中学2021-2022学年高二上学期第二次月考化学试题
大庆市肇州县肇州中学2021-2022学年高二上学期第二次月考化学试题(已下线)第1章 化学反应的热效应(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)广西百色市德保高中2021-2022学年高二上学期段考化学试题江苏省盐城市田家炳中学2021-2022学年高二上学期期中考试化学(选修)试题湖南省衡阳师范学院祁东附属中学2019-2020学年高二上学期期中考试化学试题辽宁省铁岭市清河高级中学2021-2022学年高一下学期第三次阶段考试化学试题辽宁省铁岭市清河高级中学2021-2022学年高一下学期第三次阶段考试化学试题(已下线)化学反应的热效应——进阶学习广西壮族自治区梧州市苍梧中学2022-2023学年高二上学期11月月考化学试题浙江省温州市2023-2024学年温州新力量联盟期中联考高二上学期化学试题卷
名校
3 . CO2储量大,是常见的温室效应气体,其综合利用意义深远。
CO2与H2制CH3OH可能发生如下反应:
(i)CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41.1kJ·mol-1
(ii)CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-162kJ·mol-1
(iii)CO(g)+2H2(g)=CH3OH(g) △H3=-90.1kJ·mol-1
(iv)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H4
(1)反应(iv)自发进行的条件是:___ 。
(2)科学研究工作者研究了不同外界条件与CH3OH产率或不同产物选择性的关系,如图所示。
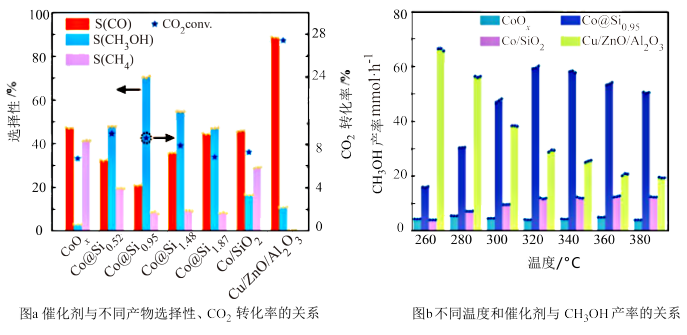
由上述可知,合适的催化剂及其适宜温度分别为___ 、___ 。
(3)以铜基催化剂催化CO2加氢制甲醇可能的反应历程存在如下步骤(*表示催化剂的活性中心,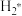 表示H2在催化剂表面的吸附态):
表示H2在催化剂表面的吸附态):
①H2(g)+*→H2*②H2*+*→2H*③CO2(g)+*→CO2*④CO2*+H*→HCO2*⑤HCO2*+H*→H2CO*+O*⑥____⑦H3CO*+H*→CH3OH*+*⑧CH3OH*→CH3OH(g)+*⑨O*+H*→OH*+*⑩OH*+H*→H2O*+*
请写出步骤⑥的化学方程式为___ 。
反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)在恒温恒压条件下进行,能证明反应达到平衡状态标志的是:
CH3OH(g)+H2O(g)在恒温恒压条件下进行,能证明反应达到平衡状态标志的是: ___ 。
A.混合气体的密度不变
B.甲醇的体积分数不变
C.相同时间内二氧化碳的消耗速率等于甲醇的生成速率
D.反应体系的温度不再变化
(4)恒温恒压下发生CO2(g)+3H2(g) CH3OH(g)+H2O(g)反应,欲增大甲醇的产量,一定可行的措施有
CH3OH(g)+H2O(g)反应,欲增大甲醇的产量,一定可行的措施有___ 。
(5)200℃时,将0.200molCO2和0.400molH2充入压强恒定为P的密闭容器中,发生CO2(g)+3H2(g) CH3OH(g)+H2O(g)反应。在催化剂作用下,CO2的最高转化率为50%,则此温度下该反应的平衡常数Kp=
CH3OH(g)+H2O(g)反应。在催化剂作用下,CO2的最高转化率为50%,则此温度下该反应的平衡常数Kp=___ 。平衡时,保持压强P恒定不变,再向体系里充入0.200molCO2和0.100mol水蒸气,反应向___ 方向进行。(选填“正反应,逆反应,保持平衡”)
CO2与H2制CH3OH可能发生如下反应:
(i)CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41.1kJ·mol-1
(ii)CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-162kJ·mol-1
(iii)CO(g)+2H2(g)=CH3OH(g) △H3=-90.1kJ·mol-1
(iv)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H4
(1)反应(iv)自发进行的条件是:
| A.低温自发 | B.高温自发 |
| C.任何条件都能自发 | D.任何条件都不能自发 |

由上述可知,合适的催化剂及其适宜温度分别为
(3)以铜基催化剂催化CO2加氢制甲醇可能的反应历程存在如下步骤(*表示催化剂的活性中心,
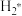 表示H2在催化剂表面的吸附态):
表示H2在催化剂表面的吸附态):①H2(g)+*→H2*②H2*+*→2H*③CO2(g)+*→CO2*④CO2*+H*→HCO2*⑤HCO2*+H*→H2CO*+O*⑥____⑦H3CO*+H*→CH3OH*+*⑧CH3OH*→CH3OH(g)+*⑨O*+H*→OH*+*⑩OH*+H*→H2O*+*
请写出步骤⑥的化学方程式为
反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)在恒温恒压条件下进行,能证明反应达到平衡状态标志的是:
CH3OH(g)+H2O(g)在恒温恒压条件下进行,能证明反应达到平衡状态标志的是: A.混合气体的密度不变
B.甲醇的体积分数不变
C.相同时间内二氧化碳的消耗速率等于甲醇的生成速率
D.反应体系的温度不再变化
(4)恒温恒压下发生CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)反应,欲增大甲醇的产量,一定可行的措施有
CH3OH(g)+H2O(g)反应,欲增大甲醇的产量,一定可行的措施有| A.向体系中通入CO2 |
| B.移走甲醇 |
| C.移走H2O(g) |
| D.与初始投料等物质的量的通入CO2、H2 |
 CH3OH(g)+H2O(g)反应。在催化剂作用下,CO2的最高转化率为50%,则此温度下该反应的平衡常数Kp=
CH3OH(g)+H2O(g)反应。在催化剂作用下,CO2的最高转化率为50%,则此温度下该反应的平衡常数Kp=
您最近一年使用:0次
名校
4 . O2PtF6是一种深红色固体,由英国化学家巴特列克发现,属于离子化合物,其晶体可用O PtF
PtF (s)表示。该晶体形成过程中的能量变化如图所示:(已知△H<0)
(s)表示。该晶体形成过程中的能量变化如图所示:(已知△H<0)
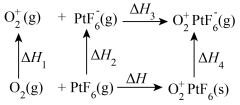
下列说法正确的是
 PtF
PtF (s)表示。该晶体形成过程中的能量变化如图所示:(已知△H<0)
(s)表示。该晶体形成过程中的能量变化如图所示:(已知△H<0)
下列说法正确的是
| A.△H1<0,△H2>0 | B.△H+△H1+△H2+△H3+△H4=0 |
| C.△H3<0,△H4>0 | D.△H4<△H1+△H2+△H3 |
您最近一年使用:0次
2021-09-05更新
|
221次组卷
|
3卷引用:黑龙江省哈尔滨市第九中学校2022届高三上学期适应性考试化学试题
名校
解题方法
5 . 氯气是一种重要的化工原料。
(1)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,例如,工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4.已知:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+175.4kJ·mol-1;KI=3.4×10-29
2C(s)+O2(g)=2CO(g) ΔH2=-220.9kJ·mol-1;KII=1.2×1048
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______ 。结合数据说明 氯化过程中加碳的理由_______ 。
(2)Cl2合成有机物时会产生副产物HCl。4HCl+O2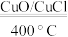 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
①若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是_______
a.v(HCl)=2v(Cl2)
b.4v正(HCl)=v逆(O2)
c.又加入1molO2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
②下图是该反应两种投料比[n(HCl):n(O2)分别为4:1和2:1]下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是_______ 。
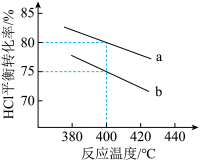
a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq)+H2O(l)⇌H+(aq)+Cl-(aq)+HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH1_______ 0(填”>”、“=”或“<”)。
②平衡常数K2的表达式为K2=_______ 。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=_______ 。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol·L-1,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是___。
(1)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,例如,工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4.已知:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1=+175.4kJ·mol-1;KI=3.4×10-29
2C(s)+O2(g)=2CO(g) ΔH2=-220.9kJ·mol-1;KII=1.2×1048
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:
(2)Cl2合成有机物时会产生副产物HCl。4HCl+O2
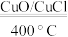 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。①若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是
a.v(HCl)=2v(Cl2)
b.4v正(HCl)=v逆(O2)
c.又加入1molO2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
②下图是该反应两种投料比[n(HCl):n(O2)分别为4:1和2:1]下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是

a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq)+H2O(l)⇌H+(aq)+Cl-(aq)+HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH1
②平衡常数K2的表达式为K2=
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=
(4)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol·L-1,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是___。
| A.适当提高反应温度 | B.改变催化剂 |
| C.适当降低反应温度 | D.改变反应物浓度 |
您最近一年使用:0次
名校
解题方法
6 . 氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ∆H=-67.7kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ∆H=-57.3kJ·mol-1
25℃时,在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,测得混合溶液的pH变化曲线如下图所示,下列说法正确的是

①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ∆H=-67.7kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ∆H=-57.3kJ·mol-1
25℃时,在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,测得混合溶液的pH变化曲线如下图所示,下列说法正确的是

| A.氢氟酸的电离方程式及热效应可表示为:HF(aq)⇌F-(aq)+H+(aq) ∆H=+10.4kJ·mol-1 |
| B.在①点时pH=6,溶液中:c(F-)-c(Na+)=9.9×10-7mol/L |
| C.在②点时,溶液中:c(F-)<c(Na+) |
| D.在③点时V=20mL,溶液中:c(F-)<c(Na+)=0.1mol/L |
您最近一年使用:0次
7 . 丙烷经催化脱氢可制丙烯:C3H8 C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol
下列说法不正确的是
 C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。
C3H6+H2。600℃,将一定浓度的 CO2与固定浓度的C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和H2浓度随初始 CO2浓度的变化关系如图。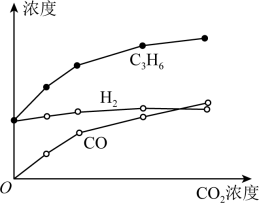
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ/mol
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H=-2058kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol
下列说法不正确的是
| A.C3H8(g)=C3H6(g)+H2(g) △H=+124kJ/mol |
B.c(H2)和c(C3H6)变化差异的原因:CO2+H2 CO+H2O CO+H2O |
| C.其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率越大 |
| D.若体系只有C3H6、CO、H2和H2O生成,则初始物质浓度c0与流出物质浓度c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6) |
您最近一年使用:0次
2021-09-03更新
|
8022次组卷
|
24卷引用:黑龙江省哈尔滨德强学校2021-2022高三(清北班)上学期期中线下考试化学试题
黑龙江省哈尔滨德强学校2021-2022高三(清北班)上学期期中线下考试化学试题2021年新高考北京化学高考真题山东省实验中学2022届高三第一次诊断考试化学试题山东省潍坊市第四中学2021-2022学年高二上学期10月检测化学试卷2021年北京高考化学试题变式题11-19山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题(已下线)秘籍07 化学反应速率及平衡图象剖析-备战2022年高考化学抢分秘籍(全国通用)(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)微专题38 新情景下的综合图象与突破-备战2023年高考化学一轮复习考点微专题(已下线)易错点18 化学反应与能量-备战2023年高考化学考试易错题河北省昌黎第一中学2023届高三下学期开学考试化学试题(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)第12练 有关反应热的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)章末综合评价(七)北京市第一○一中学2023-2024学年高二上学期期中练习化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题(已下线)选择题16-20北京市第一六一中学2023-2024学年高二上学期期中阶段练习化学试题北京师范大学第二附属中学2023-2024学年高二上学期12月月考化学试题 (已下线)北京市第四中学2023-2024学年高三上学期期中考试化学试题(已下线)北京市第四中学2023-2024学年高三上学期 期中化学试卷2024届河北省部分高中高三下学期三模化学试题
8 . 根据热化学的相关知识,进行填空:
(1)煤燃烧的反应热可通过以下两个途径计算得到:a.煤在充足的空气中直接燃烧;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程涉及的热化学方程式为
a.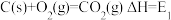 ①
①
b. ②
②
c.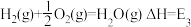 ③
③
d.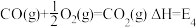 ④
④
E1、E2、E3、E4之间的关系可表示为E2=___________ ;
(2)图乙为常温常压下1molNO2和1molCO完全反应生成CO2和NO过程中的能量变化示意图,该反应为___________ (填“放热反应”或“吸热反应”);请写出NO2和CO反应的热化学方程式:___________ ;
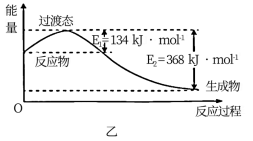
(3)化学反应的焓变与反应物和生成物的键能有关。已知某些化学键的键能数据如下表所示:
则反应 的焓变
的焓变
___________ 。
(4)实验室用5mL0.50mol/L盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定混合液温度升高的情况计算中和反应的反应热。

该装置缺少一种玻璃仪器,该仪器的名称为___________ ;实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应选择___________ mol/L的溶液进行实验。
(1)煤燃烧的反应热可通过以下两个途径计算得到:a.煤在充足的空气中直接燃烧;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程涉及的热化学方程式为
a.
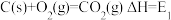 ①
①b.
 ②
②c.
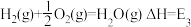 ③
③d.
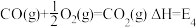 ④
④E1、E2、E3、E4之间的关系可表示为E2=
(2)图乙为常温常压下1molNO2和1molCO完全反应生成CO2和NO过程中的能量变化示意图,该反应为

(3)化学反应的焓变与反应物和生成物的键能有关。已知某些化学键的键能数据如下表所示:
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ/mol) | 436 | 247 | 434 |
则反应
 的焓变
的焓变
(4)实验室用5mL0.50mol/L盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定混合液温度升高的情况计算中和反应的反应热。

该装置缺少一种玻璃仪器,该仪器的名称为
您最近一年使用:0次
名校
9 . 回答下列问题:
(1)在1 200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+ O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1
2H2S(g)+SO2(g)= S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
H2S(g)+ O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH3
2S(g)=S2(g) ΔH4
则用ΔH1、ΔH2、ΔH3来表示ΔH4的表达式为___________ 。
(2)已知甲烷能催化还原NO2,得到氮气、二氧化碳和水蒸气,且知反应消耗1.6 g甲烷时,放出热量86.7 kJ,写出甲烷催化还原NO2的热化学方程式___________ 。
(3)已知: N2(g)+O2(g) 2NO(g) △H1 =+180.5kJ·mol-1
2NO(g) △H1 =+180.5kJ·mol-1
C(s)+O2(g) CO2(g) △H2 =-393.5kJ·mol-1
CO2(g) △H2 =-393.5kJ·mol-1
2C(s)+O2(g) 2CO(g) △H3 =-221.0kJ·mol-1
2CO(g) △H3 =-221.0kJ·mol-1
若某反应的平衡常数表达式为K=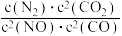 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
(4)利用如图所示装置测定中和热的实验步骤如下:
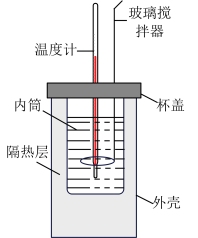
步骤一:用量筒量取50 mL 0.50 mol·L−1盐酸倒入小烧杯中,测出盐酸温度;
步骤二:用另一量筒量取50 mL 0.55 mol·L−1 NaOH溶液,并用同一温度计测出其温度;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
①现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1 mol·L−1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___________ 。
②假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18 J·g−1·℃−1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=___________ (结果保留一位小数)。
③该同学通过实验测出的中和热有误差,造成这一结果的原因不可能的是___________ 。
A.实验装置保温、隔热效果差 B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中 D.用测量盐酸的温度计直接测定NaOH溶液的温度
(1)在1 200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+
 O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1 2H2S(g)+SO2(g)=
 S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2H2S(g)+
 O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH3 2S(g)=S2(g) ΔH4
则用ΔH1、ΔH2、ΔH3来表示ΔH4的表达式为
(2)已知甲烷能催化还原NO2,得到氮气、二氧化碳和水蒸气,且知反应消耗1.6 g甲烷时,放出热量86.7 kJ,写出甲烷催化还原NO2的热化学方程式
(3)已知: N2(g)+O2(g)
 2NO(g) △H1 =+180.5kJ·mol-1
2NO(g) △H1 =+180.5kJ·mol-1C(s)+O2(g)
 CO2(g) △H2 =-393.5kJ·mol-1
CO2(g) △H2 =-393.5kJ·mol-12C(s)+O2(g)
 2CO(g) △H3 =-221.0kJ·mol-1
2CO(g) △H3 =-221.0kJ·mol-1若某反应的平衡常数表达式为K=
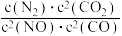 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)利用如图所示装置测定中和热的实验步骤如下:

步骤一:用量筒量取50 mL 0.50 mol·L−1盐酸倒入小烧杯中,测出盐酸温度;
步骤二:用另一量筒量取50 mL 0.55 mol·L−1 NaOH溶液,并用同一温度计测出其温度;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
①现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1 mol·L−1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
②假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18 J·g−1·℃−1。为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
③该同学通过实验测出的中和热有误差,造成这一结果的原因不可能的是
A.实验装置保温、隔热效果差 B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中 D.用测量盐酸的温度计直接测定NaOH溶液的温度
您最近一年使用:0次
2021-08-26更新
|
534次组卷
|
2卷引用:黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题
名校
10 . 向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法不正确的是
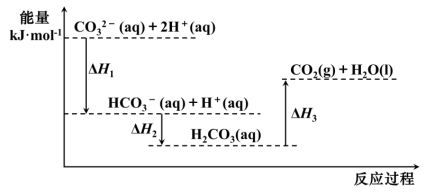

A.反应HCO (aq)+H+(aq)=CO2(g)+H2O(l)为吸热反应 (aq)+H+(aq)=CO2(g)+H2O(l)为吸热反应 |
| B.ΔH1<ΔH2,ΔH2<ΔH3 |
C.CO (aq)+2H+(aq)=CO2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3 (aq)+2H+(aq)=CO2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3 |
| D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则ΔH3变小 |
您最近一年使用:0次



