名校
1 . 某温度下,在 恒容密闭容器中投入一定量的A、B,发生反应:
恒容密闭容器中投入一定量的A、B,发生反应: ,
, 时生成C的物质的量为
时生成C的物质的量为 (反应进程如图所示)。
(反应进程如图所示)。
下列说法中不正确 的是
 恒容密闭容器中投入一定量的A、B,发生反应:
恒容密闭容器中投入一定量的A、B,发生反应: ,
, 时生成C的物质的量为
时生成C的物质的量为 (反应进程如图所示)。
(反应进程如图所示)。下列说法中
A.方程式中  |
B. 后, 后,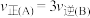 |
C.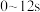 内混合气体的密度随反应进行而减小 内混合气体的密度随反应进行而减小 |
D. 内,D的平均反应速率为 内,D的平均反应速率为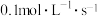 |
您最近一年使用:0次
2024-04-15更新
|
1349次组卷
|
2卷引用:河北省沧州市泊头市第一中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
2 . 氮的单质及其化合物的综合利用是目前社会普遍关注的热点之一。
已知:Ⅰ.N2(g)+3H2(g) 2NH3(g) △H1=-92.4kJ/mol;
2NH3(g) △H1=-92.4kJ/mol;
Ⅱ.N2(g)+O2(g) 2NO(g) △H2=+180.0kJ/mol;
2NO(g) △H2=+180.0kJ/mol;
Ⅲ.2NO(g)+O2(g) 2NO2(g) △H3=-113.0kJ/mol。
2NO2(g) △H3=-113.0kJ/mol。
回答下列问题:
(1)已知反应Ⅲ中的NO(g)和O2(g)经步骤1和步骤2转化为NO2(g),该过程的能量变化如图所示: N2O4(g) △H4=-akJ/mol,平衡常数K1;
N2O4(g) △H4=-akJ/mol,平衡常数K1;
步骤2:______________ △H5,平衡常数K2;
①步骤2对应反应的热化学方程式为:______________ 。
②反应Ⅲ的平衡常数K=____ (用含K1、K2的代数式表示)。
下列措施既能提高反应Ⅲ的平衡转化率,又能加快生成NO2的反应速率的是______ (填字母)。
a.升高温度 b.缩小容器体积 c.加入催化剂
(2)在不同压强下,向密闭容器中充入物质的量分数(物质i的物质的量分数:xi=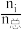 ×100%)分别为67.5%、22.5%、10.0%的H2、N2和Ar的混合气体发生反应I,测得NH3的平衡物质的量分数x(NH3)与温度T、压强p的关系如图所示。
×100%)分别为67.5%、22.5%、10.0%的H2、N2和Ar的混合气体发生反应I,测得NH3的平衡物质的量分数x(NH3)与温度T、压强p的关系如图所示。_______ v逆(b)填“>”“<”或“=”)。
②曲线L2对应p2压强下,x(NH3)=25%时,N2的转化率α=_____ %(保留三位有效数字)。
③若维持起始曲线L2对应的外界条件不变时,以x(H2)=75%、x(N2)=25%进行重复实验,则曲线L2是否可移至曲线L4:______ (填“是”或“否”),理由为__________ 。
(3)一定温度下,向5L恒容密闭容器中充入5molN2、5molH2、1molO2,发生反应I、Ⅱ、Ⅲ。实验测得反应前容器内气体压强为p0MPa。10min末达到平衡时N2的转化率为30%,NH3和NO2物质的量分别为2mol、0.8mol。
①0~10min内平均反应速率v(O2)=________ mol/(L·min)。
②反应Ⅱ的Kp=_______ (Kp是用分压表示的平衡常数,保留三位有效数字)。
③提高反应Ⅰ选择性的有效措施为____________ 。
已知:Ⅰ.N2(g)+3H2(g)
 2NH3(g) △H1=-92.4kJ/mol;
2NH3(g) △H1=-92.4kJ/mol;Ⅱ.N2(g)+O2(g)
 2NO(g) △H2=+180.0kJ/mol;
2NO(g) △H2=+180.0kJ/mol;Ⅲ.2NO(g)+O2(g)
 2NO2(g) △H3=-113.0kJ/mol。
2NO2(g) △H3=-113.0kJ/mol。回答下列问题:
(1)已知反应Ⅲ中的NO(g)和O2(g)经步骤1和步骤2转化为NO2(g),该过程的能量变化如图所示:

 N2O4(g) △H4=-akJ/mol,平衡常数K1;
N2O4(g) △H4=-akJ/mol,平衡常数K1;步骤2:______________ △H5,平衡常数K2;
①步骤2对应反应的热化学方程式为:
②反应Ⅲ的平衡常数K=
下列措施既能提高反应Ⅲ的平衡转化率,又能加快生成NO2的反应速率的是
a.升高温度 b.缩小容器体积 c.加入催化剂
(2)在不同压强下,向密闭容器中充入物质的量分数(物质i的物质的量分数:xi=
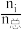 ×100%)分别为67.5%、22.5%、10.0%的H2、N2和Ar的混合气体发生反应I,测得NH3的平衡物质的量分数x(NH3)与温度T、压强p的关系如图所示。
×100%)分别为67.5%、22.5%、10.0%的H2、N2和Ar的混合气体发生反应I,测得NH3的平衡物质的量分数x(NH3)与温度T、压强p的关系如图所示。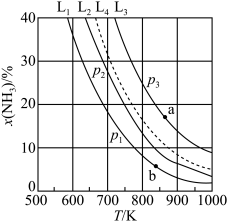
②曲线L2对应p2压强下,x(NH3)=25%时,N2的转化率α=
③若维持起始曲线L2对应的外界条件不变时,以x(H2)=75%、x(N2)=25%进行重复实验,则曲线L2是否可移至曲线L4:
(3)一定温度下,向5L恒容密闭容器中充入5molN2、5molH2、1molO2,发生反应I、Ⅱ、Ⅲ。实验测得反应前容器内气体压强为p0MPa。10min末达到平衡时N2的转化率为30%,NH3和NO2物质的量分别为2mol、0.8mol。
①0~10min内平均反应速率v(O2)=
②反应Ⅱ的Kp=
③提高反应Ⅰ选择性的有效措施为
您最近一年使用:0次
名校
解题方法
3 . T℃时,往2L的恒容密闭容器中充入 ,发生反应
,发生反应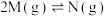 ,7min时仅改变某一条件,
,7min时仅改变某一条件, 的浓度随时间的变化曲线如图,下列说法正确的是
的浓度随时间的变化曲线如图,下列说法正确的是
 ,发生反应
,发生反应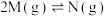 ,7min时仅改变某一条件,
,7min时仅改变某一条件, 的浓度随时间的变化曲线如图,下列说法正确的是
的浓度随时间的变化曲线如图,下列说法正确的是
| A.5min时,该反应的反应速率为零 |
B.7min时,改变的条件是再充入一部分 |
C.5min时,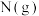 的体积分数约为28.6% 的体积分数约为28.6% |
D.7~10min内,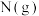 的平均反应速率 的平均反应速率 |
您最近一年使用:0次
名校
4 . 能量、速率与限度是认识和研究化学反应的重要视角。下列说法错误的是
| A.热值是指一定条件下1mol可燃物完全燃烧所放出的热量 |
| B.化学反应速率是用来衡量化学反应快慢的物理量 |
| C.化学反应的过程中一定伴随着能量的变化 |
| D.需要在高温条件下进行的化学反应不一定属于吸热反应 |
您最近一年使用:0次
名校
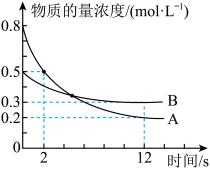
5 . 工业上,常用离子交换法软化自来水,其原理是 ,
, 。常温下,向一定体积的自来水中加入离子交换树脂(NaR),测得自来水中
。常温下,向一定体积的自来水中加入离子交换树脂(NaR),测得自来水中 变化如图所示。下列叙述正确的是
变化如图所示。下列叙述正确的是
 ,
, 。常温下,向一定体积的自来水中加入离子交换树脂(NaR),测得自来水中
。常温下,向一定体积的自来水中加入离子交换树脂(NaR),测得自来水中 变化如图所示。下列叙述正确的是
变化如图所示。下列叙述正确的是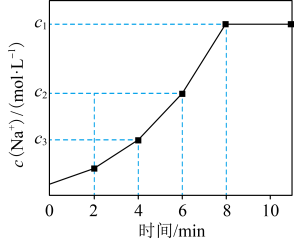
| A.反应达到平衡后,加入少量NaCl,离子交换反应的平衡常数减小 |
| B.6 min时的逆反应速率大于4 min时的逆反应速率 |
| C.其他条件不变时,10 min时离子交换反应已停止 |
D.4~8 min内平均反应速率: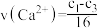 mol⋅L mol⋅L ⋅min ⋅min |
您最近一年使用:0次
2024-04-10更新
|
413次组卷
|
3卷引用:河北省部分学校2023-2024学年高三下学期4月联考化学试题
6 . 恒温下在2L密闭容器中,X、Y、Z三种气态物质的量随时间变化曲线如图。

(1)该反应的化学方程式为________ 。
(2)从开始至5min,Y的平均反应速率为________ ;平衡时,Z的物质的量浓度为________ ,X的转化率为________ 。
(3)反应达平衡时体系的压强是开始时的________ 倍。
(4)下列描述中能表明反应已达到平衡状态的是________ (填序号)。
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤Z 的物质的量浓度不变
的物质的量浓度不变
⑥容器内X、Y、Z三种气体的浓度之比为3:1:2
⑦某时刻 且不等于零 ⑧单位时间内生成2nmolZ,同时生成3nmolX
且不等于零 ⑧单位时间内生成2nmolZ,同时生成3nmolX
(5)在某一时刻采取下列措施能加快反应速率的是________。

(1)该反应的化学方程式为
(2)从开始至5min,Y的平均反应速率为
(3)反应达平衡时体系的压强是开始时的
(4)下列描述中能表明反应已达到平衡状态的是
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤Z
 的物质的量浓度不变
的物质的量浓度不变⑥容器内X、Y、Z三种气体的浓度之比为3:1:2
⑦某时刻
 且不等于零 ⑧单位时间内生成2nmolZ,同时生成3nmolX
且不等于零 ⑧单位时间内生成2nmolZ,同时生成3nmolX(5)在某一时刻采取下列措施能加快反应速率的是________。
| A.加催化剂 | B.降低温度 |
| C.体积不变,充入X | D.体积不变,从容器中分离出Y |
您最近一年使用:0次
解题方法
7 . 研究化学反应中的能量变化可以为提高工业生产效率提供指导性的理论依据。请结合所学化学反应原理相关知识回答下列问题:
(1)计算化学反应中的能量变化有多种途径。
①通过化学键的键能计算。已知:
计算可得:

_______  。
。
②通过盖斯定律计算。已知:

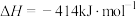

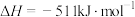
写出 与
与 反应生成
反应生成 的热化学方程式:
的热化学方程式:_______ 。
(2)实现“节能减排”和“低碳经济”的一项重要课题就是将 转化为可利用的资源,工业上有一种方法是用
转化为可利用的资源,工业上有一种方法是用 来生产燃料甲醇。已知:
来生产燃料甲醇。已知:
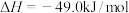 ,在一定条件下,向体积固定为1L的密闭容器中充入
,在一定条件下,向体积固定为1L的密闭容器中充入 和
和 ,测得
,测得 气体和
气体和 的浓度随时间变化曲线如图所示。
的浓度随时间变化曲线如图所示。

①该反应的熵变_______ 0(填大于、小于或等于)。
②反应开始至平衡时,反应速率
_______ 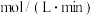 。
。
③为了加快化学反应速率,只改变下列某一条件,可采取的措施有_______ (填序号)。
A.升高温度 B.扩大容器体积 C.再充入 气体 D.使用合适的催化剂
气体 D.使用合适的催化剂
④催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
根据上表所给数据,用 生产甲醇的最优选项为
生产甲醇的最优选项为_______ (填序号)。
(1)计算化学反应中的能量变化有多种途径。
①通过化学键的键能计算。已知:
| 化学键 |  |  |  |
键能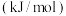 | 436 | 247 | 434 |


 。
。②通过盖斯定律计算。已知:

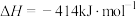

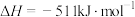
写出
 与
与 反应生成
反应生成 的热化学方程式:
的热化学方程式:(2)实现“节能减排”和“低碳经济”的一项重要课题就是将
 转化为可利用的资源,工业上有一种方法是用
转化为可利用的资源,工业上有一种方法是用 来生产燃料甲醇。已知:
来生产燃料甲醇。已知:
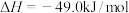 ,在一定条件下,向体积固定为1L的密闭容器中充入
,在一定条件下,向体积固定为1L的密闭容器中充入 和
和 ,测得
,测得 气体和
气体和 的浓度随时间变化曲线如图所示。
的浓度随时间变化曲线如图所示。
①该反应的熵变
②反应开始至平衡时,反应速率

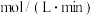 。
。③为了加快化学反应速率,只改变下列某一条件,可采取的措施有
A.升高温度 B.扩大容器体积 C.再充入
 气体 D.使用合适的催化剂
气体 D.使用合适的催化剂④催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
| 实验编号 | 温度(K) | 催化剂 |  转化率(%) 转化率(%) | 甲醇选择性(%) |
| A | 543 |  纳米棒 纳米棒 | 12.3 | 42.3 |
| B | 543 |  纳米片 纳米片 | 11.9 | 72.7 |
| C | 553 |  纳米棒 纳米棒 | 15.3 | 39.1 |
| D | 553 |  纳米片 纳米片 | 12.0 | 70.6 |
 生产甲醇的最优选项为
生产甲醇的最优选项为
您最近一年使用:0次
名校
解题方法
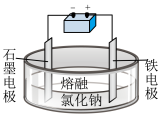
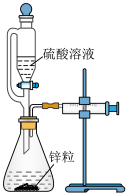
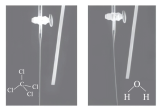
8 . 以下实验目的、方法和相关解释都正确的是
| 选项 | 实验目的 | 实验方法 | 相关解释 |
| A | 电解熔融氯化钠 |
| 该装置阳极反应为2Cl--2e-=Cl2 |
| B | 金属防腐 |
| 该图采用的是外加电流法对铁管道进行保护 |
| C | 测量锌粒和不同浓度的硫酸溶液反应速率的快慢 |
| 该实验用到的实验仪器有恒压滴液漏斗、锥形瓶、双孔塞、注射器 |
| D | 验证分子极性 |
| 该实验是用毛皮摩擦过的橡胶棒靠近 和 和 ,由图中现象可知 ,由图中现象可知 为非极性分子, 为非极性分子, 为极性分子 为极性分子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-05更新
|
267次组卷
|
4卷引用:2024届河北省雄安新区雄安部分高中高三下学期一模化学试题
9 . 一氯甲烷广泛用作溶剂、提取剂、推进剂、制冷剂、甲基化试剂,用于生产农药、医药等。600K时, 和
和 作用生成
作用生成 ,
, 可继续反应生成
可继续反应生成 。反应原理如下:
。反应原理如下:
①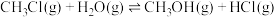

②
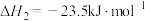
(1)已知反应①中相关化学键的键能数据如表:
则
___________  。
。
上述反应体系在一定条件下建立平衡后,下列说法正确的是___________ (填标号)。
A.升高温度反应①正向移动,反应②逆向移动
B.加入反应①的催化剂,可以降低反应的活化能及反应热
C.增大水蒸气浓度有利于提高 的产量
的产量
D.及时分离出 可以使反应①的正反应速率增大
可以使反应①的正反应速率增大
(2)对于反应②,反应速率与浓度之间存在如下关系: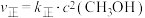 ,
,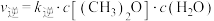 ,
, 、
、 为速率常数,只受温度影响,k和温度的关系为
为速率常数,只受温度影响,k和温度的关系为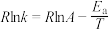 (
( 为活化能,k为速率常数,R、A为常数)。右图中两条直线分别表示
为活化能,k为速率常数,R、A为常数)。右图中两条直线分别表示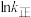 和
和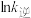 与
与 的关系,表示
的关系,表示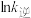 的是
的是___________ (填“a”或“b”),温度为 时,反应②的平衡常数K=
时,反应②的平衡常数K=___________ 。

(3)在恒温条件下,向2L恒容密闭容器中,充入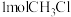 和
和 发生反应,甲醇的物质的量随时间变化如图所示:
发生反应,甲醇的物质的量随时间变化如图所示:
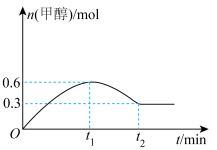
 时,水的体积分数为65%,则
时,水的体积分数为65%,则 的转化率为
的转化率为___________ ,反应①的平衡常数
___________ [对于反应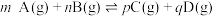 ,
,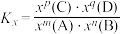 ,x为物质的量分数]。
,x为物质的量分数]。
(4)甲醇也可通过电化学方法由甲烷直接制得,装置如图所示:
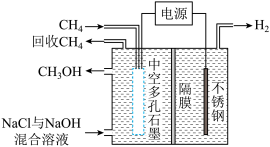
已知,电解生成甲醇的过程分3步:
①通电时,氯离子先转化成高活性的原子氯(Cl·);②Cl·与吸附在电极上的 反应生成HCl和
反应生成HCl和 ;③在碱性电解液中,
;③在碱性电解液中, 转化为目标产物
转化为目标产物 。当步骤①有2molCl·生成时,外电路中转移的电子数为
。当步骤①有2molCl·生成时,外电路中转移的电子数为___________ (用含 的代数式表示)。阴极的电极反应为
的代数式表示)。阴极的电极反应为___________ 。
 和
和 作用生成
作用生成 ,
, 可继续反应生成
可继续反应生成 。反应原理如下:
。反应原理如下:①
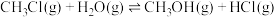

②

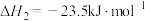
(1)已知反应①中相关化学键的键能数据如表:
| 化学键 | C-Cl | C-H | C-O | H-Cl | H-O |
键能 | 331 | 414 | 343 | 429 | 460 |

 。
。上述反应体系在一定条件下建立平衡后,下列说法正确的是
A.升高温度反应①正向移动,反应②逆向移动
B.加入反应①的催化剂,可以降低反应的活化能及反应热
C.增大水蒸气浓度有利于提高
 的产量
的产量D.及时分离出
 可以使反应①的正反应速率增大
可以使反应①的正反应速率增大(2)对于反应②,反应速率与浓度之间存在如下关系:
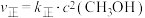 ,
,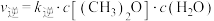 ,
, 、
、 为速率常数,只受温度影响,k和温度的关系为
为速率常数,只受温度影响,k和温度的关系为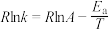 (
( 为活化能,k为速率常数,R、A为常数)。右图中两条直线分别表示
为活化能,k为速率常数,R、A为常数)。右图中两条直线分别表示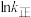 和
和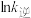 与
与 的关系,表示
的关系,表示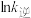 的是
的是 时,反应②的平衡常数K=
时,反应②的平衡常数K=
(3)在恒温条件下,向2L恒容密闭容器中,充入
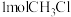 和
和 发生反应,甲醇的物质的量随时间变化如图所示:
发生反应,甲醇的物质的量随时间变化如图所示:
 时,水的体积分数为65%,则
时,水的体积分数为65%,则 的转化率为
的转化率为
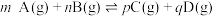 ,
,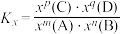 ,x为物质的量分数]。
,x为物质的量分数]。(4)甲醇也可通过电化学方法由甲烷直接制得,装置如图所示:

已知,电解生成甲醇的过程分3步:
①通电时,氯离子先转化成高活性的原子氯(Cl·);②Cl·与吸附在电极上的
 反应生成HCl和
反应生成HCl和 ;③在碱性电解液中,
;③在碱性电解液中, 转化为目标产物
转化为目标产物 。当步骤①有2molCl·生成时,外电路中转移的电子数为
。当步骤①有2molCl·生成时,外电路中转移的电子数为 的代数式表示)。阴极的电极反应为
的代数式表示)。阴极的电极反应为
您最近一年使用:0次
名校
解题方法
10 . 现代社会中,人类的一切活动都离不开能量。氢能是一种极具发展潜力的清洁能源。
Ⅰ.已知太阳光分解水制氢气的热化学方程式: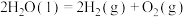
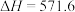 kJ⋅mol
kJ⋅mol 。
。
(1)反应中主要能量转化形式为____ 能转化为____ 能。
(2)若在反应中使用催化剂,
______ 。(请填写“增大”“减小”或“不变”)
Ⅱ.甲烷、水蒸气催化重整是制备高纯氢的方法之一,反应为: 。一定温度下,向体积为1 L的恒容密闭容器中充入1 mol
。一定温度下,向体积为1 L的恒容密闭容器中充入1 mol  和2 mol
和2 mol ,反应过程中测得
,反应过程中测得 的浓度与反应时间的关系如下表所示:
的浓度与反应时间的关系如下表所示:
(3)101 kPa时,1 mol  气体完全燃烧生成液态水和
气体完全燃烧生成液态水和 气体,放出890.3 kJ的热量,反应的热化学方程式为
气体,放出890.3 kJ的热量,反应的热化学方程式为______ 。
(4)①0~4s时间段内用 表示该反应速率
表示该反应速率
_____ mol⋅L ⋅S
⋅S ,反应到5s时,
,反应到5s时, 的转化率为
的转化率为_____ 。
②下列能判断该反应已经达到化学平衡状态的是_____ 。(填字母)
A. 的浓度不再变化 B.生成1 mol
的浓度不再变化 B.生成1 mol  的同时消耗2 mol
的同时消耗2 mol 
C.容器内气体的密度不再发生变化 D.容器内气体的平均摩尔质量不再发生变化
Ⅰ.已知太阳光分解水制氢气的热化学方程式:
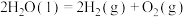
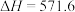 kJ⋅mol
kJ⋅mol 。
。(1)反应中主要能量转化形式为
(2)若在反应中使用催化剂,

Ⅱ.甲烷、水蒸气催化重整是制备高纯氢的方法之一,反应为:
 。一定温度下,向体积为1 L的恒容密闭容器中充入1 mol
。一定温度下,向体积为1 L的恒容密闭容器中充入1 mol  和2 mol
和2 mol ,反应过程中测得
,反应过程中测得 的浓度与反应时间的关系如下表所示:
的浓度与反应时间的关系如下表所示:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
 /mol·L /mol·L | 0.00 | 0.05 | 0.09 | 0.12 | 0.14 | 0.15 |
 气体完全燃烧生成液态水和
气体完全燃烧生成液态水和 气体,放出890.3 kJ的热量,反应的热化学方程式为
气体,放出890.3 kJ的热量,反应的热化学方程式为(4)①0~4s时间段内用
 表示该反应速率
表示该反应速率
 ⋅S
⋅S ,反应到5s时,
,反应到5s时, 的转化率为
的转化率为②下列能判断该反应已经达到化学平衡状态的是
A.
 的浓度不再变化 B.生成1 mol
的浓度不再变化 B.生成1 mol  的同时消耗2 mol
的同时消耗2 mol 
C.容器内气体的密度不再发生变化 D.容器内气体的平均摩尔质量不再发生变化
您最近一年使用:0次