解题方法
1 . Ⅰ、 的资源化可以推动经济高质量发展和生态环境质量的持续改善,回答下列问题:
的资源化可以推动经济高质量发展和生态环境质量的持续改善,回答下列问题:
(1) 和
和 都是主要的温室气体。发生催化重整反应
都是主要的温室气体。发生催化重整反应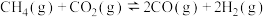

已知 时,相关物质的燃烧热数据如下表:
时,相关物质的燃烧热数据如下表:
反应的
___________ 
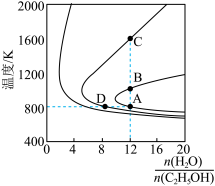
(2)将原料按初始组成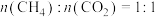 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应。达到平衡时,
发生反应。达到平衡时, 体积分数与温度的关系如图所示:
体积分数与温度的关系如图所示: 的体积分数,则
的体积分数,则___________ 点对应的平衡常数最小,理由是___________
(3)在恒温恒容装置中通入等体积 和
和 ,发生上述反应,起始压强为p,
,发生上述反应,起始压强为p, 的平衡转化率为
的平衡转化率为 。达平衡时,容器内总压为
。达平衡时,容器内总压为___________ 。该反应的平衡常数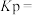
___________ (用平衡分压代替平衡浓度计算,分压 总压×物质的量分数,用
总压×物质的量分数,用 、
、 表达,并化为最简式)。
表达,并化为最简式)。
(4)其他条件相同,在不同催化剂(A、B)作用下, 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: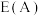 、
、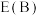 表示,则
表示,则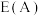
___________ 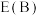 (填“>”“<”或“=”下同)。
(填“>”“<”或“=”下同)。
②y点对应的
___________ z点对应的 。
。
Ⅱ.运用电化学原理可以很好利用 资源。
资源。
(5)火星大气由 的二氧化碳气体组成,火星探测器采用
的二氧化碳气体组成,火星探测器采用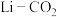 电池供电,其反应机理如下图:
电池供电,其反应机理如下图: 电极反应式:
电极反应式:___________ 。
 的资源化可以推动经济高质量发展和生态环境质量的持续改善,回答下列问题:
的资源化可以推动经济高质量发展和生态环境质量的持续改善,回答下列问题:(1)
 和
和 都是主要的温室气体。发生催化重整反应
都是主要的温室气体。发生催化重整反应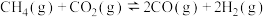

已知
 时,相关物质的燃烧热数据如下表:
时,相关物质的燃烧热数据如下表:| 物质 |  |  |  |
燃烧热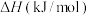 |  |  |  |


(2)将原料按初始组成
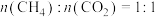 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应。达到平衡时,
发生反应。达到平衡时, 体积分数与温度的关系如图所示:
体积分数与温度的关系如图所示: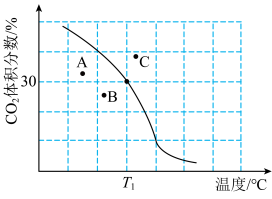
 的体积分数,则
的体积分数,则(3)在恒温恒容装置中通入等体积
 和
和 ,发生上述反应,起始压强为p,
,发生上述反应,起始压强为p, 的平衡转化率为
的平衡转化率为 。达平衡时,容器内总压为
。达平衡时,容器内总压为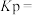
 总压×物质的量分数,用
总压×物质的量分数,用 、
、 表达,并化为最简式)。
表达,并化为最简式)。(4)其他条件相同,在不同催化剂(A、B)作用下,
 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: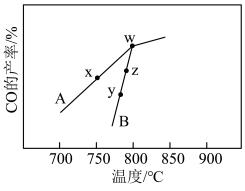
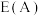 、
、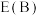 表示,则
表示,则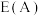
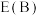 (填“>”“<”或“=”下同)。
(填“>”“<”或“=”下同)。②y点对应的

 。
。Ⅱ.运用电化学原理可以很好利用
 资源。
资源。(5)火星大气由
 的二氧化碳气体组成,火星探测器采用
的二氧化碳气体组成,火星探测器采用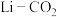 电池供电,其反应机理如下图:
电池供电,其反应机理如下图:
 电极反应式:
电极反应式:
您最近一年使用:0次
2024-02-25更新
|
863次组卷
|
6卷引用:专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)江西省上饶市2024届高三下学期第一次高考模拟考试化学试题(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)大题预测卷02 (新高考通用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)(已下线)大题04 化学反应原理综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)江西省宜春市上高县2023-2024学年高三下学期5月月考化学试题
名校
2 . 氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。乙醇与水催化重整制氢发生以下反应:
反应Ⅰ: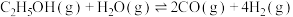

反应Ⅱ:

回答下列问题:
(1)①已知反应Ⅲ: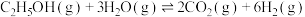 ,
,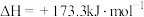 ,
,
则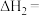
_______ 。
②反应Ⅰ能自发进行的条件为_______ 。
(2)压强为100 ,
, 的平衡产率与温度、起始时
的平衡产率与温度、起始时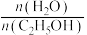 的关系如图所示,每条曲线表示
的关系如图所示,每条曲线表示
相同 的平衡产率。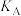
_______ 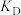 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
② 的产率:C点
的产率:C点_______ B点(填“>”、“=”或“<”);
③A、B两点 产率相等的原因是
产率相等的原因是_______ 。
(3)压强为100 下,1
下,1
 和3
和3
 发生上述反应,平衡时
发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:
的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知: 的选择性
的选择性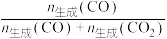 ]
]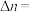
_______  。
。
②表示 选择性的曲线是
选择性的曲线是_______ (填标号)。
③573K时,反应Ⅱ的
_______ (保留到小数点后两位)。
反应Ⅰ:
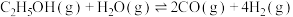

反应Ⅱ:


回答下列问题:
(1)①已知反应Ⅲ:
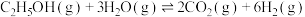 ,
,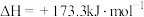 ,
,则
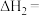
②反应Ⅰ能自发进行的条件为
(2)压强为100
 ,
, 的平衡产率与温度、起始时
的平衡产率与温度、起始时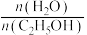 的关系如图所示,每条曲线表示
的关系如图所示,每条曲线表示
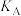
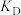 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)②
 的产率:C点
的产率:C点③A、B两点
 产率相等的原因是
产率相等的原因是(3)压强为100
 下,1
下,1
 和3
和3
 发生上述反应,平衡时
发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:
的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知: 的选择性
的选择性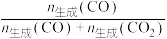 ]
]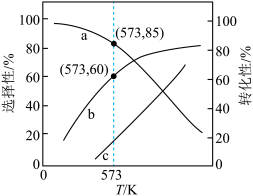
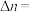
 。
。②表示
 选择性的曲线是
选择性的曲线是③573K时,反应Ⅱ的

您最近一年使用:0次
2024-02-17更新
|
1303次组卷
|
5卷引用:专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)吉林省东北师范大学附属中学、长春市十一高中、吉林市第一中学、四平一中、松原实验中学2023-2024学年高三上学期1月联合模拟考试化学试题四川省成都市第七中学(林荫校区)2024届高三二诊热身考试理综-化学试题山东省潍坊市2024届高高考模拟训练调研化学试题湖北省襄阳四中2024届高三下学期学业水平适应性考试(一模)化学试题
名校
3 . 工业上常以水煤气(CO和H2)为原料合成甲醇。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH=-221.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
则C(s)与H2O(g)制备水煤气的热化学方程式为_______ 。
(2)工业上通常用水煤气在恒容、催化剂和加热条件下生产甲醇,其热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g) ΔH=-90.8kJ·mol-1。以下各项能说明该反应达到平衡状态的是_______。
(3)在2L恒容容器中,分别在T1、T2两种温度下模拟工业合成甲醇。两种温度下不同H2和CO起始组成比[n(H2)/n(CO)]与CO平衡转化率的关系如图所示:
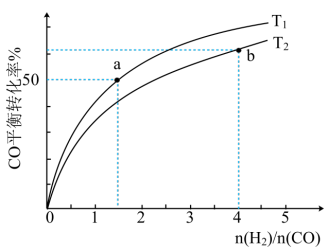
①温度T1_______ T2(填“>”、“<”或“=”)。
②T1时,往恒容容器中充入1molCO、1.5molH2,经过5min达到平衡,则5min内用H2表示的反应速率为v(H2)=_______ ,反应平衡常数K=_______ 。平衡后向容器中再通入0.4molCO、0.7molH2和0.4molCH3OH,此时v正_______ v逆(填“>”、“<”或“=”)。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH=-221.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
则C(s)与H2O(g)制备水煤气的热化学方程式为
(2)工业上通常用水煤气在恒容、催化剂和加热条件下生产甲醇,其热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g) ΔH=-90.8kJ·mol-1。以下各项能说明该反应达到平衡状态的是_______。
| A.混合气体的密度保持不变 | B.容器内总压强保持不变 |
| C.CO的体积分数保持不变 | D.2v逆(H2)=v正(CH3OH) |

①温度T1
②T1时,往恒容容器中充入1molCO、1.5molH2,经过5min达到平衡,则5min内用H2表示的反应速率为v(H2)=
您最近一年使用:0次
2024-02-13更新
|
102次组卷
|
2卷引用:甘肃省兰州第一中学2023-2024学年高二上学期1月期末化学试题
4 . 氨是一种重要的化工产品。回答下列问题:
(1)已知:①N2(g)+3H2(g) 2NH3(g) ΔH=-92.0kJ/mol
2NH3(g) ΔH=-92.0kJ/mol
②H2(g)+ O2(g)
O2(g) H2O(g) ΔH=-240.0kJ/mol
H2O(g) ΔH=-240.0kJ/mol
③2Fe(s)+ O2(g)
O2(g) Fe2O3(s) ΔH=-1644.0kJ/mol
Fe2O3(s) ΔH=-1644.0kJ/mol
则反应2NH3(g)+Fe2O3(s) N2(g)+3H2O(g)+2Fe(s) ΔH=
N2(g)+3H2O(g)+2Fe(s) ΔH=___________ kJ/mol,该反应在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
(2)下列关于合成氨工艺的理解中,正确的有___________(填标号)。
(3)温度为T℃,压强恒定为pMPa,用Fe2O3处理NH3和HCN(起始时NH3的体积分数为58%)的混合气体,部分气体的体积分数随时间的变化如图,反应经30min达到平衡。

①0~30min内用NH3的压强变化表示的反应速率v(NH3)=___________ MPa·min-1。
②反应2NH3(g)+Fe2O3(s) N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=
N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=___________ (MPa)2 (列出计算式即可);若升高温度,该反应的平衡常数将___________ (填“增大”“减小”或“不变”)。
(4)在催化剂作用下,可用NH3去除NO,其反应原理为4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)分别为4:1、3∶1、1:3时,得到的NO脱除率曲线如图所示:
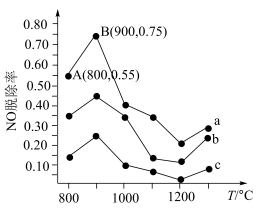
①曲线a中,在温度超过900℃时,NO脱除率骤然下降的原因可能是___________ 。
②曲线b对应的NH3与NO的物质的量之比是___________ 。
(1)已知:①N2(g)+3H2(g)
 2NH3(g) ΔH=-92.0kJ/mol
2NH3(g) ΔH=-92.0kJ/mol②H2(g)+
 O2(g)
O2(g) H2O(g) ΔH=-240.0kJ/mol
H2O(g) ΔH=-240.0kJ/mol③2Fe(s)+
 O2(g)
O2(g) Fe2O3(s) ΔH=-1644.0kJ/mol
Fe2O3(s) ΔH=-1644.0kJ/mol则反应2NH3(g)+Fe2O3(s)
 N2(g)+3H2O(g)+2Fe(s) ΔH=
N2(g)+3H2O(g)+2Fe(s) ΔH=(2)下列关于合成氨工艺的理解中,正确的有___________(填标号)。
| A.控制温度远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率 |
| B.合成氨反应在不同温度下的ΔH和ΔS都小于零 |
| C.NH3易液化,不断将液氨移去,利于反应正向进行 |
| D.原料气中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防催化剂中毒和安全事故发生 |
(3)温度为T℃,压强恒定为pMPa,用Fe2O3处理NH3和HCN(起始时NH3的体积分数为58%)的混合气体,部分气体的体积分数随时间的变化如图,反应经30min达到平衡。

①0~30min内用NH3的压强变化表示的反应速率v(NH3)=
②反应2NH3(g)+Fe2O3(s)
 N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=
N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=(4)在催化剂作用下,可用NH3去除NO,其反应原理为4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)分别为4:1、3∶1、1:3时,得到的NO脱除率曲线如图所示:

①曲线a中,在温度超过900℃时,NO脱除率骤然下降的原因可能是
②曲线b对应的NH3与NO的物质的量之比是
您最近一年使用:0次
解题方法
5 . 江西稀土资源丰富。硫酸铵作为一种重要的化工原料,可用于稀土的提取。初始投料比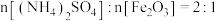 的混合物,其热分解过程如图所示:
的混合物,其热分解过程如图所示:
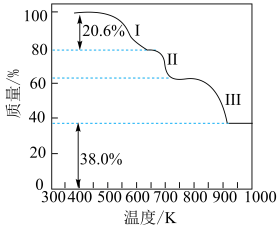
已知该过程主要分为三个阶段,其中:
阶段Ⅱ反应: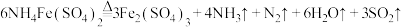
阶段Ⅲ反应: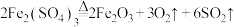
回答下列问题:
(1) 中,
中, 的空间结构为
的空间结构为_______ , 中心原子的杂化类型为
中心原子的杂化类型为______ 。
(2)阶段Ⅰ不发生氧化还原反应,对应的化学方程式为_________ ;图中阶段Ⅰ多次重复实验的实际失重均比理论值偏大,此误差属于______ (填“偶然误差”或“系统误差”)。
(3)阶段Ⅱ和Ⅲ都是吸热过程,且Ⅱ反应速率更快,下列示意图中能体现上述两反应能量变化的是______ (填标号),判断的理由是______ 。
A.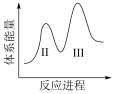 B.
B. 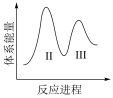 C.
C. 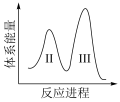 D.
D.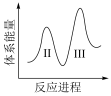
(4)该热分解过程中, 的作用为
的作用为_______ 。
(5)一定温度下,在真空刚性容器中, 的分解过程会发生下列反应:
的分解过程会发生下列反应:
主反应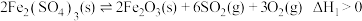
副反应
两个反应的平衡常数比值 随反应温度升高而
随反应温度升高而______ (填“增大”,“减小”或“不变”);若平衡时总压为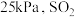 的体积分数为0.4,主反应的平衡常数
的体积分数为0.4,主反应的平衡常数
_____ 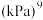 。
。
(6) 在高温下可以自发分解,原因是
在高温下可以自发分解,原因是______ 。
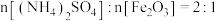 的混合物,其热分解过程如图所示:
的混合物,其热分解过程如图所示:
已知该过程主要分为三个阶段,其中:
阶段Ⅱ反应:
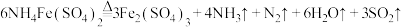
阶段Ⅲ反应:
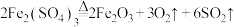
回答下列问题:
(1)
 中,
中, 的空间结构为
的空间结构为 中心原子的杂化类型为
中心原子的杂化类型为(2)阶段Ⅰ不发生氧化还原反应,对应的化学方程式为
(3)阶段Ⅱ和Ⅲ都是吸热过程,且Ⅱ反应速率更快,下列示意图中能体现上述两反应能量变化的是
A.
 B.
B.  C.
C.  D.
D.
(4)该热分解过程中,
 的作用为
的作用为(5)一定温度下,在真空刚性容器中,
 的分解过程会发生下列反应:
的分解过程会发生下列反应:主反应
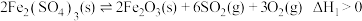
副反应

两个反应的平衡常数比值
 随反应温度升高而
随反应温度升高而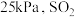 的体积分数为0.4,主反应的平衡常数
的体积分数为0.4,主反应的平衡常数
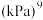 。
。(6)
 在高温下可以自发分解,原因是
在高温下可以自发分解,原因是
您最近一年使用:0次
名校
6 . 我国科学家成功利用CO还原NO,从源头上减少煤粉燃烧产生的大气污染。一定温度下,在1L的恒容密闭容器中,充入1molCO和1molNO,反应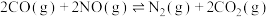 平衡时,测得c(N2)=0.2mol/L,下列说法正确的是
平衡时,测得c(N2)=0.2mol/L,下列说法正确的是
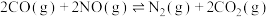 平衡时,测得c(N2)=0.2mol/L,下列说法正确的是
平衡时,测得c(N2)=0.2mol/L,下列说法正确的是| A.升高温度,正、逆反应速率以相同倍数增大 |
| B.加入催化剂使正反应速率加快,逆反应活化能增大 |
C.若往容器中再通入1molNO和1molCO2,则此时 |
D.若往容器中再通入2molCO和1molN2,则此时 |
您最近一年使用:0次
2024-01-23更新
|
745次组卷
|
5卷引用:专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024年1月江西普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”江西卷真题完全解读与考后提升(已下线)选择题11-14江苏省扬州中学2023-2024学年高二下学期3月考试化学试题
7 . 铜锈中含有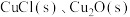 和
和 。有人提出腐蚀途径如下:
。有人提出腐蚀途径如下:
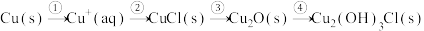
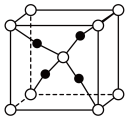
(1)上图所示晶体结构表示铜锈中___________ 物质(填写化学式)。
(2)过程①是典型的电化学腐蚀,其负极反应为___________
(3)过程③、④涉及的反应方程式包括:
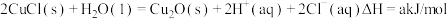
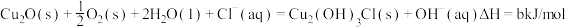
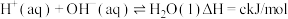
则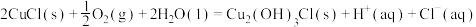 的
的
_______ 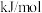 。
。
(4)环境越潮湿、氧气含量越___________ 、气温越___________ ,铜的腐蚀越严重。
(5)铜锈还含有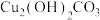 ,其分解方程式为:
,其分解方程式为: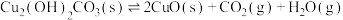 。该反应的
。该反应的 随温度的变化关系如图所示,
随温度的变化关系如图所示, 分解的最低温度为
分解的最低温度为___________ K,当温度从 升高到
升高到 时,平衡向
时,平衡向___________ 移动,判定理由是___________ 。

(6)某温度下,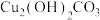 在恒容密闭容器中的分解达平衡时,容器内压强为
在恒容密闭容器中的分解达平衡时,容器内压强为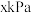 ,则反应平衡常数
,则反应平衡常数
_______ 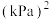 。
。
(7)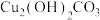 分解过程中总压强随时间的变化关系如图所示,则在
分解过程中总压强随时间的变化关系如图所示,则在 内,
内, 的平均生成速率
的平均生成速率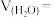
_______ 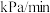 。
。
 和
和 。有人提出腐蚀途径如下:
。有人提出腐蚀途径如下: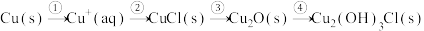

(1)上图所示晶体结构表示铜锈中
(2)过程①是典型的电化学腐蚀,其负极反应为
(3)过程③、④涉及的反应方程式包括:
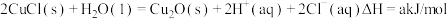
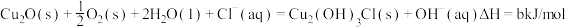
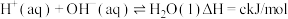
则
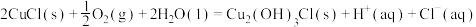 的
的
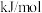 。
。(4)环境越潮湿、氧气含量越
(5)铜锈还含有
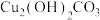 ,其分解方程式为:
,其分解方程式为: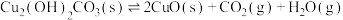 。该反应的
。该反应的 随温度的变化关系如图所示,
随温度的变化关系如图所示,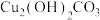 分解的最低温度为
分解的最低温度为 升高到
升高到 时,平衡向
时,平衡向
(6)某温度下,
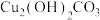 在恒容密闭容器中的分解达平衡时,容器内压强为
在恒容密闭容器中的分解达平衡时,容器内压强为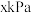 ,则反应平衡常数
,则反应平衡常数
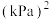 。
。(7)
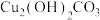 分解过程中总压强随时间的变化关系如图所示,则在
分解过程中总压强随时间的变化关系如图所示,则在 内,
内, 的平均生成速率
的平均生成速率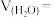
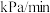 。
。
您最近一年使用:0次
名校
解题方法
8 . 苯乙烯是重要的有机化工原料,可用乙苯为原料制备苯乙烯。制备方法有直接脱氢法和氧化脱氢法。在 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接脱氢:
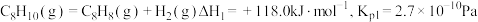
(ⅱ)氧化脱氢:

回答下列问题:
(1)①反应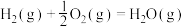 的
的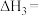
_______  ,平衡常数
,平衡常数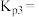
_______ (用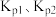 表示)。
表示)。
②氧化脱氢的反应趋势远大于直接脱氢,其原因是_______ 。
③提高氧化脱氢反应平衡转化率的措施有_______ 、_______ 。
(2)已知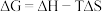 ,忽略
,忽略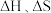 随温度的变化。当
随温度的变化。当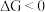 时,反应能自发进行。在
时,反应能自发进行。在 下,直接脱氢反应的
下,直接脱氢反应的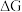 和
和 随温度变化的理论计算结果如图所示。
随温度变化的理论计算结果如图所示。

①直接脱氢反应在常温下_______ (选填“能”或“不能”)自发。
② 随温度的变化曲线为
随温度的变化曲线为_______ (选填“a”或“b”),判断的理由是_______ 。
③在某温度、 下,向密闭容器中通入
下,向密闭容器中通入 气态乙苯发生直接脱氢反应,达到平衡时,混合气体中乙苯和氢气的分压相等,该反应的平衡常数
气态乙苯发生直接脱氢反应,达到平衡时,混合气体中乙苯和氢气的分压相等,该反应的平衡常数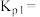
_______  (保留小数点后一位;分压
(保留小数点后一位;分压 总压
总压 物质的量分数)。
物质的量分数)。
(3)乙苯脱氢制苯乙烯往往伴随副反应,生成苯和甲苯等芳香烃副产物。一定温度和压强条件下,为了提高反应速率和苯乙烯选择性,应当_______ 。
 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:(ⅰ)直接脱氢:
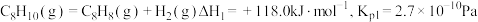
(ⅱ)氧化脱氢:

回答下列问题:
(1)①反应
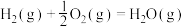 的
的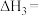
 ,平衡常数
,平衡常数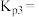
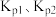 表示)。
表示)。②氧化脱氢的反应趋势远大于直接脱氢,其原因是
③提高氧化脱氢反应平衡转化率的措施有
(2)已知
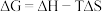 ,忽略
,忽略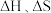 随温度的变化。当
随温度的变化。当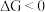 时,反应能自发进行。在
时,反应能自发进行。在 下,直接脱氢反应的
下,直接脱氢反应的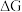 和
和 随温度变化的理论计算结果如图所示。
随温度变化的理论计算结果如图所示。
①直接脱氢反应在常温下
②
 随温度的变化曲线为
随温度的变化曲线为③在某温度、
 下,向密闭容器中通入
下,向密闭容器中通入 气态乙苯发生直接脱氢反应,达到平衡时,混合气体中乙苯和氢气的分压相等,该反应的平衡常数
气态乙苯发生直接脱氢反应,达到平衡时,混合气体中乙苯和氢气的分压相等,该反应的平衡常数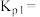
 (保留小数点后一位;分压
(保留小数点后一位;分压 总压
总压 物质的量分数)。
物质的量分数)。(3)乙苯脱氢制苯乙烯往往伴随副反应,生成苯和甲苯等芳香烃副产物。一定温度和压强条件下,为了提高反应速率和苯乙烯选择性,应当
您最近一年使用:0次
2024-01-22更新
|
807次组卷
|
7卷引用:专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024年1月贵州普通高等学校招生考试适应性测试化学试题(已下线)T29-原理综合题(已下线)2024年1月“九省联考”贵州卷真题完全解读与考后提升(已下线)T17-原理综合题(已下线)T16-原理综合题四川省遂宁市射洪市四川省射洪中学校2023-2024学年高三下学期开学理综试题-高中化学
解题方法
9 . 某温度条件下,在某恒压容器中发生反应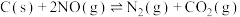 ,部分反应物和生成物的物质的量随时间变化如图所示(曲线m、n)。下列说法正确的是
,部分反应物和生成物的物质的量随时间变化如图所示(曲线m、n)。下列说法正确的是
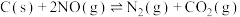 ,部分反应物和生成物的物质的量随时间变化如图所示(曲线m、n)。下列说法正确的是
,部分反应物和生成物的物质的量随时间变化如图所示(曲线m、n)。下列说法正确的是
| A.m表示C的物质的量随时间的变化 |
B. 时刻反应速率: 时刻反应速率: |
C.此反应的平衡常数 |
D.平衡后充入 ,再次达到平衡时物质n的物质的量大于 ,再次达到平衡时物质n的物质的量大于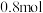 |
您最近一年使用:0次
10 .  时,向1L密闭容器中充入
时,向1L密闭容器中充入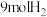 和
和 ,发生如下反应:
,发生如下反应:
 ,部分物质的物质的量
,部分物质的物质的量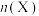 随时间变化曲线如下图中实线所示。下列说法正确的是
随时间变化曲线如下图中实线所示。下列说法正确的是
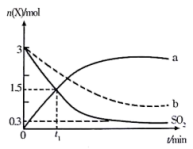
 时,向1L密闭容器中充入
时,向1L密闭容器中充入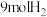 和
和 ,发生如下反应:
,发生如下反应:
 ,部分物质的物质的量
,部分物质的物质的量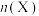 随时间变化曲线如下图中实线所示。下列说法正确的是
随时间变化曲线如下图中实线所示。下列说法正确的是
A.曲线a代表 随时间变化的曲线 随时间变化的曲线 |
B.若 ,则0~5min内 ,则0~5min内 |
C.平衡时,该反应的平衡常数 |
D.若将容器体积减小,则虚线b可表示体积减小后 的变化 的变化 |
您最近一年使用:0次



