名校
1 . 已知溴酸银的溶解是吸热过程,在不同温度条件下,溴酸银的溶解平衡曲线如图所示,下列说法正确的是( )
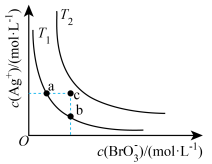

| A.T1>T2 |
| B.加入AgNO3固体,可从a点变到c点 |
| C.a点和b点的Ksp相等 |
| D.c点时,在T1、T2两个温度条件下均有固体析出 |
您最近一年使用:0次
2017-05-12更新
|
458次组卷
|
10卷引用:辽宁省渤海大学附属高级中学2021-2022学年高二上学期第二次月考化学试题
辽宁省渤海大学附属高级中学2021-2022学年高二上学期第二次月考化学试题山西省运城市教育发展联盟2021-2022学年高二上学期11月期中检测化学试题宁夏银川市第一中学2016-2017学年高二下学期期中考试化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期期中考试化学(重点、平行班)试题内蒙古翁牛特旗乌丹第二中学、呼和浩特市第二十一中学2017-2018学年高二上学期期末联考化学试题(已下线)二轮复习 专题11 水溶液中的离子平衡 押题专练【全国百强校】内蒙古第一机械制造(集团)有限公司第一中学2018-2019学年高二上学期期中考试化学试题甘肃省民勤县第一中学2021-2022学年高二上学期期末考试化学试题上海市嘉定区第二中学2022-2023学年高二下学期第一次质量检测化学试题吉林省长春市朝阳区长春外国语学校2022-2023学年高二上学期11月期中化学试题
名校
2 . 25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如右图所示(已知Ksp(AgCl)=1.8×10-10),下列说法正确的是
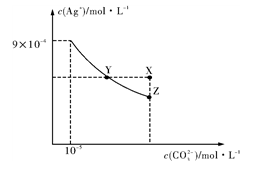
| A.根据图示可计算出Ksp(Ag2CO3)=9×10-9 |
| B.向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点 |
C.反应Ag2CO3(s)+2Cl-(aq) 2AgCl(s)+CO32-(aq)化学平衡常数K=2.5×108 2AgCl(s)+CO32-(aq)化学平衡常数K=2.5×108 |
| D.在0.001mol/LAgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀 |
您最近一年使用:0次
2017-04-23更新
|
675次组卷
|
3卷引用:专题27 难溶电解质的溶解平衡(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练
(已下线)专题27 难溶电解质的溶解平衡(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练安徽省江淮十校2017届高三下学期第三次联考理综化学试题湖南省师范大学附属中学2017届高三下学期高考模拟(二)理科综合化学试题
名校
3 . 以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀。根据上述实验事实,下列说法中,不正确的是
| A.溶解度 MnS<PbS |
B.MnS存在沉淀溶解平衡 MnS(s) Mn2+(aq) + S2-(aq) Mn2+(aq) + S2-(aq) |
| C.Cu2+转化为沉淀的原理为 MnS(s) + Cu2+(aq)=CuS(s) + Mn2+(aq) |
| D.沉淀转化能用于除去溶液中的某些杂质离子 |
您最近一年使用:0次
2017-02-17更新
|
556次组卷
|
10卷引用:安徽省滁州市定远育才学校2022届高三上学期开学摸底考试化学试题
安徽省滁州市定远育才学校2022届高三上学期开学摸底考试化学试题2017届北京市西城区高三上学期期末考试化学试卷【全国百强校】黑龙江省大庆铁人中学2018-2019学年高二上学期期末考试化学试题福建省莆田市第二十五中学2018-2019学年高二下学期第一次月考化学试题安徽省天长市炳辉中学2019-2020学年高二上学期第二次月考化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题08-2020年北京新高考化学模拟试题(已下线)《2020年新高考政策解读与配套资源》模拟试题12-2020年北京新高考化学模拟试题北京五中2021届高三上学期第二次月考化学试题北京市育才学校2020-2021学年高二上学期12月考化学试题云南省昆明市安宁中学2022-2023学年高二下学期第一次检测化学试题
名校
4 . 关于CaCO3沉淀的溶解平衡说法正确的是
| A.CaCO3沉淀生成和沉淀溶解不断进行,但速率相等 |
| B.CaCO3难溶于水,溶液中没有Ca2+和CO32- |
| C.升高温度,CaCO3沉淀的溶解度无影响 |
| D.向CaCO3沉淀中加入Na2CO3固体,CaCO3沉淀的溶解度不变 |
您最近一年使用:0次
2017-02-17更新
|
457次组卷
|
3卷引用:江西省吉安三中2021-2022学年高二上学期10月第一次段考化学试题
名校
5 . 常温时,向一定量的硫酸铜溶液中滴加pH=11 的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的是(已知Ksp[Cu(OH)2] = 2.2×10-20)
| A.若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3▪H2O)始终保持增大 |
| B.滴加过程中,当溶液中c(Cu2+) = 2.2×10-2 mol/L 时,溶液的pH = 9 |
| C.滴加过程中,当溶液的pH =7 时,溶液中2c(NH4+)= c(SO42-) |
| D.若滴加pH =11 的NaOH 溶液,Cu2+完全沉淀时消耗溶液的体积小于V |
您最近一年使用:0次
2017-01-19更新
|
278次组卷
|
3卷引用:湖南省邵阳邵东市第一中学2022届高三上学期第二次月考化学试题
名校
6 . AlPO4的沉淀溶解平衡曲线如图所示(T2>T1).下列说法正确的是( )


| A.图像中四个点的Ksp:a=b>c>d |
| B.AlPO4在b点对应的溶解度大于c点 |
| C.AlPO4(s)⇌Al3+(aq)+PO43-(aq)△H<0 |
| D.升高温度可使d点移动到b点 |
您最近一年使用:0次
2016-12-09更新
|
835次组卷
|
11卷引用:湖南省郴州市2020-2021学年高二上学期期末考试化学(选考)试题
湖南省郴州市2020-2021学年高二上学期期末考试化学(选考)试题2016届贵州省遵义一中高三押题卷理综化学试卷湖北省沙市中学2017-2018学年高二上学期期末考试化学试题【全国百强校】广东省深圳外国语学校2017-2018学年高二上学期期中化学试题(已下线)第8章 单元测试(测)-《2020年高考一轮复习讲练测》安徽省淮北市濉溪县2018-2019学年高二上学期期末考试化学试题湖北省黄石市2018-2019学年高二上学期期末质量监测考试化学试题(已下线)第八章 能力提升检测卷-2021年高考化学一轮复习讲练测(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)四川省宜宾市叙州区第一中学校2024届高三上学期一诊模拟考试理综化学试题广东省广州市白云中学2023-2024学年高二上学期12月月考化学试题
7 . 向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
A.c( ) ) | B.c(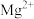 ) ) | C.c(H+) | D.Ksp(Mg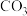 ) ) |
您最近一年使用:0次
2016-12-09更新
|
1240次组卷
|
28卷引用:广西桂林市第十八中学2020-2021学年高二下学期期中考试化学试题
广西桂林市第十八中学2020-2021学年高二下学期期中考试化学试题(已下线)3.4.1 难溶电解质的沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)陕西省延安市富县高级中学2021-2022学年高二上学期期中考试化学试题云南省玉龙纳西族自治县田家炳民族中学2021-2022学年高二上学期期中考试化学试题2016年全国普通高等学校招生统一考试化学(海南卷精编版)2017届广东省蕉岭县蕉岭中学高三上学期开学考试化学试卷安徽省铜陵市第一中学2017-2018学年高二12月月考化学试题天津市和平区2017-2018学年高二上学期期末考试化学试题(已下线)《考前20天终极攻略》-5月23日 溶液中的离子平衡(已下线)解密13 沉淀溶解平衡——备战2018年高考化学之高频考点解密广东省蓝精灵中学2018-2019学年高二上学期联考化学试题(已下线)2018年11月18日 《每日一题》人教选修4-每周一测2016年全国普通高等学校招生统一考试化学(海南卷参考版)(已下线)2019年11月17日《每日一题》人教版(选修4)—— 每周一测吉林省吉林市普通高中2020届高三上学期第一次调研测试化学试题新疆维吾尔自治区石河子第二中学2019-2020学年高二上学期第二次月考化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训江苏省南京市南京师I范大学附属中学 2019-2020 学年高二下学期期中考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡(已下线)3.4.1 难溶电解质的沉淀溶解平衡(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山西省运城市临猗县临晋中学2020-2021学年高二上学期12月月考化学试题云南省澄江市第一中学2021-2022年高二下学期3月月考化学试题云南省昆明师范专科学校附属中学2021-2022学年高二上学期期末考试化学试题(已下线)第一部分 二轮专题突破 专题14 溶液中的三大平衡及应用甘肃省兰州第一中学2022-2023学年高二上学期期末考试化学试题江西省抚州创新实验学校2021-2022学年高二上学期期末考试化学试题
8 . 下列关于沉淀溶解平衡的说法中不正确的是
| A.难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡 |
| B.Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关 |
| C.Ksp反映了物质在水中的溶解能力,可直接根据Ksp的数值大小比较电解质在水中的溶解能力大小 |
| D.Ksp改变,可使沉淀溶解平衡移动 |
您最近一年使用:0次
2016-12-09更新
|
164次组卷
|
3卷引用:3.4.1 沉淀溶解平衡原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
(已下线)3.4.1 沉淀溶解平衡原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)2015-2016学年福建省八县一中高二上学期期末考试化学试卷福建省福州市2016-2017学年高二上学期期中考试化学试题
名校
9 . 在平衡体系Ca(OH)2(s) Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
 Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是| A.加入少量MgCl2固体 | B.加入少量Na2CO3固体 |
| C.加入少量KCl固体 | D.加入少量稀H2SO4 |
您最近一年使用:0次
2016-12-09更新
|
303次组卷
|
5卷引用:新疆乌鲁木齐市第二十中学2020-2021学年高二上学期期末考试化学试题
名校
10 . 下列事实不能用平衡移动原理解释的是
| A.Mg(OH)2不溶于水,但能溶于浓NH4Cl溶液中 |
| B.水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸除去 |
| C.洗涤BaSO4沉淀时,用稀硫酸洗涤BaSO4沉淀比用蒸馏水洗涤损失少 |
| D.FeCl3溶液中混有FeCl2,常加入少量的H2O2,使Fe2+氧化为Fe3+ |
您最近一年使用:0次
2016-12-09更新
|
242次组卷
|
3卷引用:河北省石家庄市第一中学2021-2022学年高二上学期10月月考化学试卷
河北省石家庄市第一中学2021-2022学年高二上学期10月月考化学试卷2015-2016学年湖南省娄底市湘中名校高二上期末理化学试卷(已下线)2018年11月20日 《每日一题》人教选修4-沉淀溶解平衡在物质分离中的应用



