1 . 某兴趣小组对FeSO4的一些性质进行探究实验。回答下列问题:
(1)在试管中加入少量FeSO4样品,加水溶解,滴加KSCN溶液,溶液逐渐变_____ 色,说明样品已变质。同学甲认为若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,发生反应的离子方程式为______________ 。
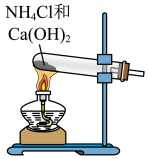
(2)已知FeSO4的分解产物中含有SO2和SO3。将纯净FeSO4和有关试剂放入如图所示的装置,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红棕色粉末。________________ 。
②装置C中盛放的溶液为________ ;装置D中盛放的溶液为________ (填标号)。
A.品红 B.NaOH C.BaCl2 D.浓H2SO4
③盛有NaOH溶液的装置的作用是_____________ 。
④实验时装置D中除有气泡冒出外,还可观察到的实验现象为_____________ 。
(1)在试管中加入少量FeSO4样品,加水溶解,滴加KSCN溶液,溶液逐渐变
(2)已知FeSO4的分解产物中含有SO2和SO3。将纯净FeSO4和有关试剂放入如图所示的装置,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红棕色粉末。

②装置C中盛放的溶液为
A.品红 B.NaOH C.BaCl2 D.浓H2SO4
③盛有NaOH溶液的装置的作用是
④实验时装置D中除有气泡冒出外,还可观察到的实验现象为
您最近一年使用:0次
2 . 合成氨是人类科学技术发展史上的一项重大成就。实验室利用如右图所示装置及药品制取氨气:_____________ 。
(2)下列装置中,可用于收集氨的是_________ (填标号)。______________ 。
(4)在一定条件下,将2molN2和6molH2在体积恒为5L的密闭容器中混合,发生如下反应:N2(g)+3H2(g) 2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
①2min内该反应的平均反应速率v(N2)=______ mol/(L·min)
②一段时间后反应达到平衡,密闭容器中混合气体的压强比反应前减少了25%,计算此时容器中NH3的浓度为____________ mol/L。
③能说明该反应已经达到平衡状态的是____________ 。
a.气体的密度保持不变 b.NH3的含量保持不变
c.N2和H2的物质的量之比为1:3 d.N2的转化率不再发生改变
(5)工业上通常用氨转化法处理含NO、NO2等氮氧化物的尾气:已知8 mol氨恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为_____ 。
(2)下列装置中,可用于收集氨的是
a. 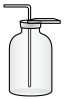 b.
b. 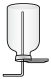 c.
c. 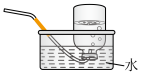
(4)在一定条件下,将2molN2和6molH2在体积恒为5L的密闭容器中混合,发生如下反应:N2(g)+3H2(g)
 2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:①2min内该反应的平均反应速率v(N2)=
②一段时间后反应达到平衡,密闭容器中混合气体的压强比反应前减少了25%,计算此时容器中NH3的浓度为
③能说明该反应已经达到平衡状态的是
a.气体的密度保持不变 b.NH3的含量保持不变
c.N2和H2的物质的量之比为1:3 d.N2的转化率不再发生改变
(5)工业上通常用氨转化法处理含NO、NO2等氮氧化物的尾气:已知8 mol氨恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
您最近一年使用:0次
名校
解题方法
3 . 材料是人类赖以生存和发展的基础,下列有关说法错误的是
| A.传统的无机非金属材料多为硅酸盐材料 |
| B.高纯硅广泛应用于信息技术和新能源技术领域 |
| C.碳纳米材料在信息,医药等领域有广阔应用前景 |
| D.SiC因含有离子键而具有优异的高温抗氧化性能 |
您最近一年使用:0次
4 . 柳州市博物馆是我市的文化名片。下列有关展品主要成分为合金的是
A.兽骨 | B.青铜器 |
C.纸张 | D.青花瓷 |
您最近一年使用:0次
解题方法
5 . 下列有关物质结构和性质的说法错误的是
A. 晶体中存在 晶体中存在 与 与 之间的离子键,为强烈相互作用 之间的离子键,为强烈相互作用 |
B.依据价层电子对互斥理论预测, 的空间结构为三角锥形 的空间结构为三角锥形 |
| C.液氧和煤油可做火箭推进剂,液氧分子间靠范德华力凝聚在一起 |
D.NaCl(800.7℃)的熔点远高于 (-68.8℃),原因是两者晶体类型不同 (-68.8℃),原因是两者晶体类型不同 |
您最近一年使用:0次
2024-04-30更新
|
454次组卷
|
3卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
名校
6 . 电化学原理在电池制造、能量转换、物质合成等方面应用广泛。
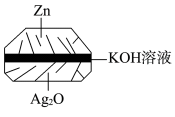
(1)微型纽扣银锌电池(如下图)在生活中有广泛应用,其电极分别是 和
和 ,电解质为
,电解质为 溶液,电极反应分别为:
溶液,电极反应分别为: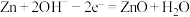 ;
;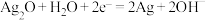 。
。 是电池的
是电池的___________ 极,电池的总反应方程式为___________ 。在使用过程中,电解质溶液的
___________ (填“增大”、“减小”或“不变”)。
(2)燃料电池必须从电池外部不断地向电池提供燃料。如甲烷 -空气燃料电池,工作原理如下图甲。ab均为惰性电极。a为
-空气燃料电池,工作原理如下图甲。ab均为惰性电极。a为___________ 极,正极的电极反应式为___________ 。当通入 (标准状况下)甲烷气体完全反应时,测得电路中转移
(标准状况下)甲烷气体完全反应时,测得电路中转移 电子,则甲烷的利用率为
电子,则甲烷的利用率为___________ 。
写出该装置负极的电极反应式___________ ,若此过程中转移了 电子,则理论上质子膜两侧电解液的质量变化差[
电子,则理论上质子膜两侧电解液的质量变化差[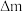 左
左 右]为
右]为___________ 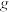 (忽略气体的溶解)。
(忽略气体的溶解)。
(1)微型纽扣银锌电池(如下图)在生活中有广泛应用,其电极分别是
 和
和 ,电解质为
,电解质为 溶液,电极反应分别为:
溶液,电极反应分别为: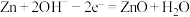 ;
;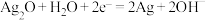 。
。
 是电池的
是电池的
(2)燃料电池必须从电池外部不断地向电池提供燃料。如甲烷
 -空气燃料电池,工作原理如下图甲。ab均为惰性电极。a为
-空气燃料电池,工作原理如下图甲。ab均为惰性电极。a为 (标准状况下)甲烷气体完全反应时,测得电路中转移
(标准状况下)甲烷气体完全反应时,测得电路中转移 电子,则甲烷的利用率为
电子,则甲烷的利用率为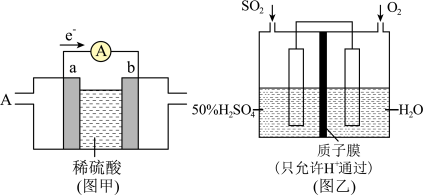
写出该装置负极的电极反应式
 电子,则理论上质子膜两侧电解液的质量变化差[
电子,则理论上质子膜两侧电解液的质量变化差[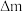 左
左 右]为
右]为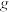 (忽略气体的溶解)。
(忽略气体的溶解)。
您最近一年使用:0次
7 . 某同学设计了如图原电池装置(盐桥装有琼脂吸附的饱和 溶液)。下列说法错误的是
溶液)。下列说法错误的是
 溶液)。下列说法错误的是
溶液)。下列说法错误的是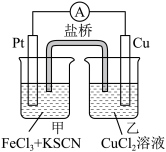
A.负极是 ,电池工作时, ,电池工作时, 发生了氧化反应 发生了氧化反应 |
| B.电池工作过程中,甲烧杯中溶液的颜色逐渐变浅 |
C.电池工作过程中,盐桥中的 向甲烧杯移动 向甲烧杯移动 |
D.该电池的反应原理是: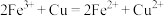 |
您最近一年使用:0次
名校
8 . Ⅰ.请写出下列反应的离子方程式:
(1)往 溶液中滴加浓烧碱并加热:
溶液中滴加浓烧碱并加热:___________ 。
(2)往 溶液中滴加稀盐酸溶液:
溶液中滴加稀盐酸溶液:___________ 。
(3)将 气体与
气体与 充分发生反应:
充分发生反应:___________ 。
(4) 溶液中通入少量
溶液中通入少量 气体:
气体:___________ 。
(5)往 溶液中通入少量
溶液中通入少量 :
:___________ 。
Ⅱ.请按要求完成下列热化学知识小题(能量数据均为常温常压下的测定值):
(6)将 氢气与足量氧气充分反应生成液态水,放出
氢气与足量氧气充分反应生成液态水,放出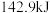 的热量。则表示氢气燃烧热的热化学方程式为:
的热量。则表示氢气燃烧热的热化学方程式为:___________ 。
(7)将含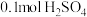 的稀硫酸溶液与足量稀
的稀硫酸溶液与足量稀 溶液迅速反应,测得放出
溶液迅速反应,测得放出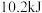 的热量。则表示该反应的热化学方程式为:
的热量。则表示该反应的热化学方程式为:___________ 。
(8)已知反应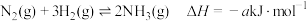 ;
; 、
、 键能分别为
键能分别为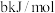 、
、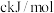 ,则
,则 的键能为
的键能为___________  (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(9)已知:
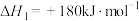

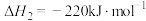
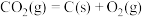
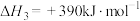
则反应 的
的
___________  。
。
(1)往
 溶液中滴加浓烧碱并加热:
溶液中滴加浓烧碱并加热:(2)往
 溶液中滴加稀盐酸溶液:
溶液中滴加稀盐酸溶液:(3)将
 气体与
气体与 充分发生反应:
充分发生反应:(4)
 溶液中通入少量
溶液中通入少量 气体:
气体:(5)往
 溶液中通入少量
溶液中通入少量 :
:Ⅱ.请按要求完成下列热化学知识小题(能量数据均为常温常压下的测定值):
(6)将
 氢气与足量氧气充分反应生成液态水,放出
氢气与足量氧气充分反应生成液态水,放出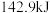 的热量。则表示氢气燃烧热的热化学方程式为:
的热量。则表示氢气燃烧热的热化学方程式为:(7)将含
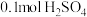 的稀硫酸溶液与足量稀
的稀硫酸溶液与足量稀 溶液迅速反应,测得放出
溶液迅速反应,测得放出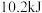 的热量。则表示该反应的热化学方程式为:
的热量。则表示该反应的热化学方程式为:(8)已知反应
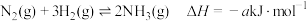 ;
; 、
、 键能分别为
键能分别为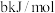 、
、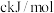 ,则
,则 的键能为
的键能为 (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。(9)已知:

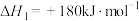

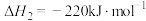
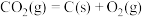
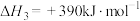
则反应
 的
的
 。
。
您最近一年使用:0次
名校
9 . 四氧化三锰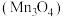 广泛应用于软磁材料、电池材料等高科技材料制备领域。一种以低品位锰矿(含
广泛应用于软磁材料、电池材料等高科技材料制备领域。一种以低品位锰矿(含 、
、 及少量
及少量 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
回答以下问题:
(1)元素Si在周期表的位置为___________ 。
(2)为提高反应和生产效率,“溶浸”时适宜采取的预处理措施是(回答一种措施)___________ 。不采取“升温”措施的原因是___________ 。
(3)“溶浸”时 发生反应的离子方程式为:
发生反应的离子方程式为:___________ 。此步骤的硫酸可用后续从“沉锰”滤液中获得的副产品 代替,但不能用盐酸代替,主要原因是:
代替,但不能用盐酸代替,主要原因是:___________ 。
(4)滤渣2主要成分的化学式为___________ 。
(5)“调pH=5”工艺中,以下的___________(填写序号)最适宜选作“物质A”来添加。
(6)写出“沉锰”工艺中反应的离子方程式___________ 。
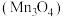 广泛应用于软磁材料、电池材料等高科技材料制备领域。一种以低品位锰矿(含
广泛应用于软磁材料、电池材料等高科技材料制备领域。一种以低品位锰矿(含 、
、 及少量
及少量 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下: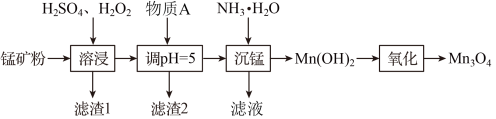
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 7.2 | 2.2 | 3.8 | 8.8 |
| 完全沉淀的pH | 9.5 | 3.2 | 5.0 | 10.4 |
(1)元素Si在周期表的位置为
(2)为提高反应和生产效率,“溶浸”时适宜采取的预处理措施是(回答一种措施)
(3)“溶浸”时
 发生反应的离子方程式为:
发生反应的离子方程式为: 代替,但不能用盐酸代替,主要原因是:
代替,但不能用盐酸代替,主要原因是:(4)滤渣2主要成分的化学式为
(5)“调pH=5”工艺中,以下的___________(填写序号)最适宜选作“物质A”来添加。
A. | B. | C. | D. |
(6)写出“沉锰”工艺中反应的离子方程式
您最近一年使用:0次
10 . 一定温度下,向恒容密闭容器中投入E和M发生如下反应:E(g)+M(g)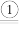 F(g)
F(g) G(g)。已知反应初始c0(E)=c0(M)=0.10mol/L,部分物质的浓度(c)随时间(t)的变化关系如图所示,t2后反应体系达到平衡状态。下列说法正确的是
G(g)。已知反应初始c0(E)=c0(M)=0.10mol/L,部分物质的浓度(c)随时间(t)的变化关系如图所示,t2后反应体系达到平衡状态。下列说法正确的是
 F(g)
F(g) G(g)。已知反应初始c0(E)=c0(M)=0.10mol/L,部分物质的浓度(c)随时间(t)的变化关系如图所示,t2后反应体系达到平衡状态。下列说法正确的是
G(g)。已知反应初始c0(E)=c0(M)=0.10mol/L,部分物质的浓度(c)随时间(t)的变化关系如图所示,t2后反应体系达到平衡状态。下列说法正确的是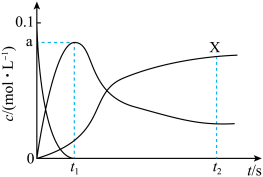
A.X为c(F)随 的变化曲线 的变化曲线 | B.0~t1内,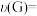  mol•L-1•s-1 mol•L-1•s-1 |
| C.反应的活化能:①>② | D.t2时,扩大容器的体积,n(F)减小 |
您最近一年使用:0次
2024-04-28更新
|
785次组卷
|
5卷引用:广西壮族自治区贵港市2024届高三下学期收网考化学试题
广西壮族自治区贵港市2024届高三下学期收网考化学试题广东省深圳市2024届高三二模考试化学试题(已下线)江苏省姜堰中学、如东中学、前黄中学三校2023-2024学年高三下学期联考化学试题2024届广东省高州市第一中学高三下学期5月考前热身训练化学试题2024届河南省鹤壁市高中高三下学期模拟预测化学试题



