1 . 实验小组制备高铁酸钾 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
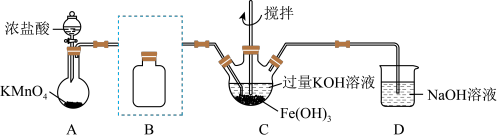
①A为氯气发生装置,写出A中反应的离子反应方程式,并用单线桥表示电子转移_______ 。
②将除杂装置B补充完整;并标明所用试剂_______ 。
③C中得到紫色固体和溶液。C中 发生的反应有
发生的反应有_______ 、_______ 。
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
i.由方案I中溶液变红可知a中含有_______ 离子,但该离子的产生不能判断一定 将
将 氧化,还可能由
氧化,还可能由_______ 产生(用离子方程式表示)。
ii.方案II可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
根据 的制备实验得出:氧化性
的制备实验得出:氧化性
_______  (填“>””或“<”),而方案II实验表明,
(填“>””或“<”),而方案II实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
①A为氯气发生装置,写出A中反应的离子反应方程式,并用单线桥表示电子转移
②将除杂装置B补充完整;并标明所用试剂
③C中得到紫色固体和溶液。C中
 发生的反应有
发生的反应有(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案I | 取少量a,滴加 溶液至过量,溶液呈红色 溶液至过量,溶液呈红色 |
| 方案II | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 产生。 产生。 |
 将
将 氧化,还可能由
氧化,还可能由ii.方案II可证明
 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>””或“<”),而方案II实验表明,
(填“>””或“<”),而方案II实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
2 . 某化学小组探究酸性条件下NO 、SO
、SO 、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验,忽略氧气对反应的影响)。
、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验,忽略氧气对反应的影响)。
查阅资料已知:
①可用KSCN溶液检验溶液中Fe3+的存在(显红色),但与Fe2+不显色。
②在氧化还原反应中稀硝酸做氧化剂时,生成的还原产物是污染性无色NO气体,NO气体常温下与氧气反应生成红棕色污染性气体NO2。

实验记录如下:
请回答下列问题:
(1)指出仪器a的名称_________ 。
(2)写出A装置中通入二氧化硫气体发生反应的离子方程式_________ 。
(3)实验Ⅱ中发生反应的离子方程式是_________ 。
(4)实验Ⅲ中,浅绿色溶液变为黄色的原因是_________ 。(用语言叙述)。
(5)若将实验Ⅳ改为:往A中通入空气,液面上方的现象_________ 。
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱顺序为_________ 。
 、SO
、SO 、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验,忽略氧气对反应的影响)。
、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验,忽略氧气对反应的影响)。查阅资料已知:
①可用KSCN溶液检验溶液中Fe3+的存在(显红色),但与Fe2+不显色。
②在氧化还原反应中稀硝酸做氧化剂时,生成的还原产物是污染性无色NO气体,NO气体常温下与氧气反应生成红棕色污染性气体NO2。

实验记录如下:
| 实验 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体 | A中溶液最终变为浅绿色 |
| Ⅱ | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀 |
| Ⅲ | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色 |
| Ⅳ | 取出Ⅲ中少量A装置中的溶液,加入KSCN溶液 | 溶液变为红色 |
(1)指出仪器a的名称
(2)写出A装置中通入二氧化硫气体发生反应的离子方程式
(3)实验Ⅱ中发生反应的离子方程式是
(4)实验Ⅲ中,浅绿色溶液变为黄色的原因是
(5)若将实验Ⅳ改为:往A中通入空气,液面上方的现象
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱顺序为
您最近一年使用:0次
名校
3 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是____ (锰被还原为Mn2+);氧化剂和还原剂的物质的量之比为______ 。
②将除杂装置B补充完整并标明所用试剂_____ 。
③C中得到紫色固体和溶液。C中Cl2发生的反应有_____ 、____ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
I.由方案I中溶液变红可知a中含有_____ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由____ 产生(用方程式表示)。
II.方案II可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是____ 。
②根据K2FeO4的制备实验得出:氧化性Cl2____ FeO (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_____ 。
③资料表明,酸性溶液中的氧化性FeO >MnO
>MnO ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO >MnO
>MnO 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案:____ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是
②将除杂装置B补充完整并标明所用试剂
③C中得到紫色固体和溶液。C中Cl2发生的反应有
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
II.方案II可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性FeO
 >MnO
>MnO ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO >MnO
>MnO 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
20-21高一下·浙江·阶段练习
4 . 在氮的化合物中,有一类盐叫亚硝酸盐,如亚硝酸钠(NaNO2)等。它们广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂;它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生过被误当食盐食用的事件。某同学查阅有关资料,了解到亚硝酸及亚硝酸盐的资料相一关信息:(1)HNO2是一种弱酸(比醋酸略强),且不稳定,易分解生成NO和NO2。(2)NO 既有氧化性又有还原性,能被常见的强氧化剂氧化,在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。(3)AgNO2是一种难溶于水、易溶于硝酸的化合物。下列有关说法不正确的是
既有氧化性又有还原性,能被常见的强氧化剂氧化,在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。(3)AgNO2是一种难溶于水、易溶于硝酸的化合物。下列有关说法不正确的是
 既有氧化性又有还原性,能被常见的强氧化剂氧化,在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。(3)AgNO2是一种难溶于水、易溶于硝酸的化合物。下列有关说法不正确的是
既有氧化性又有还原性,能被常见的强氧化剂氧化,在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。(3)AgNO2是一种难溶于水、易溶于硝酸的化合物。下列有关说法不正确的是| A.可用AgNO3和HNO3两种试剂来鉴别NaNO2和NaCl |
B.亚硝酸钠可以使酸性KMnO4溶液褪色,发生反应的离子方程式可表示为:5NO +2 +2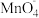 +6H+=5NO +6H+=5NO +2Mn2++3H2O +2Mn2++3H2O |
| C.在冷冻的亚硝酸钠溶液中加入稀硫酸、通入CO2或SO2均能制得HNO2 |
| D.若误食亚硝酸盐(如NaNO2),会导致血红蛋白中Fe2+被转化为Fe3+而中毒,可服用维生素C解毒,这个过程体现了维生素C的还原性 |
您最近一年使用:0次
名校
5 . 实验小组制备高铁酸钾( )并探究其性质。
)并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)

①A为氯气发生装置。A中反应的离子方程式是___________
②将除杂装置B补充完整并标明所用试剂___________ 。

③C中得到紫色固体和溶液。C中 发生的反应有
发生的反应有
 ,另外还有
,另外还有___________ 。
(2)探究 的性质
的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
ⅰ、由方案Ⅰ可知a中含有 离子,但该离子的产生不能判断一定是
离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由___________ 产生(用离子方程式表示)。
ⅱ、方案Ⅱ可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是___________ 。
②根据 的制备实验得出:氧化性
的制备实验得出:氧化性
___________  (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因可能是
的氧化性强弱关系相反,原因可能是___________ 。
 )并探究其性质。
)并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
①A为氯气发生装置。A中反应的离子方程式是
②将除杂装置B补充完整并标明所用试剂

③C中得到紫色固体和溶液。C中
 发生的反应有
发生的反应有
 ,另外还有
,另外还有(2)探究
 的性质
的性质①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,经过检验溶液中含有 。 。 |
| 方案Ⅱ | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。 产生。 |
 离子,但该离子的产生不能判断一定是
离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由ⅱ、方案Ⅱ可证明
 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因可能是
的氧化性强弱关系相反,原因可能是
您最近一年使用:0次
名校
解题方法
6 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。
②将除杂装置B补充完整并标明所用试剂___________ 。
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有___________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
ⅰ、由方案Ⅰ中溶液变红可知a中含有___________ ,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由___________ 产生(用方程式表示)。
ⅱ、方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是___________ 。
②根据K2FeO4的制备实验得出:氧化性:Cl2___________ FeO (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
③资料表明,酸性溶液中的氧化性:FeO >MnO
>MnO ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性:FeO
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性:FeO >MnO
>MnO 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案:___________ 。
(3)铁矿石中的铁元素通常以氧化物形式存在,可用通式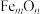 表示。为了确定某铁矿石中的
表示。为了确定某铁矿石中的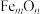 的组成,现进行如下实验:将少量该铁矿石样品粉碎,称取12.5g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌(假设只有Fe的氧化物溶解),过滤后,向所得滤液中加入5.0g铜粉,充分反应后过滤、洗涤、干燥得剩余固体1.8g,再将该过程所得滤液用浓度为1.0mol/L的酸性
的组成,现进行如下实验:将少量该铁矿石样品粉碎,称取12.5g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌(假设只有Fe的氧化物溶解),过滤后,向所得滤液中加入5.0g铜粉,充分反应后过滤、洗涤、干燥得剩余固体1.8g,再将该过程所得滤液用浓度为1.0mol/L的酸性 溶液滴定至终点,此时消耗酸性
溶液滴定至终点,此时消耗酸性 溶液的体积为25.0mL。
溶液的体积为25.0mL。
已知: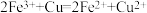 ,
,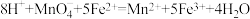 。
。
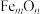 的化学式(m、n为正整数)为
的化学式(m、n为正整数)为___________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。
②将除杂装置B补充完整并标明所用试剂
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
ⅱ、方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性:Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性:FeO
 >MnO
>MnO ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性:FeO
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性:FeO >MnO
>MnO 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
(3)铁矿石中的铁元素通常以氧化物形式存在,可用通式
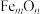 表示。为了确定某铁矿石中的
表示。为了确定某铁矿石中的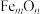 的组成,现进行如下实验:将少量该铁矿石样品粉碎,称取12.5g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌(假设只有Fe的氧化物溶解),过滤后,向所得滤液中加入5.0g铜粉,充分反应后过滤、洗涤、干燥得剩余固体1.8g,再将该过程所得滤液用浓度为1.0mol/L的酸性
的组成,现进行如下实验:将少量该铁矿石样品粉碎,称取12.5g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌(假设只有Fe的氧化物溶解),过滤后,向所得滤液中加入5.0g铜粉,充分反应后过滤、洗涤、干燥得剩余固体1.8g,再将该过程所得滤液用浓度为1.0mol/L的酸性 溶液滴定至终点,此时消耗酸性
溶液滴定至终点,此时消耗酸性 溶液的体积为25.0mL。
溶液的体积为25.0mL。已知:
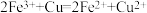 ,
,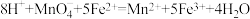 。
。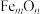 的化学式(m、n为正整数)为
的化学式(m、n为正整数)为
您最近一年使用:0次
2022-10-22更新
|
314次组卷
|
2卷引用:山东省泰安市宁阳县第四中学2022-2023学年高三上学期10月月考化学试题(等级考)
名校
解题方法
7 . Ⅰ.明胶是水溶性蛋白质混合物,溶于水形成胶体。工业明胶含有重金属 ,对人体有害。
,对人体有害。
(1)已知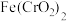 中
中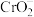 是一种酸根离子,则
是一种酸根离子,则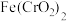 属于
属于___________ (填“酸”“碱”“盐”或“氧化物”),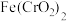 中铁元素的化合价为
中铁元素的化合价为___________ 价。
(2)明胶的水溶液和 溶液共同具有的性质是
溶液共同具有的性质是___________ (填字母)。
A.都不稳定,密封放置会产生沉淀 B.两者均有丁达尔效应 C.分散质粒子都可通过滤纸
Ⅱ. 是银白色金属,化学性质稳定,
是银白色金属,化学性质稳定, 价和
价和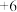 价为常见价态。工业上以铬铁矿(主要成分为
价为常见价态。工业上以铬铁矿(主要成分为 ,含
,含
 等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠
等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠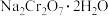 ,其主要工艺流程如下。
,其主要工艺流程如下。

查阅资料:常温下, 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为 。
。
(3)工业上常采用热还原法制备金属铬,写出以 为原料,利用铝热反应制取金属铬的化学方程式:
为原料,利用铝热反应制取金属铬的化学方程式:___________ 。
(4)酸化滤液D时,用硫酸而不用盐酸,可能的原因是___________ 。
(5)固体E的主要成分是 ,根据下图分析操作a为
,根据下图分析操作a为___________ 、___________ 。
(6)电镀厂产生的镀铜废水中往往含有一定量的 ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:

① 的化学性质与
的化学性质与 相似。在上述生产过程中加入
相似。在上述生产过程中加入 溶液时要控制溶液的
溶液时要控制溶液的 不能过高,是因为
不能过高,是因为___________ (用离子方程式表示)。
②下列溶液中可以代替上述流程中 溶液的是
溶液的是___________ (填字母)。
A.浓硫酸 B.酸性 溶液 C.
溶液 C. 溶液
溶液
③上述流程中,每消耗0.1mol 转移0.8mole-,则加入
转移0.8mole-,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为___________ 。
 ,对人体有害。
,对人体有害。(1)已知
 中
中 是一种酸根离子,则
是一种酸根离子,则 属于
属于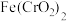 中铁元素的化合价为
中铁元素的化合价为(2)明胶的水溶液和
 溶液共同具有的性质是
溶液共同具有的性质是A.都不稳定,密封放置会产生沉淀 B.两者均有丁达尔效应 C.分散质粒子都可通过滤纸
Ⅱ.
 是银白色金属,化学性质稳定,
是银白色金属,化学性质稳定, 价和
价和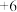 价为常见价态。工业上以铬铁矿(主要成分为
价为常见价态。工业上以铬铁矿(主要成分为 ,含
,含
 等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠
等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠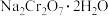 ,其主要工艺流程如下。
,其主要工艺流程如下。
查阅资料:常温下,
 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为 。
。(3)工业上常采用热还原法制备金属铬,写出以
 为原料,利用铝热反应制取金属铬的化学方程式:
为原料,利用铝热反应制取金属铬的化学方程式:(4)酸化滤液D时,用硫酸而不用盐酸,可能的原因是
(5)固体E的主要成分是
 ,根据下图分析操作a为
,根据下图分析操作a为
(6)电镀厂产生的镀铜废水中往往含有一定量的
 ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:
①
 的化学性质与
的化学性质与 相似。在上述生产过程中加入
相似。在上述生产过程中加入 溶液时要控制溶液的
溶液时要控制溶液的 不能过高,是因为
不能过高,是因为②下列溶液中可以代替上述流程中
 溶液的是
溶液的是A.浓硫酸 B.酸性
 溶液 C.
溶液 C. 溶液
溶液③上述流程中,每消耗0.1mol
 转移0.8mole-,则加入
转移0.8mole-,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为
您最近一年使用:0次
2021-12-04更新
|
87次组卷
|
2卷引用:宁夏回族自治区石嘴山市第三中学2022-2023学年高三上学期第一次月考化学试题
8 . Ⅰ.某工厂的酸性废水中主要含有Fe3+、Cu2+等离子,为了减少污染并变废为宝,工程师们设计了如图流程,回收铜和绿矾(FeSO4·7H2O)。
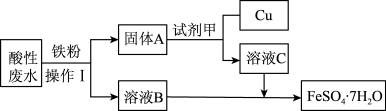
(1)操作1是_______ ;试剂甲是_______ (填化学式)。
(2)获得的FeSO4·7H2O需密闭保存,原因是_______ 。
(3)绿矾可消除某种酸性工业废水中+6价铬( )的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是
)的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是_______ 。
(4)黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是_______ (填化学式)。
Ⅱ.某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
氧化性强弱探究:
【分析与解释】
(5)实验Ⅰ中a试管中反应的离子方程式是_______ 。
(6)通过实验Ⅰ可以得出的结论是_______ 。
(7)①甲同学认为:实验Ⅱ观察到_______ 现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
补做实验Ⅲ的目的是_______ 。

(1)操作1是
(2)获得的FeSO4·7H2O需密闭保存,原因是
(3)绿矾可消除某种酸性工业废水中+6价铬(
 )的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是
)的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是(4)黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是
Ⅱ.某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
氧化性强弱探究:
| 实验Ⅰ | 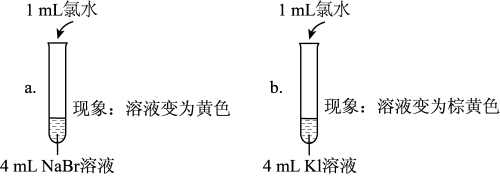 |
| 实验Ⅱ | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(5)实验Ⅰ中a试管中反应的离子方程式是
(6)通过实验Ⅰ可以得出的结论是
(7)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
| 实验Ⅲ | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
您最近一年使用:0次
2022-04-15更新
|
102次组卷
|
2卷引用:河北省衡水市武强中学2021-2022学年高一上学期第三次月考化学试题
9 . 某兴趣小组同学探究 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将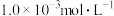 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。
【设计实验】
(1)补全 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:_______ 。

(2)实验①和②的目的是_______ 。
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a. 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:
反应ⅰ.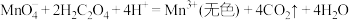
反应ⅱ.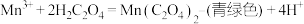
反应ⅲ。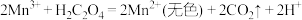
b. 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。
c. 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。
【继续探究】
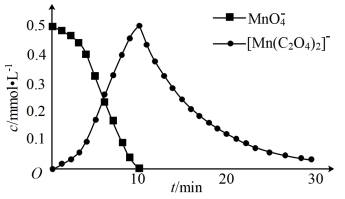
进一步实验证明溶液中含有 ,实验①反应过程中
,实验①反应过程中 和
和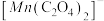 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ_______ 反应ⅲ(填“>”、“=”或“<”)。
(4)小组同学认为反应ⅱ的离子方程式应该改为: ,结合实验现象,说明其理由
,结合实验现象,说明其理由_______ 。
 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将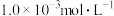 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。【设计实验】
| 序号 | V( 酸性溶液)/ 酸性溶液)/ | V(草酸溶液)/ | 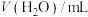 | 反应温度/ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:
(2)实验①和②的目的是
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a.
 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:反应ⅰ.
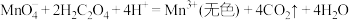
反应ⅱ.
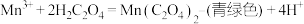
反应ⅲ。
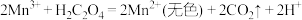
b.
 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。c.
 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。【继续探究】
进一步实验证明溶液中含有
 ,实验①反应过程中
,实验①反应过程中 和
和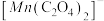 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ
(4)小组同学认为反应ⅱ的离子方程式应该改为:
 ,结合实验现象,说明其理由
,结合实验现象,说明其理由
您最近一年使用:0次
名校
10 . 某小组探究 氧化性、还原性的变化规律。
氧化性、还原性的变化规律。
资料: 、
、
(1)制备 :将
:将 溶于冰水中,产生少量气泡,得溶液A。向A中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。向A中加入过量稀 ,得溶液B。溶
,得溶液B。溶 用冰水,目的是
用冰水,目的是_______ 。
(2)检验 :向溶液A、B中分别滴加适量酸性
:向溶液A、B中分别滴加适量酸性 溶液。
溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
 发生还原反应:
发生还原反应:
 发生氧化反应:
发生氧化反应:_______ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:
猜想1. 有氧化性,能被还原为
有氧化性,能被还原为
猜想2. 有
有_______ 性,能与 反应产生
反应产生
猜想3.……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
ⅲ是ⅱ和ⅰ的对照实验。
①X是_______ 。
②a是_______ 、b是_______ 。
③取ⅰ中棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体。
(4)向一定浓度的 溶液中加入少量
溶液中加入少量 ,迅速产生大量气泡;随后加入
,迅速产生大量气泡;随后加入 ,固体溶解,气泡产生明显减弱。结合方程式解释原因
,固体溶解,气泡产生明显减弱。结合方程式解释原因_______ 。
(5)综上, 做氧化剂还是做还原剂,与
做氧化剂还是做还原剂,与_______ 等因素有关。
 氧化性、还原性的变化规律。
氧化性、还原性的变化规律。资料:
 、
、
(1)制备
 :将
:将 溶于冰水中,产生少量气泡,得溶液A。向A中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。向A中加入过量稀 ,得溶液B。溶
,得溶液B。溶 用冰水,目的是
用冰水,目的是(2)检验
 :向溶液A、B中分别滴加适量酸性
:向溶液A、B中分别滴加适量酸性 溶液。
溶液。Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
 发生还原反应:
发生还原反应:
 发生氧化反应:
发生氧化反应:Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含
 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:猜想1.
 有氧化性,能被还原为
有氧化性,能被还原为
猜想2.
 有
有 反应产生
反应产生
猜想3.……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| ⅰ | 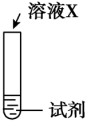 | a | 生成棕褐色固体,产生大量气泡 |
| ⅱ | b | 有少量气泡 | |
| ⅲ |  溶液 溶液 | 有少量气泡 |
①X是
②a是
③取ⅰ中棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体。
(4)向一定浓度的
 溶液中加入少量
溶液中加入少量 ,迅速产生大量气泡;随后加入
,迅速产生大量气泡;随后加入 ,固体溶解,气泡产生明显减弱。结合方程式解释原因
,固体溶解,气泡产生明显减弱。结合方程式解释原因(5)综上,
 做氧化剂还是做还原剂,与
做氧化剂还是做还原剂,与
您最近一年使用:0次
2022-05-19更新
|
427次组卷
|
3卷引用:北京大学附属中学预科部2023-2024学年高三下学期3月阶段练习化学试题



