1 . 实验小组制备高铁酸钾 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在0~5℃碱性溶液中较稳定。
,在0~5℃碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
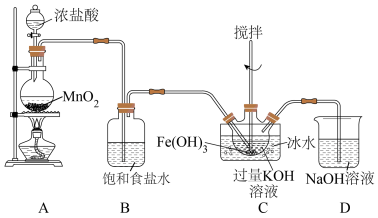
①装置A中反应的化学方程式是__________ 。
②B的作用是__________ 。
③C中得到紫色固体和溶液。C中 发生的反应有:
发生的反应有: ,还有:
,还有:__________ 。(用化学方程式表示)
(2)探究 的性质
的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
ⅰ.由方案Ⅰ中溶液变红可知a中含有__________ 离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由__________ 反应产生(用离子方程式表示)。
ⅱ.方案Ⅱ可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是__________ 。
②根据 的制备实验得出:氧化性
的制备实验得出:氧化性
__________  (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是__________ 。
③资料表明,酸性溶液中的氧化性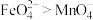 ,验证实验如下:将溶液b滴入
,验证实验如下:将溶液b滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性
的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性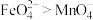 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:__________ 。
 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在0~5℃碱性溶液中较稳定。
,在0~5℃碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
①装置A中反应的化学方程式是
②B的作用是
③C中得到紫色固体和溶液。C中
 发生的反应有:
发生的反应有: ,还有:
,还有:(2)探究
 的性质
的性质①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:方案Ⅰ | 取少量a,滴加 溶液至过量,溶液呈红色 溶液至过量,溶液呈红色 |
方案Ⅱ | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生 产生 |
 将
将 氧化,还可能由
氧化,还可能由ⅱ.方案Ⅱ可证明
 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
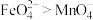 ,验证实验如下:将溶液b滴入
,验证实验如下:将溶液b滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性
的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性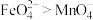 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
名校
2 . 某化学学习小组经查阅资料发现: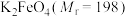 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。现制备高铁酸钾
,在碱性溶液中较稳定。现制备高铁酸钾 ,测定其纯度并探究其性质。
,测定其纯度并探究其性质。
(1)制备 (夹持装置略)
(夹持装置略)

①A为气体发生装置,写出对应的离子方程式_______ 。
②装置B的作用为_______ 。
③装置C中主要反应的化学方程式为_______ 。
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否是
。为证明是否是 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
①补全方案Ⅰ中实验步骤:取少量a于试管中,_______ ,但该离子的产生不能判断一定是 被
被 还原得到,还可能由
还原得到,还可能由_______ 产生(用离子反应方程式表示)。
②方案Ⅱ可证明 氧化了
氧化了 ,用
,用 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
③小组同学对比方案Ⅱ实验和 的制备实验发现:
的制备实验发现: 和
和 的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是_______ 。
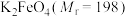 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。现制备高铁酸钾
,在碱性溶液中较稳定。现制备高铁酸钾 ,测定其纯度并探究其性质。
,测定其纯度并探究其性质。(1)制备
 (夹持装置略)
(夹持装置略)
①A为气体发生装置,写出对应的离子方程式
②装置B的作用为
③装置C中主要反应的化学方程式为
(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否是
。为证明是否是 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a于试管中,… |
| 方案Ⅱ | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b;取少量b,滴加盐酸,有 溶出,得到紫色溶液b;取少量b,滴加盐酸,有 产生。 产生。 |
 被
被 还原得到,还可能由
还原得到,还可能由②方案Ⅱ可证明
 氧化了
氧化了 ,用
,用 溶液洗涤的目的是
溶液洗涤的目的是③小组同学对比方案Ⅱ实验和
 的制备实验发现:
的制备实验发现: 和
和 的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
您最近一年使用:0次
名校
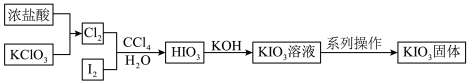
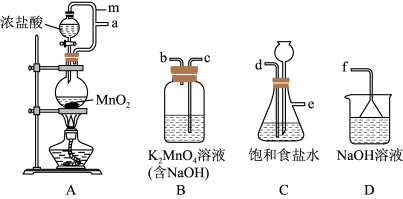
3 . 碘酸钾(KIO3)是重要的食品添加剂,某化学兴趣小组查阅资料得知,HIO3与KIO3均为白色固体,能溶于水,难溶于部分有机溶剂,且KIO3在碱性条件下易被ClO 氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
 氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
氧化为KIO4,于是设计了以下路线制备碘酸钾。下列有关说法正确的是
| A.浓盐酸在反应中体现了氧化性 |
| B.加入CCl4目的是萃取I2 |
| C.加入KOH前,应先对原溶液加热煮沸 |
| D.系列操作包括:加入乙醇溶液、搅拌、静置、过滤、洗涤、干燥 |
您最近一年使用:0次
2020-11-26更新
|
622次组卷
|
2卷引用:江苏省南京市第二十九中2020-2021学年高二上学期12月调研化学试题
名校
4 . 草酸(H2C2O4)是一种常见二元弱酸,易溶于水,常用来做还原剂、沉淀剂、媒染剂、络合剂等。某化学学习兴趣小组欲制备草酸并探究其某些化学性质,经查找资料:乙炔在45-55℃硝酸汞作催化剂的条件下,经浓硝酸氧化可制得草酸。
[草酸的制备]
甲同学以电石(主要成分CaC2)、浓硝酸及少量硝酸汞为原料,利用如图装置制备草酸。

(1)仪器a的名称_______
(2)实验室制乙炔时用饱和食盐水代替水的目的是。_______ 。反应时C中产生大量红棕色气体,请写出C中发生化学反应方程式_______ 。
[产品中草酸晶体(H2C2O4·2H2O)质量分数的测定]
乙同学准确称取ag产品,配成100mL水溶液,取20mL所配制的溶液置于锥形瓶内,用cmol·L-1酸性KMnO4标准溶液滴定至终点,平行实验三次,平均消耗标准溶液vmL。试回答:
(3)上述滴定实验中发生的离子反应方程式_______ ,判断到达滴定终点的现象是_______ 。
(4)产品中草酸晶体(H2C2O4·2H2O)的质量分数为_______ (用a、v表示)
[草酸的性质]
(5)上述酸性高锰酸钾与草酸反应,体现了草酸_______ (填酸性、氧化性或还原性)
(6)室温下已知:Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.5×104,通过下列实验探究草酸的性质。[1g2=0.3,lg3=0.5]。向10mL0.1mol/LH2C2O4溶液中逐滴加入VmL0.1mol/LNaOH溶液,当V从0逐渐增大至20时,测得混合溶液的pH逐渐增大,下列说法正确的是_______(填字母)
[草酸的制备]
甲同学以电石(主要成分CaC2)、浓硝酸及少量硝酸汞为原料,利用如图装置制备草酸。

(1)仪器a的名称
(2)实验室制乙炔时用饱和食盐水代替水的目的是。
[产品中草酸晶体(H2C2O4·2H2O)质量分数的测定]
乙同学准确称取ag产品,配成100mL水溶液,取20mL所配制的溶液置于锥形瓶内,用cmol·L-1酸性KMnO4标准溶液滴定至终点,平行实验三次,平均消耗标准溶液vmL。试回答:
(3)上述滴定实验中发生的离子反应方程式
(4)产品中草酸晶体(H2C2O4·2H2O)的质量分数为
[草酸的性质]
(5)上述酸性高锰酸钾与草酸反应,体现了草酸
(6)室温下已知:Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.5×104,通过下列实验探究草酸的性质。[1g2=0.3,lg3=0.5]。向10mL0.1mol/LH2C2O4溶液中逐滴加入VmL0.1mol/LNaOH溶液,当V从0逐渐增大至20时,测得混合溶液的pH逐渐增大,下列说法正确的是_______(填字母)
A.当V=10时,溶液中离子浓度关系:c(Na+)>c(HC2O )>c(C2O )>c(C2O )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
B.当溶液中c(C2O )=c(HC2O )=c(HC2O )时,混合溶液的pH约为3.8 )时,混合溶液的pH约为3.8 |
C.当溶液中c(C2O )+c(HC2O )+c(HC2O )=c(Na+)时,混合溶液的pH=7 )=c(Na+)时,混合溶液的pH=7 |
D.当溶液中c(Na+)=2c(C2O )+2c(HC2O )+2c(HC2O )+2c(H2C2O4)时,混合溶液的pH>7 )+2c(H2C2O4)时,混合溶液的pH>7 |
您最近一年使用:0次
2022-04-17更新
|
459次组卷
|
4卷引用:湖南省邵阳市第一中学2023届高三第五次月考化学试题
湖南省邵阳市第一中学2023届高三第五次月考化学试题江西省上饶市六校2022届高三第二次联考理科综合化学试题(已下线)化学(辽宁A卷)-学易金卷:2023年高考第一次模拟考试卷辽宁省葫芦岛市第一高级中学2022-2023学年高三上学期期末线上教学阶段检测化学试题
名校
解题方法
5 .  是一种常用的氧化剂。某实验小组利用氯气氧化
是一种常用的氧化剂。某实验小组利用氯气氧化 制备
制备 并对其性质进行探究。
并对其性质进行探究。
资料:①锰酸钾( )在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: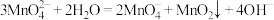
②酸性条件下的氧化性: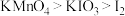
I. 的制备
的制备
(1)从A~D中选择合适的装置制备 ,正确的连接顺序是a→
,正确的连接顺序是a→_______ (按气流方向,用小写字母表示):装置A中m的作用是_______ 。若没有使用装置C,造成的影响是_________ 。
II. 性质探究
性质探究
取适量制取的 溶液稀释至约0.01mol/L(用硫酸酸化至pH=1),取配制好的
溶液稀释至约0.01mol/L(用硫酸酸化至pH=1),取配制好的 溶液2mL于试管中,逐滴滴加0.1mol/L KI溶液,
溶液2mL于试管中,逐滴滴加0.1mol/L KI溶液, 紫色溶液迅速变为棕褐色悬浊液,然后沉淀逐渐消失,最终溶液变为棕黄色。
紫色溶液迅速变为棕褐色悬浊液,然后沉淀逐渐消失,最终溶液变为棕黄色。
(2)最终溶液呈现棕黄色推测生成了______________ (写化学式)。
实验小组对初始阶段的产物成分进行探究:
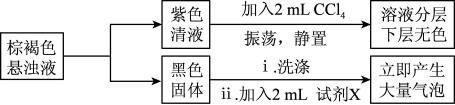
(3)黑色固体是 ,试剂X是
,试剂X是___________ (写化学式)。
(4)在“紫色清液”中存在 ,下列实验方案中,可用于检验“紫色清液”中是否存在
,下列实验方案中,可用于检验“紫色清液”中是否存在 的是
的是____ (填序号)。
A.用洁净的玻璃棒随取紫色清液滴在淀粉—KI试纸上,观察试纸是否变蓝色。
B.取少量紫色清液于试管中,向其中加入几滴淀粉溶液,溶液不变蓝,再加入过量 溶液,观察溶液是否变色。
溶液,观察溶液是否变色。
C.取少量紫色清液于试管中,加入稀硝酸酸化,再加入几滴硝酸银溶液,观察是否生成黄色沉淀。
探究实验II中棕褐色沉淀消失的原因:
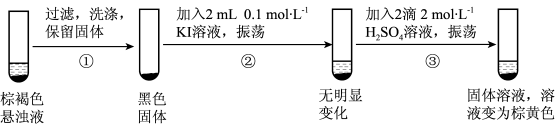
(5)用化学方程式解释步骤③中固体消失的原因_______________________ 。
(6)由上述实验可知, 的还原产物与
的还原产物与______ 有关。
 是一种常用的氧化剂。某实验小组利用氯气氧化
是一种常用的氧化剂。某实验小组利用氯气氧化 制备
制备 并对其性质进行探究。
并对其性质进行探究。资料:①锰酸钾(
 )在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: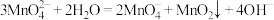
②酸性条件下的氧化性:
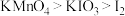
I.
 的制备
的制备
(1)从A~D中选择合适的装置制备
 ,正确的连接顺序是a→
,正确的连接顺序是a→II.
 性质探究
性质探究取适量制取的
 溶液稀释至约0.01mol/L(用硫酸酸化至pH=1),取配制好的
溶液稀释至约0.01mol/L(用硫酸酸化至pH=1),取配制好的 溶液2mL于试管中,逐滴滴加0.1mol/L KI溶液,
溶液2mL于试管中,逐滴滴加0.1mol/L KI溶液, 紫色溶液迅速变为棕褐色悬浊液,然后沉淀逐渐消失,最终溶液变为棕黄色。
紫色溶液迅速变为棕褐色悬浊液,然后沉淀逐渐消失,最终溶液变为棕黄色。(2)最终溶液呈现棕黄色推测生成了
实验小组对初始阶段的产物成分进行探究:

(3)黑色固体是
 ,试剂X是
,试剂X是(4)在“紫色清液”中存在
 ,下列实验方案中,可用于检验“紫色清液”中是否存在
,下列实验方案中,可用于检验“紫色清液”中是否存在 的是
的是A.用洁净的玻璃棒随取紫色清液滴在淀粉—KI试纸上,观察试纸是否变蓝色。
B.取少量紫色清液于试管中,向其中加入几滴淀粉溶液,溶液不变蓝,再加入过量
 溶液,观察溶液是否变色。
溶液,观察溶液是否变色。C.取少量紫色清液于试管中,加入稀硝酸酸化,再加入几滴硝酸银溶液,观察是否生成黄色沉淀。
探究实验II中棕褐色沉淀消失的原因:

(5)用化学方程式解释步骤③中固体消失的原因
(6)由上述实验可知,
 的还原产物与
的还原产物与
您最近一年使用:0次
名校
解题方法
6 . 某兴趣小组同学探究 溶液与草酸(
溶液与草酸( )溶液反应速率的影响因素。配制
)溶液反应速率的影响因素。配制 mol⋅L
mol⋅L
 溶液、0.40mol·L
溶液、0.40mol·L 草酸溶液。将
草酸溶液。将 溶液与草酸溶液按如下比例混合。
溶液与草酸溶液按如下比例混合。
【设计实验】
(1)表格中
_____ ,实验①和②的目的是_____ 。
(2)甲认为上述实验应控制pH相同,可加入的试剂是_____ (填序号)。
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:ⅰ。紫色溶液变为青色溶液,ⅱ。青色溶液逐渐褪至无色溶液。
资料:(a) 在溶液中无色,在草酸中不能形成配合物;
在溶液中无色,在草酸中不能形成配合物;
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应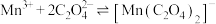 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段ⅰ中可能产生了 。你认为该观点是否合理,并说明理由:
。你认为该观点是否合理,并说明理由:_____ 。
【继续探究】
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。

(4)第ⅰ阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为_____ 。
(5)实验②在第ⅱ阶段的反应速率较大,可能的原因是_____ 。
(6)为了验证上述(5)中说法,设计如下实验:在第ⅱ阶段将 调节至0.2mol/L,现象是
调节至0.2mol/L,现象是_____ ,由此现象可证明上述猜想合理。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是_____ 。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
 溶液与草酸(
溶液与草酸( )溶液反应速率的影响因素。配制
)溶液反应速率的影响因素。配制 mol⋅L
mol⋅L
 溶液、0.40mol·L
溶液、0.40mol·L 草酸溶液。将
草酸溶液。将 溶液与草酸溶液按如下比例混合。
溶液与草酸溶液按如下比例混合。【设计实验】
| 序号 |  /mL /mL | V(草酸)/mL |  /mL /mL | 反应温度/℃ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | x | 20 |

(2)甲认为上述实验应控制pH相同,可加入的试剂是
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:ⅰ。紫色溶液变为青色溶液,ⅱ。青色溶液逐渐褪至无色溶液。
资料:(a)
 在溶液中无色,在草酸中不能形成配合物;
在溶液中无色,在草酸中不能形成配合物;(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应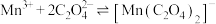 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段ⅰ中可能产生了
 。你认为该观点是否合理,并说明理由:
。你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
(4)第ⅰ阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ⅱ阶段的反应速率较大,可能的原因是
(6)为了验证上述(5)中说法,设计如下实验:在第ⅱ阶段将
 调节至0.2mol/L,现象是
调节至0.2mol/L,现象是【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
名校
7 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速反应产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为______ 。
②除杂装置B中盛装的试剂为________ 。
③C中有多个反应发生,其中生成高铁酸钾的化学反应方程式为_________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
I.由方案I中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl—氧化,该离子还可能由反应_______ 产生(用离子方程式表示)。
II.方案II可证明K2FeO4氧化Cl—,用KOH溶液洗涤的目的是排除______ 的干扰。
②根据K2FeO4的制备实验得出:氧化性Cl2______ FeO (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速反应产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为
②除杂装置B中盛装的试剂为
③C中有多个反应发生,其中生成高铁酸钾的化学反应方程式为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生。 |
II.方案II可证明K2FeO4氧化Cl—,用KOH溶液洗涤的目的是排除
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
名校
8 . 铁及其化合物在生产、生活中有着广泛的应用。
Ⅰ.FeSO4可作补血剂,用于治疗缺铁性贫血症。
(1)配制FeSO4溶液时需加入_______ 防止Fe2+被氧化,Fe(OH)2沉淀露置在空气中被氧化的化学反应方程式为_______ 。
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、无毒的多功能水处理剂。查阅资料已知:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(2)制备K2FeO4。
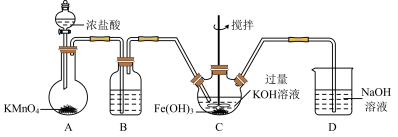
①在装置A中发生的化学反应中HCl显示出来的性质为_______ 。
②B中装的药品是_______ 。
③C中,氯气先与KOH反应生成次氯酸钾,次氯酸钾再与氢氧化铁和KOH反应生成高铁酸钾(K2FeO4),在该反应体系中,71g氯气完全反应后理论上最多可生成高铁酸钾_______ g。
(3)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为探究K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
由方案I中溶液变红可知a中含有Fe3+,该离子的产生能否判断它是由K2FeO4被Cl-还原形成的,并说明理由?_______ 。
(4)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:□FeO +□H+=□O2↑+□Fe3++□_______。完成并配平上述离子方程式
+□H+=□O2↑+□Fe3++□_______。完成并配平上述离子方程式_______ (方框内填化学计量数,横线上写物质)。
Ⅲ.Fe3O4俗称磁性氧化铁,可用来作录音磁带和电讯器材的原材料。某同学利用Fe3O4固体进行如下实验:
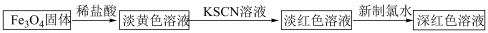
(5)某同学发现实验中加入过量新制氯水,放置一段时间后,深红色会逐渐褪去,褪色后的溶液中继续滴加KSCN溶液,又出现红色,则褪色的原因可能是_______ ;
(6)该同学将上述实验中的新制氯水改为H2O2溶液,也能出现深红色溶液,用离子方程式表示溶液颜色加深的原因_______ 。
Ⅰ.FeSO4可作补血剂,用于治疗缺铁性贫血症。
(1)配制FeSO4溶液时需加入
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、无毒的多功能水处理剂。查阅资料已知:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(2)制备K2FeO4。

①在装置A中发生的化学反应中HCl显示出来的性质为
②B中装的药品是
③C中,氯气先与KOH反应生成次氯酸钾,次氯酸钾再与氢氧化铁和KOH反应生成高铁酸钾(K2FeO4),在该反应体系中,71g氯气完全反应后理论上最多可生成高铁酸钾
(3)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为探究K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。 |
(4)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:□FeO
 +□H+=□O2↑+□Fe3++□_______。完成并配平上述离子方程式
+□H+=□O2↑+□Fe3++□_______。完成并配平上述离子方程式Ⅲ.Fe3O4俗称磁性氧化铁,可用来作录音磁带和电讯器材的原材料。某同学利用Fe3O4固体进行如下实验:
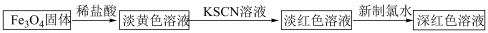
(5)某同学发现实验中加入过量新制氯水,放置一段时间后,深红色会逐渐褪去,褪色后的溶液中继续滴加KSCN溶液,又出现红色,则褪色的原因可能是
(6)该同学将上述实验中的新制氯水改为H2O2溶液,也能出现深红色溶液,用离子方程式表示溶液颜色加深的原因
您最近一年使用:0次
名校
解题方法
9 . 浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质。
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:
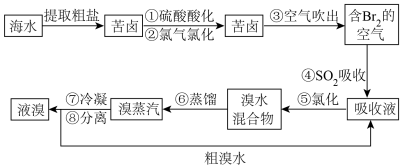
(1)用热空气能将溴单质吹出的原因是___________ 。
(2)写出④发生反应的化学方程式___________ 。
(3)已知某溶液中 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的___________ 。
Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
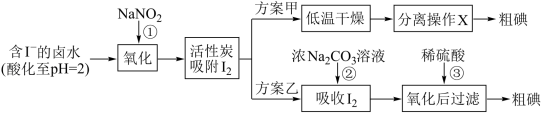
资料显示:
ⅰ.pH=2时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NO
ⅱ.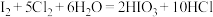 ;氧化性:
;氧化性: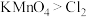
ⅲ.
(4)请列举除蒸馏法外海水淡化的一种方法:___________ 。
(5)写出反应①的离子方程式___________ 。
(6)方案甲中,根据 的特性,分离操作X应为
的特性,分离操作X应为___________ 、冷凝结晶。
(7) 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是___________ 。
(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。
a.将滤液用 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,___________ 。
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:

(1)用热空气能将溴单质吹出的原因是
(2)写出④发生反应的化学方程式
(3)已知某溶液中
 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
ⅰ.pH=2时,
 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NOⅱ.
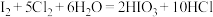 ;氧化性:
;氧化性: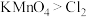
ⅲ.

(4)请列举除蒸馏法外海水淡化的一种方法:
(5)写出反应①的离子方程式
(6)方案甲中,根据
 的特性,分离操作X应为
的特性,分离操作X应为(7)
 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的
 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。实验中可供选择的试剂:稀
 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。a.将滤液用
 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,b.从水层取少量溶液于试管中,
您最近一年使用:0次
2023-05-25更新
|
405次组卷
|
2卷引用:天津市第一中学2022—2023学年高一下学期第二次月考化学试题
名校
解题方法
10 . 实验表明,当乙醛加入到溴水中,溴水会褪色。针对此现象,某小组同学依据乙醛结构进行探究。
【实验假设】
(1)假设Ⅰ:醛基含有不饱和键,可与 发生
发生_________ 反应(填反应类型)。
假设Ⅱ:乙醛具有α-H,可与溴水发生取代反应。一元取代反应如下:

无论是几元取代,参加反应的 与生成的HBr物质的量之比为
与生成的HBr物质的量之比为_________ 。
假设Ⅲ:乙醛具有较强的还原性,可被溴水氧化为乙酸,补全下面反应方程式。
方案Ⅰ:通过对比反应现象判断反应类型。
结论:假设Ⅰ不成立。
(2)试管2中的实验现象为__________ 。
方案Ⅱ:通过测定反应后混合液的pH判断反应类型。
注:苯酚和乙酸的电离及温度变化对混合液pH的影响可忽略。
(3)写出苯酚与溴水反应的化学方程式:____________________________________ 。
(4)若试管2中反应后混合液的pH=1.85,则证明乙醛与溴水的反应类型为______ 反应;若pH接近______ ,则证明为氧化反应(lg2≈0.3);若pH介于两者之间,则证明两种反应类型皆有。
【实验结论与反思】
(5)根据实验数据得出结论:乙醛与溴水发生氧化反应。查阅资料,乙醛并非直接与 发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:
发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:______________ 。
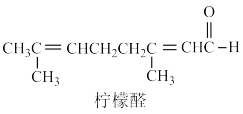
(6)已知柠檬醛的结构如图,结合上述实验,检验柠檬醛分子中存在碳碳双键的合理方法为 (填字母序号)。
【实验假设】
(1)假设Ⅰ:醛基含有不饱和键,可与
 发生
发生假设Ⅱ:乙醛具有α-H,可与溴水发生取代反应。一元取代反应如下:

无论是几元取代,参加反应的
 与生成的HBr物质的量之比为
与生成的HBr物质的量之比为假设Ⅲ:乙醛具有较强的还原性,可被溴水氧化为乙酸,补全下面反应方程式。

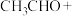



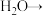



方案Ⅰ:通过对比反应现象判断反应类型。
序号 | 操作 | 现象 |
试管1 | 1mL溴水+1mL乙醛,充分振荡后静置 | 褪色 |
试管2 | 1mL溴的 溶液+1mL乙醛,充分振荡后静置 溶液+1mL乙醛,充分振荡后静置 | ____ |
(2)试管2中的实验现象为
方案Ⅱ:通过测定反应后混合液的pH判断反应类型。
序号 | 操作 | pH |
试管1 | 加入20mL溴水,再加入10mL苯酚溶液,待完全反应后(苯酚过量),测定混合液pH | 1.85 [ |
试管2 | 加入20mL相同浓度的溴水,再加入10mL 20%的乙醛溶液(乙醛过量),3min后完全褪色,测定混合液pH | ____________ |
(3)写出苯酚与溴水反应的化学方程式:
(4)若试管2中反应后混合液的pH=1.85,则证明乙醛与溴水的反应类型为
【实验结论与反思】
(5)根据实验数据得出结论:乙醛与溴水发生氧化反应。查阅资料,乙醛并非直接与
 发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:
发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:(6)已知柠檬醛的结构如图,结合上述实验,检验柠檬醛分子中存在碳碳双键的合理方法为 (填字母序号)。
| A.向酸性高锰酸钾溶液中加适量柠檬醛,观察其是否褪色 |
| B.向溴水中加适量柠檬醛,观察其是否褪色 |
C.向溴的 溶液中加适量柠檬醛,观察其是否褪色 溶液中加适量柠檬醛,观察其是否褪色 |
| D.向新制氢氧化铜悬浊液中加适量柠檬醛,加热,冷却后取上层清液再加溴水,观察其是否褪色 |
您最近一年使用:0次
2022-11-02更新
|
574次组卷
|
7卷引用:北京市第二中学2022-2023学年高三上学期12月考化学试题
北京市第二中学2022-2023学年高三上学期12月考化学试题北京市海淀区2022-2023学年高三上学期期中考试化学试题(已下线)北京市海淀区2022届高三一模(实验探究题)(已下线)T28-实验探究题北京市第八中学2022-2023学年高二下学期期末考试化学试题北京理工大学附属中学2023-2024学年高二下学期期中考试化学试题 (已下线)题型突破02 有机实验(综合题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)

 ]
]

