2024高三·全国·专题练习
解题方法
1 . 氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:①反应I: ΔH1=-1266.6 kJ· mol-1;
ΔH1=-1266.6 kJ· mol-1;
②H2的燃烧热ΔH2=-285.8 kJ·mol-1;
③水的气化时ΔH3=+44.0 kJ·mol-1。
反应I热力学趋势很大(平衡常数很大)的原因为___________ 。
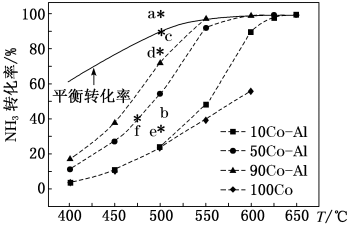
(2)在CoAl催化剂体系中,压强p0下氨气以一定流速通过反应器,得到不同催化剂下氨气转化率随温度变化曲线如图,活化能最小的催化剂为___________ ,温度高时NH3的转化率接近平衡转化率的原因为___________ 。如果增大气体流速,则b点对应的点可能为___________ (填“a”“c”“d”“e”或“f”);___________ ,NH3分解率为___________ 。
(1)已知:①反应I:
 ΔH1=-1266.6 kJ· mol-1;
ΔH1=-1266.6 kJ· mol-1;②H2的燃烧热ΔH2=-285.8 kJ·mol-1;
③水的气化时ΔH3=+44.0 kJ·mol-1。
反应I热力学趋势很大(平衡常数很大)的原因为
(2)在CoAl催化剂体系中,压强p0下氨气以一定流速通过反应器,得到不同催化剂下氨气转化率随温度变化曲线如图,活化能最小的催化剂为
您最近一年使用:0次
解题方法
2 . 工业上常用合成气(主要成分为CO、H2)在一定条件下制备甲醇,其涉及反应如下:
反应Ⅰ.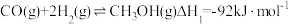
反应Ⅱ.
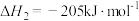 ;
;
反应Ⅲ.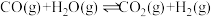
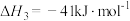 。
。
回答下列问题:
(1)在催化剂作用下也可以由CO2制备甲醇:
 ,则
,则
_____ kJ·mol-1;该反应在_____ (填“高温”“低温”或“任意温度”)下可自发进行。
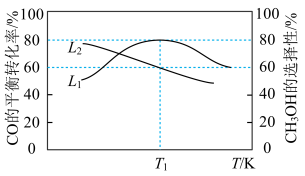
(2)向容积为2L的刚性密闭容器中充入2molCO和4molH2发生上述反应,测得不同温度下,CO的平衡转化率、CH3OH的选择性如图所示[CH3OH的选择性=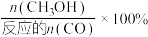 ]。
]。_____ (填“L1”或“L2”)。
②T1K下,2min时达到平衡,此时体系压强为aPa,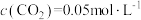 。用CH4的分压变化表示的化学反应速率为
。用CH4的分压变化表示的化学反应速率为_____  。
。
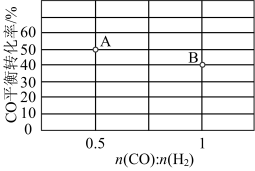
(3)维持CO和H2的物质的量之和为3mol,若在1L恒容密闭容器中只发生上述反应Ⅰ,调整进气比n(CO);n(H2)不同,温度不同时,测得相应的CO平衡转化率如图所示。则A和B两点的温度:T(A)_____ (填“<”“>”或“=”)T(B),其判断依据是_____ 。
反应Ⅰ.
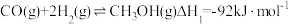
反应Ⅱ.

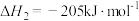 ;
;反应Ⅲ.
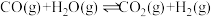
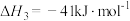 。
。回答下列问题:
(1)在催化剂作用下也可以由CO2制备甲醇:

 ,则
,则
(2)向容积为2L的刚性密闭容器中充入2molCO和4molH2发生上述反应,测得不同温度下,CO的平衡转化率、CH3OH的选择性如图所示[CH3OH的选择性=
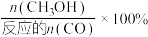 ]。
]。
②T1K下,2min时达到平衡,此时体系压强为aPa,
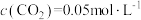 。用CH4的分压变化表示的化学反应速率为
。用CH4的分压变化表示的化学反应速率为 。
。(3)维持CO和H2的物质的量之和为3mol,若在1L恒容密闭容器中只发生上述反应Ⅰ,调整进气比n(CO);n(H2)不同,温度不同时,测得相应的CO平衡转化率如图所示。则A和B两点的温度:T(A)
您最近一年使用:0次
解题方法
3 . 氯化磷酸三钠(简称氯钠)通常表示为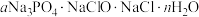 ,是一种固体杀菌消毒剂、水体软化剂、净水剂,常温下较稳定,受热易分解。在水溶液中可直接与钙、镁及重金属离子形成不溶性磷酸盐沉淀,同时可使溶液中不溶性杂质凝聚而沉降。可由磷酸三钠与次氯酸钠溶液反应制得。某学习小组设计如下实验。回答下列问题:
,是一种固体杀菌消毒剂、水体软化剂、净水剂,常温下较稳定,受热易分解。在水溶液中可直接与钙、镁及重金属离子形成不溶性磷酸盐沉淀,同时可使溶液中不溶性杂质凝聚而沉降。可由磷酸三钠与次氯酸钠溶液反应制得。某学习小组设计如下实验。回答下列问题:
Ⅰ.制备次氯酸钠溶液
制备装置如图所示(夹持装置省略)。_____ ;X可以选择下列药品中的_____ (填字母)。
a.KClO3 b.MnO2 c.KMnO4 d.Ca(ClO)2
(2)装置C中发生反应的离子方程式为_____ ;虚线框中装置D的作用为_____ 。
Ⅱ.制备氯钠
将Na3PO4加入实验Ⅰ制备的次氯酸钠溶液中,充分混合,减压蒸发,低温干燥,得到氯钠晶体。
(3)减压蒸发的目的是_____ 。
(4)氯钠除去水中Cu2+的离子方程式为_____ 。
Ⅲ.氯钠样品中有效氯含量的测定
实验步骤如下:
①取2.500g氯钠样品溶于蒸馏水中,配成250mL溶液,取25.00mL待测液于锥形瓶中,迅速加入20mL过量的KI溶液,再加入5mLH2SO4酸化,充分反应5min,滴入淀粉作指示剂,用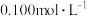 Na2S2O3标准溶液滴定至终点,三次实验消耗Na2S2O3标准溶液的平均体积为11.30mL。
Na2S2O3标准溶液滴定至终点,三次实验消耗Na2S2O3标准溶液的平均体积为11.30mL。
②另取25.00mL蒸馏水代替样品溶液放入锥形瓶中,重复①中实验操作,进行空白实验,消耗Na2S2O3标准溶液的平均体积为1.30mL。
已知:含氯消毒剂中“有效氯”的含量是指与HI作用生成相同量的I2,所需Cl2的质量与指定化合物的质量之比; 。
。
(5)配制氯钠溶液用到的定量玻璃仪器有_____ 。
(6)若实验步骤②进行空白实验,滴定前,忘记充分反应5min,则样品有效氯含量会_____ (填“偏大”“偏小”或“不变”)。
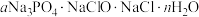 ,是一种固体杀菌消毒剂、水体软化剂、净水剂,常温下较稳定,受热易分解。在水溶液中可直接与钙、镁及重金属离子形成不溶性磷酸盐沉淀,同时可使溶液中不溶性杂质凝聚而沉降。可由磷酸三钠与次氯酸钠溶液反应制得。某学习小组设计如下实验。回答下列问题:
,是一种固体杀菌消毒剂、水体软化剂、净水剂,常温下较稳定,受热易分解。在水溶液中可直接与钙、镁及重金属离子形成不溶性磷酸盐沉淀,同时可使溶液中不溶性杂质凝聚而沉降。可由磷酸三钠与次氯酸钠溶液反应制得。某学习小组设计如下实验。回答下列问题:Ⅰ.制备次氯酸钠溶液
制备装置如图所示(夹持装置省略)。
a.KClO3 b.MnO2 c.KMnO4 d.Ca(ClO)2
(2)装置C中发生反应的离子方程式为
Ⅱ.制备氯钠
将Na3PO4加入实验Ⅰ制备的次氯酸钠溶液中,充分混合,减压蒸发,低温干燥,得到氯钠晶体。
(3)减压蒸发的目的是
(4)氯钠除去水中Cu2+的离子方程式为
Ⅲ.氯钠样品中有效氯含量的测定
实验步骤如下:
①取2.500g氯钠样品溶于蒸馏水中,配成250mL溶液,取25.00mL待测液于锥形瓶中,迅速加入20mL过量的KI溶液,再加入5mLH2SO4酸化,充分反应5min,滴入淀粉作指示剂,用
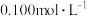 Na2S2O3标准溶液滴定至终点,三次实验消耗Na2S2O3标准溶液的平均体积为11.30mL。
Na2S2O3标准溶液滴定至终点,三次实验消耗Na2S2O3标准溶液的平均体积为11.30mL。②另取25.00mL蒸馏水代替样品溶液放入锥形瓶中,重复①中实验操作,进行空白实验,消耗Na2S2O3标准溶液的平均体积为1.30mL。
已知:含氯消毒剂中“有效氯”的含量是指与HI作用生成相同量的I2,所需Cl2的质量与指定化合物的质量之比;
 。
。(5)配制氯钠溶液用到的定量玻璃仪器有
(6)若实验步骤②进行空白实验,滴定前,忘记充分反应5min,则样品有效氯含量会
您最近一年使用:0次
名校
解题方法
4 . 二氧化氯 是一种优良的消毒剂,熔点为
是一种优良的消毒剂,熔点为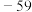 ℃,沸点为11℃,浓度过高时易发生分解,甚至爆炸。
℃,沸点为11℃,浓度过高时易发生分解,甚至爆炸。
Ⅰ.某课外兴趣小组通过氯气与 溶液反应来制取少量
溶液反应来制取少量 ,装置如图所示:
,装置如图所示:_______ 。
(2) 存在时会催化
存在时会催化 的生成,若无乙装置,则丙装置内产生
的生成,若无乙装置,则丙装置内产生 的速率明显加快。乙装置中试剂瓶内的液体是
的速率明显加快。乙装置中试剂瓶内的液体是_______ 。实验过程中常需通入适量的 稀释
稀释 ,其目的是
,其目的是_______ 。
Ⅱ.用下图装置可以测定混合气中 的含量:
的含量: 水溶解后,再加入
水溶解后,再加入 稀硫酸;
稀硫酸;
②在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
③将一定量的混合气体通入锥形瓶中吸收;
④将玻璃液封装置中的水倒入锥形瓶中;
⑤用 硫代硫酸钠标准溶液滴定锥形瓶中的溶液
硫代硫酸钠标准溶液滴定锥形瓶中的溶液 ,指示剂显示终点时共用去
,指示剂显示终点时共用去 硫代硫酸钠溶液。在此过程中:
硫代硫酸钠溶液。在此过程中:
(3)玻璃液封装置的作用是除了使锥形瓶内外压强相等之外,还能_______ 。
(4)滴定至终点的溶液颜色变化是_______ 。
(5)测得混合气中 的质量为
的质量为_______ g。
(6)用 处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是
处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_______ (填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
 是一种优良的消毒剂,熔点为
是一种优良的消毒剂,熔点为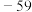 ℃,沸点为11℃,浓度过高时易发生分解,甚至爆炸。
℃,沸点为11℃,浓度过高时易发生分解,甚至爆炸。Ⅰ.某课外兴趣小组通过氯气与
 溶液反应来制取少量
溶液反应来制取少量 ,装置如图所示:
,装置如图所示: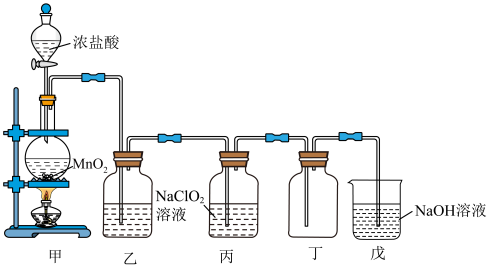
(2)
 存在时会催化
存在时会催化 的生成,若无乙装置,则丙装置内产生
的生成,若无乙装置,则丙装置内产生 的速率明显加快。乙装置中试剂瓶内的液体是
的速率明显加快。乙装置中试剂瓶内的液体是 稀释
稀释 ,其目的是
,其目的是Ⅱ.用下图装置可以测定混合气中
 的含量:
的含量: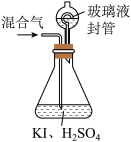
 水溶解后,再加入
水溶解后,再加入 稀硫酸;
稀硫酸;②在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
③将一定量的混合气体通入锥形瓶中吸收;
④将玻璃液封装置中的水倒入锥形瓶中;
⑤用
 硫代硫酸钠标准溶液滴定锥形瓶中的溶液
硫代硫酸钠标准溶液滴定锥形瓶中的溶液 ,指示剂显示终点时共用去
,指示剂显示终点时共用去 硫代硫酸钠溶液。在此过程中:
硫代硫酸钠溶液。在此过程中:(3)玻璃液封装置的作用是除了使锥形瓶内外压强相等之外,还能
(4)滴定至终点的溶液颜色变化是
(5)测得混合气中
 的质量为
的质量为(6)用
 处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是
处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
您最近一年使用:0次
2024-08-31更新
|
340次组卷
|
4卷引用:湖南省长沙市雅礼中学2024-2025学年高三上学期入学考试化学试题
解题方法
5 . 氮、磷是重要的生命元素,广泛存在于蛋白质、骨骼和遗传物质中。回答下列问题:
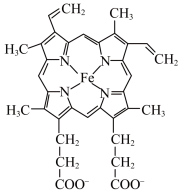
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。_____ (填元素符号);Fe2+的价电子排布式为_____ 。
②含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1mol血红素中通过螯合作用形成_____ mol配位键。
③人体一氧化碳中毒的原理为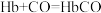 ,
, ,Hb中的Fe2+与CO、卟啉的4个N结合形成八面体较稳定结构。HbCO中Fe2+与CO之间的相互作用为
,Hb中的Fe2+与CO、卟啉的4个N结合形成八面体较稳定结构。HbCO中Fe2+与CO之间的相互作用为_____ (填字母)。
A.氢键 B.配位键 C.范德华力 D.离子键
(2)羟磷灰石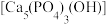 是人体骨骼组织的主要无机组成成分。其熔点为1650℃,OH-可以被F-、Cl-取代,形成氟磷灰石或氯磷灰石。
是人体骨骼组织的主要无机组成成分。其熔点为1650℃,OH-可以被F-、Cl-取代,形成氟磷灰石或氯磷灰石。
①羟磷灰石属于_____ (填晶体类型)晶体。
②氮原子之间可以形成双键,而磷原子之间很难形成双键,原因是_____ 。
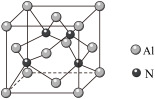
(3)氮化铝熔点高、硬度大,其结构与金刚石类似,AlN晶胞结构如图所示,晶胞中Al和N紧密相连。晶胞中氮原子相连接形成的几何图形为_____ ;设NA为阿伏加德罗常数的值,晶胞参数为apm,该晶胞密度为_____ g·cm3(用含a、NA的式子表示,列出计算式即可)。
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。
②含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1mol血红素中通过螯合作用形成
③人体一氧化碳中毒的原理为
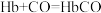 ,
, ,Hb中的Fe2+与CO、卟啉的4个N结合形成八面体较稳定结构。HbCO中Fe2+与CO之间的相互作用为
,Hb中的Fe2+与CO、卟啉的4个N结合形成八面体较稳定结构。HbCO中Fe2+与CO之间的相互作用为A.氢键 B.配位键 C.范德华力 D.离子键
(2)羟磷灰石
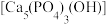 是人体骨骼组织的主要无机组成成分。其熔点为1650℃,OH-可以被F-、Cl-取代,形成氟磷灰石或氯磷灰石。
是人体骨骼组织的主要无机组成成分。其熔点为1650℃,OH-可以被F-、Cl-取代,形成氟磷灰石或氯磷灰石。①羟磷灰石属于
②氮原子之间可以形成双键,而磷原子之间很难形成双键,原因是
(3)氮化铝熔点高、硬度大,其结构与金刚石类似,AlN晶胞结构如图所示,晶胞中Al和N紧密相连。晶胞中氮原子相连接形成的几何图形为
您最近一年使用:0次
解题方法
6 . 利用某废催化剂(含V2O5、TiO2及少量MgO)提取V、TiO2和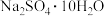 的工艺流程如图所示。
的工艺流程如图所示。
② ,
,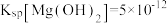 ;
;
③溶液中某离子浓度 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
回答下列问题:
(1)“滤渣a”的成分为Na2TiO3和MgO,酸浸、调pH”生成TiO(OH)2的离子方程式为_____ ;调溶液pH最小值为_____ 。
(2)已知Na2SO4和MgSO4的溶解度曲线如图所示。“滤液b”含有Na2SO4和少量MgSO4,从中获得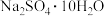 的“系列操作”包含
的“系列操作”包含_____ 、过滤、冷水洗涤、干燥。_____ (假设水溶解溶质后体积不变)。“沉钒”过程中,一般要加入过量铵盐,其原因是_____ 。
(4)常用铝热反应法由V2O5冶炼金属钒,反应的化学方程式为_____ 。
(5)全钒液流电池的工作原理为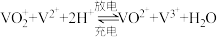 。此电池的两极区被质子交换膜隔开,则负极区溶液中的含钒离子为
。此电池的两极区被质子交换膜隔开,则负极区溶液中的含钒离子为_____ (填“ ”“
”“ ”“
”“ ”“
”“ ”四种微粒中的两种);充电时,阳极区溶液pH
”四种微粒中的两种);充电时,阳极区溶液pH_____ (填“增大”或“减小”)。
 的工艺流程如图所示。
的工艺流程如图所示。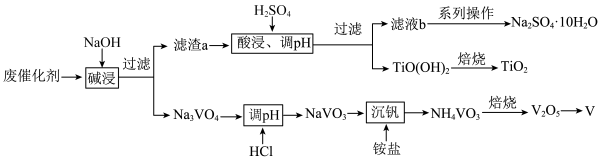
②
 ,
,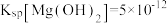 ;
;③溶液中某离子浓度
 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。回答下列问题:
(1)“滤渣a”的成分为Na2TiO3和MgO,酸浸、调pH”生成TiO(OH)2的离子方程式为
(2)已知Na2SO4和MgSO4的溶解度曲线如图所示。“滤液b”含有Na2SO4和少量MgSO4,从中获得
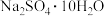 的“系列操作”包含
的“系列操作”包含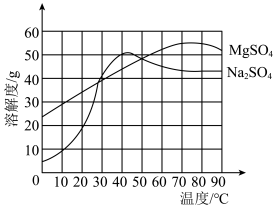
(4)常用铝热反应法由V2O5冶炼金属钒,反应的化学方程式为
(5)全钒液流电池的工作原理为
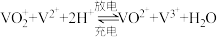 。此电池的两极区被质子交换膜隔开,则负极区溶液中的含钒离子为
。此电池的两极区被质子交换膜隔开,则负极区溶液中的含钒离子为 ”“
”“ ”“
”“ ”“
”“ ”四种微粒中的两种);充电时,阳极区溶液pH
”四种微粒中的两种);充电时,阳极区溶液pH
您最近一年使用:0次
2024高三·全国·专题练习
7 . 党的二十大报告提出推动绿色发展,促进人与自然和谐共生。回答下列问题:
(1)研究脱除烟气中的NO是环境保护、促进社会可持续发展的重要课题。选择性催化还原技术是利用还原剂氨或尿素[CO(NH2)2],把烟气中的NO还原成N2和H2O。相关反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol−1
2NO(g)+O2(g)=2NO2(g )ΔH2=-112.0kJ·mol−1
4CO(NH2)2(s)+6NO2(g)=7N2(g)+4CO(g)+8H2O(g) ΔH3=-2780.0kJ·mol−1
2CO(NH2)2(s)+6NO(g)=5N2(g)+2CO2(g)+4H2O(g) ΔH4
ΔH4=_______ 。
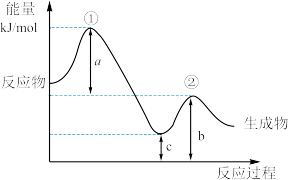
(2)科学家研究了在贵重金属催化剂表面上的气态体系中,一个CO分子还原NO的能量变化与反应历程如图所示。图中第一步逆反应的活化能为_______ kJ·mol-1(用a、b、c的代数式表示)。
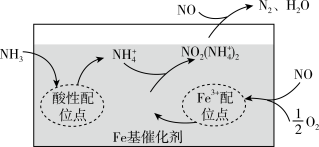
①有氧条件下,在Fe基催化剂表面,NH3还原NO的反应机理如图所示,该过程可描述为_______ 。_____ ;反应过程图中,虚线方框里的过程可描述为_____ 。
(1)研究脱除烟气中的NO是环境保护、促进社会可持续发展的重要课题。选择性催化还原技术是利用还原剂氨或尿素[CO(NH2)2],把烟气中的NO还原成N2和H2O。相关反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol−1
2NO(g)+O2(g)=2NO2(g )ΔH2=-112.0kJ·mol−1
4CO(NH2)2(s)+6NO2(g)=7N2(g)+4CO(g)+8H2O(g) ΔH3=-2780.0kJ·mol−1
2CO(NH2)2(s)+6NO(g)=5N2(g)+2CO2(g)+4H2O(g) ΔH4
ΔH4=
(2)科学家研究了在贵重金属催化剂表面上的气态体系中,一个CO分子还原NO的能量变化与反应历程如图所示。图中第一步逆反应的活化能为
①有氧条件下,在Fe基催化剂表面,NH3还原NO的反应机理如图所示,该过程可描述为

您最近一年使用:0次
2024高三·全国·专题练习
8 . 电催化还原CO2是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
(1)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图-1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。_______ 。
②控制电压为0.8V,电解时转移电子的物质的量为_______ mol。
③科研小组利用13CO2代替原有的CO2进行研究,其目的是_______ 。
(2)一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液呈蓝色。写出Cu2O还原HAuCl4的离子方程式:_______ 。
(3)金属Cu/La复合电极材料电催化还原CO₂制备甲醛和乙醇的可能机理如图-3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图-4所示。_______ ,补充完整虚线框内Y的结构_______ 。
(1)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图-1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
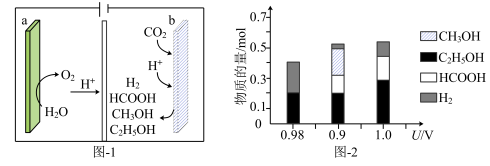
②控制电压为0.8V,电解时转移电子的物质的量为
③科研小组利用13CO2代替原有的CO2进行研究,其目的是
(2)一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液呈蓝色。写出Cu2O还原HAuCl4的离子方程式:
(3)金属Cu/La复合电极材料电催化还原CO₂制备甲醛和乙醇的可能机理如图-3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图-4所示。
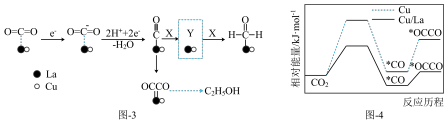
您最近一年使用:0次
2024高三·全国·专题练习
9 . 肼(N2H4)又称联氨,为二元弱碱,在水中的电离与氨类似,广泛用于火箭推进剂、有机合成及电池燃料。回答下列问题:
(1)肼(N2H4)可用做发射卫星的火箭燃料。已知:
①N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=﹣543kJ•mol-1
写出气态肼和NO2生成氮气和水蒸气的热化学方程式_______ 。
(2)联氨(化学式为 ,二元弱碱)是重要的火箭燃料,在水中的电离方程式与氨相似。若N2H4+H+⇌
,二元弱碱)是重要的火箭燃料,在水中的电离方程式与氨相似。若N2H4+H+⇌ 的
的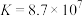 ,
,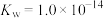 。
。
①联氨第一步电离反应的平衡常数值为_______ 。
②联氨与硫酸形成的正盐的化学式为_______ ,其水溶液中离子浓度的大小关系是_______ 。
(3)肼除了可作火箭的推进剂外,还可用于新型环保电池中,电池工作原理如图所示。_______ 移动(填“电极甲”或“电极乙”)。
②该电池的负极反应式为_______ 。
(1)肼(N2H4)可用做发射卫星的火箭燃料。已知:
①N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=﹣543kJ•mol-1
写出气态肼和NO2生成氮气和水蒸气的热化学方程式
(2)联氨(化学式为
 ,二元弱碱)是重要的火箭燃料,在水中的电离方程式与氨相似。若N2H4+H+⇌
,二元弱碱)是重要的火箭燃料,在水中的电离方程式与氨相似。若N2H4+H+⇌ 的
的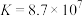 ,
,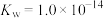 。
。①联氨第一步电离反应的平衡常数值为
②联氨与硫酸形成的正盐的化学式为
(3)肼除了可作火箭的推进剂外,还可用于新型环保电池中,电池工作原理如图所示。
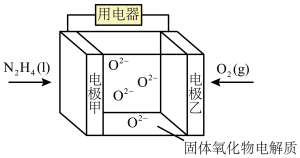
②该电池的负极反应式为
您最近一年使用:0次
24-25高三上·全国·课前预习
解题方法
10 . 臭氧层中O3分解过程如图所示,回答下列问题。________ (填“>”或“<”)0。
(2)催化反应①是________ (填“吸热”或“放热”,下同)反应,催化反应②是________ 反应。
(3)总反应的活化能是________ ,催化反应①的活化能是________ ,催化反应②对应的逆反应的活化能是___________ ,总反应对应的逆反应活化能为_________ 。
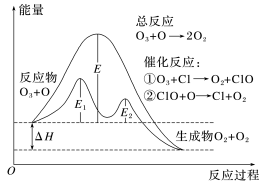
(2)催化反应①是
(3)总反应的活化能是
您最近一年使用:0次



