名校
解题方法
1 . 二氧化氯(ClO2)是一种高效、安全的杀菌消毒剂。一种综合法制备ClO2的工艺流程及ClO2分子的结构(O-Cl-O的键角为117.6°)如图所示。
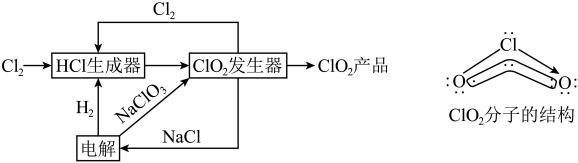
| A.Cl2与ClO2分子中所含化学键类型完全相同 |
B. ClO2分子中含有大π键(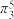 ),Cl原子杂化方式为sp2杂化 ),Cl原子杂化方式为sp2杂化 |
| C.“ClO2发生器”中,NaClO3的还原产物为Cl2 |
| D.“电解”时,阳极与阴极产物的物质的量之比为3:1 |
您最近一年使用:0次
2024-05-11更新
|
269次组卷
|
4卷引用:2024届江西省吉安市第一中学高三下学期三模化学试题
2024届江西省吉安市第一中学高三下学期三模化学试题江西省赣州市2023-2024学年高三下学期5月二模考试化学试题(已下线)湖南师大附中2024届高三下学期第三次模拟考试化学试题(已下线)暑假作业04 突破氧化还原反应及陌生方程式书写综合应用-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)
名校
2 . 下列各图均能表示某种分子的结构,按要求回答下列问题。__________ 模型,其电子式是________________ 。
(2)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为________ ,空间构型为________ 。
(3)写出上述中A、E的分子式和结构简式:A.________ ;________________ ; E.________ ;_________________ ;
(4)B中共平面的原子最多有_______ 个,F中共一条直线的原子最多有_______ 个,
(5)互为同系物的是_______ 。互为同分异构体的是_______ 。(填序号)
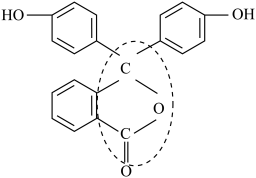
(6)酚酞是常用的酸碱指示剂,其结构简式如图所示:
A.  B.
B.  C.
C.  D.
D.  E.
E.  F.
F. 
(2)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为
(3)写出上述中A、E的分子式和结构简式:A.
(4)B中共平面的原子最多有
(5)互为同系物的是
(6)酚酞是常用的酸碱指示剂,其结构简式如图所示:
| A.烯烃 | B.芳香化合物 | C.醚类物质 | D.酯类物质 |
您最近一年使用:0次
2024-04-20更新
|
475次组卷
|
2卷引用:江西省安福中学2023-2024学年高一下学期第二次月考化学试题
2024·辽宁沈阳·一模
名校
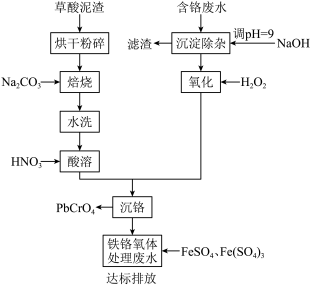
3 . 铬酸铅俗称铬黄,主要用于油漆、油墨、塑料以及橡胶等行业。一种以含铬废水(含Cr3+、Fe3+、Cu2+)和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
回答下列问题
(1)草酸泥渣“粉碎”的目的是___________ ,“焙烧”时加入碳酸钠是为了将硫酸铅转化为PbO,同时放出CO2,该转化过程的化学方程式为___________ 。
(2)滤渣的主要成分为___________ 、___________ 。(填化学式)
(3)“沉淀除杂”所得滤液中含铬化合物主要为___________ 。(填化学式)
(4)“氧化”工序中发生反应的离子方程式为___________ 。
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:___________ 。
(6)处理含 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为___________ mol。

回答下列问题
(1)草酸泥渣“粉碎”的目的是
(2)滤渣的主要成分为
(3)“沉淀除杂”所得滤液中含铬化合物主要为
(4)“氧化”工序中发生反应的离子方程式为
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:
(6)处理含
 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
您最近一年使用:0次
2024-04-13更新
|
359次组卷
|
5卷引用:2024届江西省吉安市第一中学高三下学期一模化学试题
2024届江西省吉安市第一中学高三下学期一模化学试题(已下线)东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题东北三省四市2024届高三教研联合体高考模拟(一)化学试卷东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题专题8 水溶液中的离子反应与平衡-工业流程题解题策略
名校
4 . 用NA代表阿伏加德罗常数的值。下列说法正确的是
| A.25℃,1.01×105Pa时,11.2LO2所含的原子数目为NA |
B.通常条件下,14g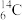 含有质子数为8NA 含有质子数为8NA |
| C.0.5mol/L的FeCl2溶液中,含有Cl-个数为NA |
| D.标准状况下,11.2LNH3中含有氢原子的数目为1.5NA |
您最近一年使用:0次
名校
解题方法
5 . 下列反应的离子方程式书写正确的是
A.碘化亚铁溶液中通入足量的氯气: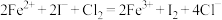 |
B.加碘盐与药物碘化钾片尽量不要同时服用: |
C.向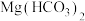 溶液中加入过量的NaOH溶液: 溶液中加入过量的NaOH溶液: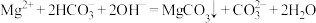 |
D.向 溶液中滴入 溶液中滴入 使 使 反应完全: 反应完全: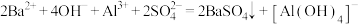 |
您最近一年使用:0次
2024-04-06更新
|
1799次组卷
|
9卷引用:2024届江西省吉安市第一中学高三下学期一模化学试题
2024届江西省吉安市第一中学高三下学期一模化学试题湖南省“一起考”大联考2023-2024学年高三下学期3月模拟考试(模拟一)化学试题江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷 (已下线)题型4 离子反应 氧化还原反应(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)暑假作业03 掌握离子反应、共存、离子方程式的正误判断-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)(已下线)专题08 离子反应-备战2025年高考化学真题题源解密(新高考通用)(已下线)专题3 金属及其化合物-铝及其重要化合物(已下线)专题1 物质及其变化-离子反应、离子方程式湖南省长沙市望城区第六中学2024-2025学年高二上学期开学考试化学试题
名校
解题方法
6 . NA为阿伏加德罗常数的值。下列说法正确的是
A. 和 和 充分反应转移电子数为0.2NA 充分反应转移电子数为0.2NA |
| B.50mL、18.4mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA |
| C.常温下,将2.7g铝片投入足量的浓硝酸中,铝失去的电子数为0.3NA |
D.标准状况下,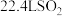 与足量O2的反应,生成的SO3分子数为NA 与足量O2的反应,生成的SO3分子数为NA |
您最近一年使用:0次
2024-04-03更新
|
227次组卷
|
3卷引用:江西省安福中学2023-2024学年高一下学期第一次学科练习化学试题
名校
7 .  是一种半导体材料,一种制备方法是
是一种半导体材料,一种制备方法是 。设
。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 是一种半导体材料,一种制备方法是
是一种半导体材料,一种制备方法是 。设
。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是A.标准状况下,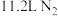 含 含 键数目为 键数目为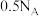 |
B.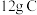 (金刚石)含非极性键数目为 (金刚石)含非极性键数目为 |
C.每生成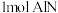 时转移电子数目为 时转移电子数目为 |
D.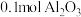 溶于足量盐酸,溶液中含 溶于足量盐酸,溶液中含 数目为 数目为 |
您最近一年使用:0次
2024-04-01更新
|
742次组卷
|
8卷引用:2024届江西省吉安市第一中学高三下学期一模化学试题
2024届江西省吉安市第一中学高三下学期一模化学试题吉林省白山市2023-2024学年高三第二次模拟考试化学试题河南省郑州市宇华实验学校2024届高三下学期第三次模拟考试化学试题甘肃省民乐县第一中学2023-2024学年高三下学期5月第一次模拟考化学试卷安徽省六安第一中学2024届高三下学期质量检测(二 )化学试题(已下线)第01讲 物质的量 气体摩尔体积(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)专题03 化学计量-备战2025年高考化学真题题源解密(新高考通用)(已下线)专题2 化学计量及应用-阿伏伽德罗常数的应用
名校
8 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 、___________ 。
(2) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
(3)已知 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与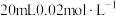 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:___________ 。
(4)过二硫酸钠( )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为___________ 。
(5)雌黄( )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。
① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若 参加反应时,转移
参加反应时,转移 电子,则物质a为
电子,则物质a为___________ 。

(2)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(3)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与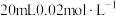 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(4)过二硫酸钠(
 )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(5)雌黄(
 )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。①
 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为②
 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若 参加反应时,转移
参加反应时,转移 电子,则物质a为
电子,则物质a为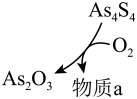
您最近一年使用:0次
2024-03-11更新
|
354次组卷
|
3卷引用:江西省安福中学2023-2024学年高一下学期第一次学科练习化学试题
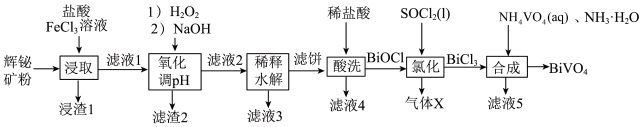
9 . 钒酸铋(BiVO4)是一种亮黄色无机化学品,应用于众多领域。某小组以辉铋矿粉(主要成分是Bi2S3,含少量Bi2O3、Bi、FeS2和SiO2等杂质)为原料制备BiVO4的流程如图所示。
①滤液1中的主要阳离子有Bi3+、Fe2+、Fe3+和H+;
②水解能力:Bi3+<Fe3+;
③常温下,几种离子生成氢氧化物沉淀的pH如表所示。
回答下列问题:
(1)“浸取”时可以适当加热,但温度不宜过高,其原因是_______ ,写出浸取过程生成S渣的主要离子方程式_______ 。
(2)加H2O2氧化的目的是_______ ,调pH的范围是_______ 。
(3)滤液3可以循环用于_______ (填名称)工序。
(4)SOCl2的空间构型是_______ ,气体X是_______ (填写化学式)。
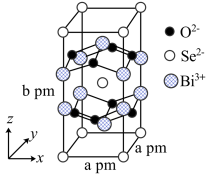
(5)我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为apm、apm、bpm。该晶体的密度为_______ g。cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
①滤液1中的主要阳离子有Bi3+、Fe2+、Fe3+和H+;
②水解能力:Bi3+<Fe3+;
③常温下,几种离子生成氢氧化物沉淀的pH如表所示。
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Bi(OH)3 |
| 开始沉淀的pH | 7.7 | 1.6 | 4.0 |
| 完全沉淀的pH | 9.6 | 3.1 | 5.5 |
(1)“浸取”时可以适当加热,但温度不宜过高,其原因是
(2)加H2O2氧化的目的是
(3)滤液3可以循环用于
(4)SOCl2的空间构型是
(5)我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为apm、apm、bpm。该晶体的密度为
您最近一年使用:0次
2024-03-03更新
|
188次组卷
|
5卷引用:2024届江西省吉安市第一中学高三下学期三模化学试题
10 . 化学知识与科技、生产、生活有密切的关系。下列叙述中错误的是
| A.“天宫二号”空间运行的动力源泉——太阳能电池帆板,其核心材料为晶体硅 |
| B.“天问一号”火星车使用的保温材料——纳米气凝胶,具有丁达尔效应 |
| C.三星堆二号祭祀坑出土商代的铜人铜像填补了我国考古学、青铜文化史上的诸多空白。青铜器的出土表明我国商代已经掌握冶炼铜技术 |
| D.“北斗系统”组网成功,北斗芯片中的半导体材料为二氧化硅 |
您最近一年使用:0次
2024-02-27更新
|
1019次组卷
|
18卷引用:江西省万安中学2022-2023学年高一下学期6月期末考试化学试题
江西省万安中学2022-2023学年高一下学期6月期末考试化学试题四川省绵阳南山中学2021-2022学年高一上学期12月月考化学试题(已下线)5.3 无机非金属材料-2021-2022学年高一化学课后培优练(人教版2019必修第二册)广东省珠海市第二中学2021-2022学年高一下学期期中考试化学试题辽宁省东北师范大学连山实验高中2021-2022学年高一下学期第一次线上考试化学试题宁夏银川市景博中学2021-2022学年高三上学期第二次月考化学试题第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)黑龙江省牡丹江市第三高级中学2022-2023学年高一下学期期中考试化学试题(已下线)第五章 化工生产中的重要非金属元素【单元测试B卷】云南省开远市第一中学校2023-2024学年高一下学期3月月考化学试题内蒙古自治区乌兰浩特第一中学2023-2024学年高一下学期第一次月考化学试题云南省三校联考2023-2024学年高一下学期4月月考化学试题四川省广元市川师大万达中学2023-2024学年高一下学期3月月考化学试题黑龙江省哈尔滨市第六中学校2023-2024学年高一下学期4月测试化学试卷山东省聊城颐中外国语学校2023-2024学年高一下学期第一次质量检测化学试题天津市第一中学2023-2024学年高一下学期5月第五章单元检测(月考)化学试题云南省文山市富宁县第一中学2023-2024学年高一下学期3月月考化学试卷山东省聊城市第二中学2024-2025学年高二上学期开学考试化学试题



