1 . 若NA代表阿伏加德罗常数的值,下列说法正确的是
| A.常温下,18gH2O所含的质子数为18NA |
| B.在标准状况下,5.6LCH4和11.2LCl2在光照下充分反应后的分子数为0.75NA |
| C.1L0.1mol·L-1乙二酸溶液中含H+的数目为0.2NA |
| D.用惰性电极电解饱和食盐水,电子转移的数目为NA时,生成的OH-浓度为1mol·L-1 |
您最近一年使用:0次
2 . 利用压强传感器测定氨气的喷泉实验中的压强变化。下列说法错误的是
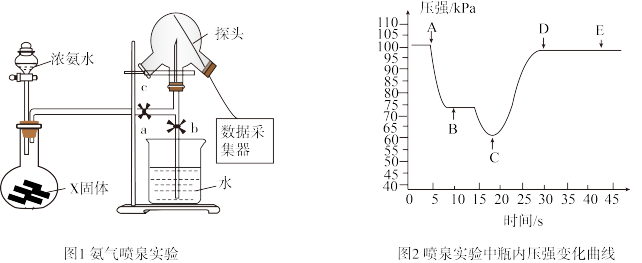

| A.烧瓶中制取氨气时常用的固体为CaO或NaOH |
| B.可用湿润的红色石蕊试纸置于三颈瓶口c处验满 |
| C.关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,挤压胶头滴管,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,A点时喷泉最剧烈 |
D.常温下完成该实验,假设溶液刚好充满烧瓶且混合均匀,则溶液的物质的量浓度大于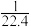 mol/L mol/L |
您最近一年使用:0次
2022-05-16更新
|
318次组卷
|
5卷引用:湖南省株洲市第一中学2021届高三第一次模拟检测化学试题
解题方法
3 . 酒驾检验原理:2K2Cr2O7+3CH3CH2OH+8H2SO4=3CH3COOH+2Cr2(SO4)3+11H2O+2K2SO4。设NA为阿伏加德罗常数的值,下列说法正确的是
| A.lmol[2K2Cr2O7+3CH3CH2OH]完全反应转移电子数为6NA |
B.25℃时,1LpH=1的H2SO4溶液中含SO 数目为0.1NA 数目为0.1NA |
| C.等物质的量的CH3CH2OH和CH3COOH充分反应生成的H2O中含氢键数为2NA |
| D.1molCH3COOH中含sp2—sp3σ键的数目为2NA |
您最近一年使用:0次
4 . 为了探究市售Fe3O4能否与常见的酸(盐酸、稀硫酸)发生反应,实验小组做了以下工作。
Ⅰ.Fe3O4的制备
(1)将可溶性亚铁盐和铁盐按一定配比混合后,加入NaOH溶液,在一定条件下反应可制行Fe3O4,反应的离子方程式为_______ 。
Ⅱ.Fe3O4与酸反应的热力学论证
(2)理论上完全溶解1.16gFe3O4至少需要3 mol/LH2SO4溶液的体积约为_______ mL(保留1位小数)。
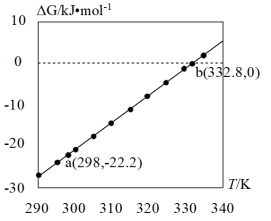
(3)查阅文献:吉布斯自由能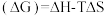 ,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是
,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是_______ 。
Ⅲ.Fe3O4与酸反应的实验研究
用10 mL3 mol/LH2SO4溶液浸泡1.0 g Fe3O4粉末,5分钟后各取2 mL澄清浸泡液,按编号i进行实验。(所用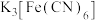 、KSCN溶液均为0.1 mol/L,Fe2+遇
、KSCN溶液均为0.1 mol/L,Fe2+遇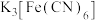 溶液生成蓝色沉淀。)
溶液生成蓝色沉淀。)
(4)实验ⅱ的作用是_______ 。
(5)实验ⅰ中滴加K3[Fe(CN)6]溶液无蓝色沉淀生成,其可能原因是Fe2+的浓度太小,为了验证这一推断,可改进的方法是_______ 。
(6)实验ⅲ:用10 mL6 mol/L盐酸代替H2SO4浸泡样品后,重复实验ⅰ,发现试管①有蓝色沉淀,试管②溶液显红色,说明Cl-有利于Fe3O4与H+反应,为了验证这一推测,可在用H2SO4溶液浸泡时加入_______ ,然后重复实验i。
(7)实验ⅳ:用20 mL6 mol/L盐酸浸泡1.0 g天然磁铁矿粉末,20 min后浸泡液几乎无色,重复实验i,发现试管①、②均无明显现象,与实验iii现象不同的可能原因是_______ 。
Ⅰ.Fe3O4的制备
(1)将可溶性亚铁盐和铁盐按一定配比混合后,加入NaOH溶液,在一定条件下反应可制行Fe3O4,反应的离子方程式为
Ⅱ.Fe3O4与酸反应的热力学论证
(2)理论上完全溶解1.16gFe3O4至少需要3 mol/LH2SO4溶液的体积约为
(3)查阅文献:吉布斯自由能
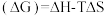 ,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是
,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是
Ⅲ.Fe3O4与酸反应的实验研究
用10 mL3 mol/LH2SO4溶液浸泡1.0 g Fe3O4粉末,5分钟后各取2 mL澄清浸泡液,按编号i进行实验。(所用
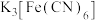 、KSCN溶液均为0.1 mol/L,Fe2+遇
、KSCN溶液均为0.1 mol/L,Fe2+遇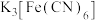 溶液生成蓝色沉淀。)
溶液生成蓝色沉淀。)| 编号 | i | ii |
| 实验操作 | 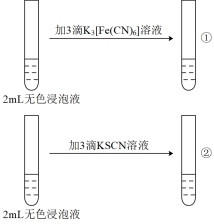 | 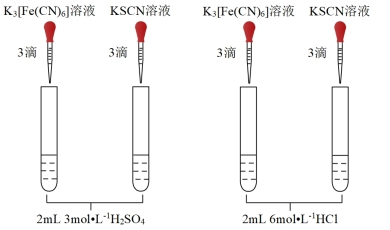 |
| 现象 | ①无蓝色沉淀 ②溶液显红色 | 均无明显现象 |
(5)实验ⅰ中滴加K3[Fe(CN)6]溶液无蓝色沉淀生成,其可能原因是Fe2+的浓度太小,为了验证这一推断,可改进的方法是
(6)实验ⅲ:用10 mL6 mol/L盐酸代替H2SO4浸泡样品后,重复实验ⅰ,发现试管①有蓝色沉淀,试管②溶液显红色,说明Cl-有利于Fe3O4与H+反应,为了验证这一推测,可在用H2SO4溶液浸泡时加入
(7)实验ⅳ:用20 mL6 mol/L盐酸浸泡1.0 g天然磁铁矿粉末,20 min后浸泡液几乎无色,重复实验i,发现试管①、②均无明显现象,与实验iii现象不同的可能原因是
您最近一年使用:0次
2022-05-05更新
|
540次组卷
|
3卷引用:福建省三明市2022届普通高中毕业班下学期5月质量测试化学试题
福建省三明市2022届普通高中毕业班下学期5月质量测试化学试题(已下线)专题17 化学实验综合题-三年(2020-2022)高考真题分项汇编福建省泉州第一中学2023-2024学年高三上学期12月月考化学试题
名校
5 . NA为阿伏加德罗常数的值。下列叙述正确的是
| A.1molOH-中含有9NA个电子 |
| B.1molCl2与NaOH完全反应,转移2NA个电子 |
| C.14gC2H4与C3H6混合物中含有2NA个氢原子 |
| D.10mL0.1mol·L-1NaAlO2溶液中含有2×10-3NA个氧原子 |
您最近一年使用:0次
2022-05-03更新
|
478次组卷
|
3卷引用:河南省许昌济源平顶山2022届高三下学期第三次质量检测理科综合化学试题
河南省许昌济源平顶山2022届高三下学期第三次质量检测理科综合化学试题(已下线)第06练 物质的量-2023年高考化学一轮复习小题多维练(全国通用)湖南省株洲市攸攸县第二中学2022-2023学年高三上学期第五次月考化学试题
名校
6 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.标准状况下, 分子数为 分子数为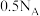 |
B. 白磷分子中共价键数目为 白磷分子中共价键数目为 |
C. 的盐酸中, 的盐酸中, 数目为 数目为 |
D.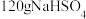 晶体中 晶体中 的数目为 的数目为 |
您最近一年使用:0次
2022-04-30更新
|
262次组卷
|
2卷引用:河北省唐山市2022届高三普通高中学业水平选择性考试第二次模拟演练化学试题
7 . 硫酸肼(N2H4·H2SO4)又名硫酸联氨,在医药、染料、农业上用途广泛。
已知:①Cl2与NaOH溶液的反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3
②利用尿素法生产水合肼的原理:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl
③硫酸肼的制备原理:N2H4·H2O+H2SO4=N2H4·H2SO4+H2O
回答下列问题:
Ⅰ.制备NaClO溶液
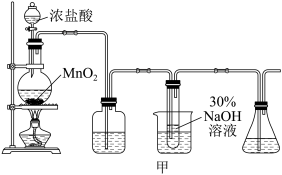
实验制备装置如图甲所示:
(1)欲配制220mL6mol/L的盐酸,则需要密度为1.2g/mL,质量分数为36.5%的浓盐酸体积为____ mL,此过程所需玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管和____ 。
(2)甲图装置C试管内发生主要化学反应的离子方程式为____ 。
Ⅱ.乙图是尿素法生产水合肼的装置
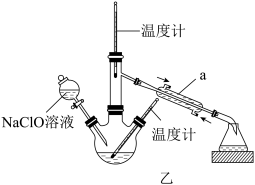
(3)把Ⅰ制得的NaClO溶液注入到图乙装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液,应采用____ 的方式降温,并控制低温(低于20℃)进行反应。温度高时水合肼会被氧化成无色无味的气体,该气体在标准状况下的密度为1.25g·L-1,其反应的化学方程式为_____ 。反应结束后,收集108~1149℃馏分。
(4)测定馏分中水合肼的含量。称取馏分5.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。实验测得消耗I2溶液体积的平均值为20.00mL,则馏分中水合肼(N2H4H2O)的质量分数为____ 。(保留两位有效数字)
Ⅲ.硫酸肼的性质、制备
已知:硫酸肼(又可以表示为:N2H6SO4)是一种重要的化工原料,硫酸肼属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似。
(5)将水合肼转移到烧杯中,滴加一定量浓硫酸,控制温度,得硫酸肼沉淀。洗涤硫酸肼时用无水乙醇而不用水洗涤的原因是____ 。
(6)①写出硫酸肼第二步水解反应的离子方程式:____ 。
②硫酸肼水溶液中离子浓度关系表达正确的是____ (填英文字母)。
A.c(SO )=c(N2H
)=c(N2H )+c(N2H
)+c(N2H )+c(N2H4·H2O)
)+c(N2H4·H2O)
B.c(SO )>c([N2H5·H2O]+)>c(H+)>c(OH-)
)>c([N2H5·H2O]+)>c(H+)>c(OH-)
C.2c(N2H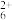 )+c([N2H5·H2O]+)=c(H+)+c(OH-)
)+c([N2H5·H2O]+)=c(H+)+c(OH-)
D.c(SO )>c(N2H
)>c(N2H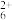 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
已知:①Cl2与NaOH溶液的反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3
②利用尿素法生产水合肼的原理:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl
③硫酸肼的制备原理:N2H4·H2O+H2SO4=N2H4·H2SO4+H2O
回答下列问题:
Ⅰ.制备NaClO溶液
实验制备装置如图甲所示:
(1)欲配制220mL6mol/L的盐酸,则需要密度为1.2g/mL,质量分数为36.5%的浓盐酸体积为
(2)甲图装置C试管内发生主要化学反应的离子方程式为

Ⅱ.乙图是尿素法生产水合肼的装置

(3)把Ⅰ制得的NaClO溶液注入到图乙装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液,应采用
(4)测定馏分中水合肼的含量。称取馏分5.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。实验测得消耗I2溶液体积的平均值为20.00mL,则馏分中水合肼(N2H4H2O)的质量分数为
Ⅲ.硫酸肼的性质、制备
已知:硫酸肼(又可以表示为:N2H6SO4)是一种重要的化工原料,硫酸肼属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似。
(5)将水合肼转移到烧杯中,滴加一定量浓硫酸,控制温度,得硫酸肼沉淀。洗涤硫酸肼时用无水乙醇而不用水洗涤的原因是
(6)①写出硫酸肼第二步水解反应的离子方程式:
②硫酸肼水溶液中离子浓度关系表达正确的是
A.c(SO
 )=c(N2H
)=c(N2H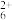 )+c(N2H
)+c(N2H )+c(N2H4·H2O)
)+c(N2H4·H2O)B.c(SO
 )>c([N2H5·H2O]+)>c(H+)>c(OH-)
)>c([N2H5·H2O]+)>c(H+)>c(OH-)C.2c(N2H
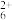 )+c([N2H5·H2O]+)=c(H+)+c(OH-)
)+c([N2H5·H2O]+)=c(H+)+c(OH-)D.c(SO
 )>c(N2H
)>c(N2H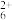 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
您最近一年使用:0次
解题方法
8 . 单质硫在热的NaOH溶液中发生如下反应:3S+6NaOH 2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S
2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S Na2Sx,S+Na2SO3
Na2Sx,S+Na2SO3 Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO
Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO 。
。
请计算:
(1)a mol Na2Sx和b mol Na2S2O3中a∶b=____ 。
(2)NaClO溶液的物质的量浓度为____ mol·L-1 (写出计算过程)。
 2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S
2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S Na2Sx,S+Na2SO3
Na2Sx,S+Na2SO3 Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO
Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO 。
。请计算:
(1)a mol Na2Sx和b mol Na2S2O3中a∶b=
(2)NaClO溶液的物质的量浓度为
您最近一年使用:0次
2022-04-16更新
|
407次组卷
|
2卷引用:浙江省宁波市2022届高三下学期高考模拟考试(二模)化学试题
2022·安徽宣城·二模
9 . 氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。工业上用钛铁矿(主要成分FeTiO3,钛酸亚铁,含有少量SiO2,MgO等杂质)制备氮化钛的工艺流程如下:
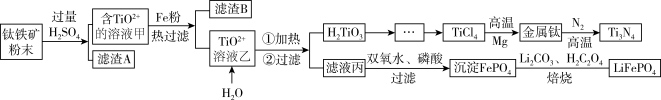
已知:钛铁矿与硫酸发生非氧化还原反应,TiOSO4遇水会水解。H2TiO3灼烧制得TiO2,TiO2与焦炭、氯气在高温下生成TiCl4。
请回答下列问题:
(1)钛铁矿加入过量硫酸后滤渣A是_______ (化学式)。
(2)钛铁矿与硫酸发生反应的化学方程式_______ 。
(3)请用化学用语解释溶液乙TiO2+转化为H2TiO3的原理_______ 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是_______ 。
(5)TiO2制取单质Ti涉及到的步骤如下:由TiCl4→Ti需发在Ar气中进行的理由_______ 。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到,依据表中的信息,需要加热的温度略高于 _______ 即可。
(6)用氧化还原滴定法测定TiOSO4的含量。先取待测钛液10.00 mL用水释至100 mL,加过量铝粉,充分振荡,使TiO2+还原为Ti3+,过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液,用0.1000 mol/L NH4Fe(SO4)2的标准液滴定。Ti3++Fe3+═Ti4++Fe2+,滴定终点时现象_______ ,若用去了30.00 mL NH4Fe(SO4)2溶液,待测钛液中TiOSO4的物质的量浓度是 _______ mol/L。

已知:钛铁矿与硫酸发生非氧化还原反应,TiOSO4遇水会水解。H2TiO3灼烧制得TiO2,TiO2与焦炭、氯气在高温下生成TiCl4。
请回答下列问题:
(1)钛铁矿加入过量硫酸后滤渣A是
(2)钛铁矿与硫酸发生反应的化学方程式
(3)请用化学用语解释溶液乙TiO2+转化为H2TiO3的原理
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是
(5)TiO2制取单质Ti涉及到的步骤如下:由TiCl4→Ti需发在Ar气中进行的理由
(6)用氧化还原滴定法测定TiOSO4的含量。先取待测钛液10.00 mL用水释至100 mL,加过量铝粉,充分振荡,使TiO2+还原为Ti3+,过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液,用0.1000 mol/L NH4Fe(SO4)2的标准液滴定。Ti3++Fe3+═Ti4++Fe2+,滴定终点时现象
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | ﹣25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
您最近一年使用:0次
10 . 以下方法常用于对废水中的苯酚进行定量测定:取 含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量
含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量 溶液生成三溴苯酚,再用
溶液生成三溴苯酚,再用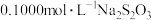 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 .已知
.已知 (三溴苯酚)
(三溴苯酚) .
. 和
和 溶液颜色均为无色.
溶液颜色均为无色.
(1)消耗 的物质的量为
的物质的量为________ .
(2)废水中苯酚的物质的量浓度为_______ (写出简要计算过程).
 含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量
含苯酚废水,加过量溴水使苯酚完全反应,煮沸,再加入过量 溶液生成三溴苯酚,再用
溶液生成三溴苯酚,再用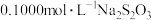 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 .已知
.已知 (三溴苯酚)
(三溴苯酚) .
. 和
和 溶液颜色均为无色.
溶液颜色均为无色.(1)消耗
 的物质的量为
的物质的量为(2)废水中苯酚的物质的量浓度为
您最近一年使用:0次



