名校
1 . 绿矾(FeSO4⋅7H2O))是一种重要的药物,也是一种工业原料。一种以黄铜矿(主要成分是CuFeS2,含SiO2、Al2O3等杂质)为原料制备绿矾的流程如图:

回答下列问题:
(1)“焙烧”时,需将黄铜矿粉碎,其目的是______ ;高温“焙烧”过程中生成了三种氧化物,其化学方程式是______ 。
(2)滤渣1的主要成分为_______ (填化学式,下同);滤渣2的主要成分为_______ 。
(3)“一系列操作”为:______ 、_______ 、过滤、洗涤、干燥。
(4)硫代硫酸钠(Na2S2O3)俗称“海波”或“大苏打”,也是一种重要的含硫盐。在酸性条件下不稳定,易生成一种固体和一种气体,其离子方程式为_______ 。
(5)绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测所取晶体中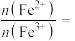
______ 。

回答下列问题:
(1)“焙烧”时,需将黄铜矿粉碎,其目的是
(2)滤渣1的主要成分为
(3)“一系列操作”为:
(4)硫代硫酸钠(Na2S2O3)俗称“海波”或“大苏打”,也是一种重要的含硫盐。在酸性条件下不稳定,易生成一种固体和一种气体,其离子方程式为
(5)绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测所取晶体中
您最近一年使用:0次
名校
2 . 某小组同学探究SO2与新制Cu(OH)2悬浊液反应的实验装置图如下所示:

已知Cu2O在水溶液中为砖红色沉淀,则下列说法错误的是

已知Cu2O在水溶液中为砖红色沉淀,则下列说法错误的是
| A.装置A中恒压滴液漏斗的主要作用是平衡气压,使硫酸能够顺利滴下 |
| B.装置B的作用是监控SO2流速,其中试剂可以用饱和NaHSO3溶液 |
| C.反应开始时C中出现砖红色沉淀,氧化剂和还原剂的物质的量之比为1:2 |
| D.装置D的作用是尾气处理,防止多余的SO2污染环境,但存在不足 |
您最近一年使用:0次
解题方法
3 . 丙烷催化氧化是制备丙烯的常见方法,如图为采用羰基催化剂催化氧化丙烷的机理,下列说法正确的是

| A.该机理中,有非极性键的断裂.无非极性键的形成 |
| B.羰基催化剂的活性温度高 |
C.若 参与反应,最终催化剂中含有 参与反应,最终催化剂中含有 |
D.理论上消耗1mol 可制得2mol 可制得2mol |
您最近一年使用:0次
解题方法
4 . 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
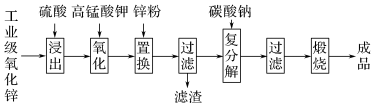
已知Ksp[Fe(OH)3]=8.0×10-38,回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写一种既可)
(2)浸出步骤中发生主要反应的离子方程式为
(3)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:
□ +□Fe2++□___________=□MnO2↓+□Fe(OH)3↓+□H+
+□Fe2++□___________=□MnO2↓+□Fe(OH)3↓+□H+
(4)加入锌粉的目的是调节溶液pH除去Fe3+,和还原除去溶液中的
(5)已知H2SO4浸出液中,c(Fe2+)=50.4mg·L-1、c(Mn2+)=16.5mg·L-1,若要除尽1m3上述浸出液中的Fe2+和Mn2+,需加入
(6)若用酸性KMnO4标准溶液测定未知溶液中所含Fe2+的物质的量浓度(不含其他还原性粒子,MnO
 转化为Mn2+),不需要选取其他的指示剂,则滴定终点判断依据是
转化为Mn2+),不需要选取其他的指示剂,则滴定终点判断依据是
您最近一年使用:0次
名校
解题方法
5 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。
Ⅰ.某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约为10%,其余为空气),实验装置如图所示:
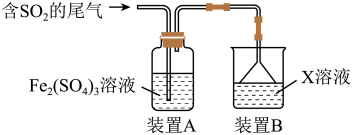
(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的化学方程式:___________ 。
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为___________ ;若要检验SO2是否过量,可用试剂为___________ 。
(3)装置B中所用X溶液常为碱溶液,其作用是___________ 。
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00 mL装置A中溶液,向其中逐滴加入0.100 0 mol/L Ce(SO4)2溶液,发生反应Fe2++Ce4+= Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00 mL。则FeSO4的物质的量浓度为___________ 。
Ⅱ.工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
(5)水吸收法。结合化学方程式说明用水吸收NO2的缺陷___________ 。
(6)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:___________ 。
Ⅰ.某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约为10%,其余为空气),实验装置如图所示:

(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的化学方程式:
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为
(3)装置B中所用X溶液常为碱溶液,其作用是
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00 mL装置A中溶液,向其中逐滴加入0.100 0 mol/L Ce(SO4)2溶液,发生反应Fe2++Ce4+= Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00 mL。则FeSO4的物质的量浓度为
Ⅱ.工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
(5)水吸收法。结合化学方程式说明用水吸收NO2的缺陷
(6)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
您最近一年使用:0次
名校
6 . 铜和硝酸的反应实验是体现硝酸重要性质的实验,某教师设计了如图装置进行铜和稀硝酸的反应实验,步骤如下:
步骤ⅰ.将弹簧状细铜丝放入注射器 底部并固定,注射器
底部并固定,注射器 吸入少量蒸馏水后将活塞推至最低处;注射器
吸入少量蒸馏水后将活塞推至最低处;注射器 吸取
吸取 溶液(过量),注射器
溶液(过量),注射器 于烧杯中吸取
于烧杯中吸取 稀硝酸,注射器
稀硝酸,注射器 吸取
吸取 (过量)。
(过量)。
步骤ⅱ.按图连接好装置,打开止水夹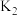 、
、 ,关闭
,关闭 、
、 ,将注射器
,将注射器 中的稀硝酸注入
中的稀硝酸注入 中。
中。
步骤ⅲ.关闭止水夹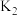 ,打开止水夹
,打开止水夹 ,抽动注射器
,抽动注射器 的活塞,将注射器
的活塞,将注射器 中生成的
中生成的 气体全部抽入
气体全部抽入 中。
中。
步骤ⅳ.关闭止水夹 ,打开止水夹
,打开止水夹 ,将注射器
,将注射器 中气体全部抽入
中气体全部抽入 中。
中。 、
、 的容积为
的容积为 ,注射器
,注射器 、
、 的容积为
的容积为 ;②止水夹
;②止水夹 、
、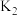 、
、 、
、 连在四通管上;③该实验中,铜与稀硝酸反应生成的气体只有
连在四通管上;③该实验中,铜与稀硝酸反应生成的气体只有 。
。
请回答下列问题:
(1)步骤ⅰ中注射器 吸入少量蒸馏水后将活塞推至最低处的目的是
吸入少量蒸馏水后将活塞推至最低处的目的是______ ;步骤ⅱ注射器 中的稀硝酸注入
中的稀硝酸注入 中时发生反应的化学方程式为
中时发生反应的化学方程式为______ ,观察到的现象为______ ,该反应中稀硝酸体现了______ (填化学性质)。
(2)步骤ⅲ将注射器 中生成的气体全部抽入
中生成的气体全部抽入 中,注射器
中,注射器 中能观察到的现象为
中能观察到的现象为______ ;该过程中, 发生了
发生了______ (填“氧化”或“还原”)反应。
(3)步骤ⅳ将注射器 中气体全部抽入
中气体全部抽入 中,
中, 和
和 的混合气体与
的混合气体与 溶液反应生成的盐只有
溶液反应生成的盐只有 ,该反应的离子方程式为
,该反应的离子方程式为______ ,该反应中氧化剂和氧化产物的物质的量之比为______ 。
(4)若反应过程中有 铜丝参与反应,要使注射器
铜丝参与反应,要使注射器 中产生的
中产生的 最终在注射器
最终在注射器 中全部转化为
中全部转化为 ,需要消耗
,需要消耗______ 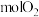 。
。
步骤ⅰ.将弹簧状细铜丝放入注射器
 底部并固定,注射器
底部并固定,注射器 吸入少量蒸馏水后将活塞推至最低处;注射器
吸入少量蒸馏水后将活塞推至最低处;注射器 吸取
吸取 溶液(过量),注射器
溶液(过量),注射器 于烧杯中吸取
于烧杯中吸取 稀硝酸,注射器
稀硝酸,注射器 吸取
吸取 (过量)。
(过量)。步骤ⅱ.按图连接好装置,打开止水夹
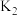 、
、 ,关闭
,关闭 、
、 ,将注射器
,将注射器 中的稀硝酸注入
中的稀硝酸注入 中。
中。步骤ⅲ.关闭止水夹
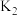 ,打开止水夹
,打开止水夹 ,抽动注射器
,抽动注射器 的活塞,将注射器
的活塞,将注射器 中生成的
中生成的 气体全部抽入
气体全部抽入 中。
中。步骤ⅳ.关闭止水夹
 ,打开止水夹
,打开止水夹 ,将注射器
,将注射器 中气体全部抽入
中气体全部抽入 中。
中。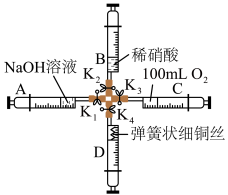
 、
、 的容积为
的容积为 ,注射器
,注射器 、
、 的容积为
的容积为 ;②止水夹
;②止水夹 、
、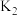 、
、 、
、 连在四通管上;③该实验中,铜与稀硝酸反应生成的气体只有
连在四通管上;③该实验中,铜与稀硝酸反应生成的气体只有 。
。请回答下列问题:
(1)步骤ⅰ中注射器
 吸入少量蒸馏水后将活塞推至最低处的目的是
吸入少量蒸馏水后将活塞推至最低处的目的是 中的稀硝酸注入
中的稀硝酸注入 中时发生反应的化学方程式为
中时发生反应的化学方程式为(2)步骤ⅲ将注射器
 中生成的气体全部抽入
中生成的气体全部抽入 中,注射器
中,注射器 中能观察到的现象为
中能观察到的现象为 发生了
发生了(3)步骤ⅳ将注射器
 中气体全部抽入
中气体全部抽入 中,
中, 和
和 的混合气体与
的混合气体与 溶液反应生成的盐只有
溶液反应生成的盐只有 ,该反应的离子方程式为
,该反应的离子方程式为(4)若反应过程中有
 铜丝参与反应,要使注射器
铜丝参与反应,要使注射器 中产生的
中产生的 最终在注射器
最终在注射器 中全部转化为
中全部转化为 ,需要消耗
,需要消耗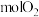 。
。
您最近一年使用:0次
2024-03-27更新
|
64次组卷
|
4卷引用:湖南省衡阳市衡阳县三校2023-2024学年高一下学期三月联考化学试题
名校
解题方法
7 . 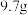 只含有
只含有 和
和 的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有
的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有 、
、 的混合气体甲
的混合气体甲 (常温常压下,
(常温常压下,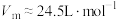 )。将生成的
)。将生成的 、
、 与
与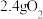 同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为
同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为 ,得到溶液乙。下列说法正确的是
,得到溶液乙。下列说法正确的是
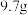 只含有
只含有 和
和 的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有
的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有 、
、 的混合气体甲
的混合气体甲 (常温常压下,
(常温常压下,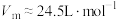 )。将生成的
)。将生成的 、
、 与
与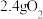 同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为
同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为 ,得到溶液乙。下列说法正确的是
,得到溶液乙。下列说法正确的是A.原合金中, 和 和 的物质的量之比为 的物质的量之比为 |
B.生成的混合气体甲的总质量为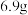 |
C.溶液乙中,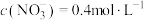 |
D.原硝酸溶液中含有 的物质的量为 的物质的量为 |
您最近一年使用:0次
2024-03-27更新
|
157次组卷
|
6卷引用:湖南省衡阳市衡阳县三校2023-2024学年高一下学期三月联考化学试题
名校
解题方法
8 . 中国科学院理化所发现利用Pd-CdS可使PLA(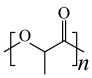 )转化为丙酮酸(
)转化为丙酮酸(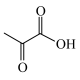 )的速率显著提高,并且优异的稳定性确保了Pd—CdS可以维持100h的反应性能,其反应机理如图所示,Pd-CdS在光照条件下产生带正电空穴(用h+表示,可捕获电子)和电子。下列说法错误的是
)的速率显著提高,并且优异的稳定性确保了Pd—CdS可以维持100h的反应性能,其反应机理如图所示,Pd-CdS在光照条件下产生带正电空穴(用h+表示,可捕获电子)和电子。下列说法错误的是
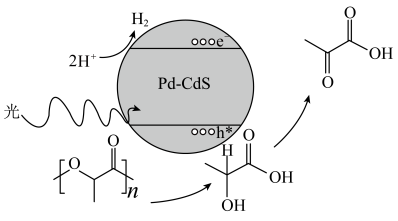
| A.Pd-CdS可作乳酸制备丙酮酸的催化剂 |
| B.在相同条件下,适当增加光的强度有利于加快反应速率 |
| C.整个过程中,氧化产物与还原产物的物质的量之比为1:1 |
| D.当180gPLA完全转化成丙酮酸时,理论上Pd-CdS中至少产生4molh+ |
您最近一年使用:0次
2024-03-27更新
|
592次组卷
|
2卷引用:2024届湖南省益阳市安化县第二中学高三下学期三模化学试题
名校
9 . 1986年,化学家用化学法制氟,其原理如下:
① (未配平);
(未配平);
② ;
;
③ 。
。
下列说法正确的是
①
 (未配平);
(未配平);②
 ;
;③
 。
。下列说法正确的是
| A.①中氧化产物和还原产物的物质的量之比为2∶3 |
B. 能与 能与 溶液发生反应 溶液发生反应 |
C. 因为其具有强酸性而被用于刻蚀玻璃 因为其具有强酸性而被用于刻蚀玻璃 |
D.用上述方法制备1  ,理论上需要消耗30 ,理论上需要消耗30  |
您最近一年使用:0次
2024-03-27更新
|
168次组卷
|
5卷引用:湖南省衡阳市衡阳县三校2023-2024学年高一下学期三月联考化学试题
10 . A、储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质—碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、 、
、 、
、 、
、 、
、 和
和 七种。
七种。
(1)请用上述物质填空(不用配平):_____
 。
。
(2)上述反应中氧化剂是(填化学式)______ ,被氧化的元素是(填元素符号)______ 。
(3) 在上述反应中表现出来的性质是(填选项序号)______。
在上述反应中表现出来的性质是(填选项序号)______。
B、 与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为:
与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为: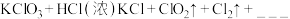
(4)请完成该化学方程式__________________
(5)浓盐酸在反应中显示出来的性质是______ (填写编号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(6)若产生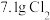 ,则生成
,则生成 的质量为
的质量为_____  。
。
(7) 具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(用单位质量得到的电子数表示)是
具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(用单位质量得到的电子数表示)是 的
的_____ 倍(小数点后保留两位数字)。
 、
、 、
、 、
、 、
、 和
和 七种。
七种。(1)请用上述物质填空(不用配平):
 。
。(2)上述反应中氧化剂是(填化学式)
(3)
 在上述反应中表现出来的性质是(填选项序号)______。
在上述反应中表现出来的性质是(填选项序号)______。| A.氧化性 | B.氧化性和酸性 | C.酸性 | D.还原性和酸性 |
B、
 与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为:
与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为: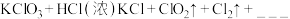
(4)请完成该化学方程式
(5)浓盐酸在反应中显示出来的性质是
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(6)若产生
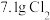 ,则生成
,则生成 的质量为
的质量为 。
。(7)
 具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(用单位质量得到的电子数表示)是
具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(用单位质量得到的电子数表示)是 的
的
您最近一年使用:0次



