1 . 一种由湿法炼铜的低铜萃取余液(含Co2+、Cu2+、Fe2+、Fe3+、Mn2+、H+、 )回收金属的工艺流程如下:
)回收金属的工艺流程如下:
下列说法正确的是
 )回收金属的工艺流程如下:
)回收金属的工艺流程如下: 
| 金属离子 |  |  |  |  |  |
| 开始沉淀时的pH | 7.8 | 5.5 | 5.8 | 1.8 | 8.3 |
| 完全沉淀时的pH | 9.4 | 6.7 | 8.8 | 2.9 | 10.9 |
A.“滤渣I”为 |
| B.“调pH”时,选用CaO浆液代替CaO固体可加快反应速率 |
C.生成 的离子方程式为 的离子方程式为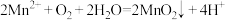 |
D.“沉钴”时,用 代替 代替 可以提高 可以提高 的纯度 的纯度 |
您最近一年使用:0次
2023-02-26更新
|
758次组卷
|
7卷引用:山东省青岛市第二中学2022-2023学年高二5月月考化学试题
山东省青岛市第二中学2022-2023学年高二5月月考化学试题山东省淄博实验中学2022-2023学年高二下学期3月月考化学试题山东省日照市2023届高三一模考试化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(不定项选择题)(已下线)专题11 物质的反应及转化 山东省泰安肥城市2023-2024学年高三9月阶段测试化学试题山东省烟台第一中学2023-2024学年高三上学期12月月考化学试题
2 . 以菱锌矿(主要含有 ,另含有少量
,另含有少量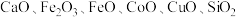 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有_______ (写出一种即可)。
(2)“调 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择_______ (填标号)。
A. B.
B. C.
C.
(3)“氧化过滤”中, 转化为
转化为 的离子方程式为
的离子方程式为_______ 。若反应结束时,溶液 为5,则残留的
为5,则残留的
_______  。
。
(4)“转化过滤”中,除去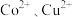 速率先慢后快的原因是
速率先慢后快的原因是_______ 。
(5)“脱钙镁过滤”后,溶液中
_______ 。
(6)“电解”装置示意如图。 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为_______ 。
②电解过程中,电解液中 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是_______ 。
 ,另含有少量
,另含有少量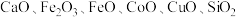 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图: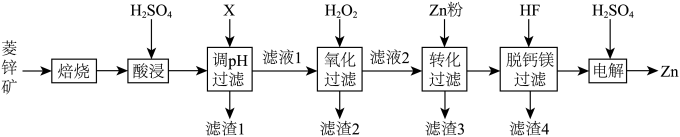
| 物质 |  |  |  |  |
 | 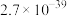 | 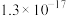 |  |  |
(2)“调
 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择A.
 B.
B. C.
C.
(3)“氧化过滤”中,
 转化为
转化为 的离子方程式为
的离子方程式为 为5,则残留的
为5,则残留的
 。
。(4)“转化过滤”中,除去
 速率先慢后快的原因是
速率先慢后快的原因是(5)“脱钙镁过滤”后,溶液中

(6)“电解”装置示意如图。
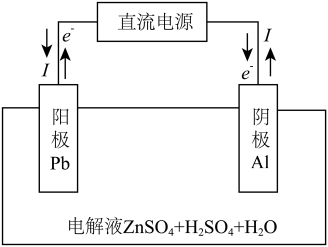
 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为②电解过程中,电解液中
 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是
您最近一年使用:0次
3 . 菱锰矿主要成分为 、
、 、
、 和少量
和少量 ,一种利用该矿石制取高纯二氧化锰的工艺流程如图所示:
,一种利用该矿石制取高纯二氧化锰的工艺流程如图所示:

已知:常温下, 的
的 ,
, ;
; 。回答下列问题:
。回答下列问题:
(1)“研磨”的目的是_______ 。
(2)“浸出”后浸渣的主要成分有 、
、 、
、_______ (填化学式,下同)。将“氯化焙烧”得到的气体A通入水中,再通入气体B,可制得“沉锰”时需要的试剂 ,则气体A、B分别为
,则气体A、B分别为_______ 、 。
。
(3)已知“沉锰”时有CO2生成,写出“沉锰”时反应的离子反应方程式:_______ 。
(4)若“沉锰”后所得滤液中 、
、 ,此时溶液中
,此时溶液中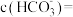
_______  (保留2位有效数字);“沉锰”后通过过滤、洗涤、干燥得到
(保留2位有效数字);“沉锰”后通过过滤、洗涤、干燥得到 ,检验沉淀洗涤干净的方法是
,检验沉淀洗涤干净的方法是_______ 。
(5)写出空气中进行“氧化焙烧”反应的化学方程式:_______ 。
 、
、 、
、 和少量
和少量 ,一种利用该矿石制取高纯二氧化锰的工艺流程如图所示:
,一种利用该矿石制取高纯二氧化锰的工艺流程如图所示:
已知:常温下,
 的
的 ,
, ;
; 。回答下列问题:
。回答下列问题:(1)“研磨”的目的是
(2)“浸出”后浸渣的主要成分有
 、
、 、
、 ,则气体A、B分别为
,则气体A、B分别为 。
。(3)已知“沉锰”时有CO2生成,写出“沉锰”时反应的离子反应方程式:
(4)若“沉锰”后所得滤液中
 、
、 ,此时溶液中
,此时溶液中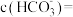
 (保留2位有效数字);“沉锰”后通过过滤、洗涤、干燥得到
(保留2位有效数字);“沉锰”后通过过滤、洗涤、干燥得到 ,检验沉淀洗涤干净的方法是
,检验沉淀洗涤干净的方法是(5)写出空气中进行“氧化焙烧”反应的化学方程式:
您最近一年使用:0次
2023-02-23更新
|
287次组卷
|
2卷引用:福建省福州市八县(市、区)一中2022-2023学年高二上学期期末联考化学试题
名校
解题方法
4 .  (钴酸锂)常用作锂离子电池的正极材料。以某海水(含浓度较大的LiCl、少量
(钴酸锂)常用作锂离子电池的正极材料。以某海水(含浓度较大的LiCl、少量 、
、 、
、 等)为原料制备钴酸锂的一种流程如下:
等)为原料制备钴酸锂的一种流程如下:
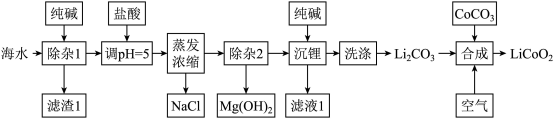
已知:① 的溶解度随温度升高而降低;
的溶解度随温度升高而降低;
②常温下,几种难溶物质的溶度积数据如下:
下列说法错误的是
 (钴酸锂)常用作锂离子电池的正极材料。以某海水(含浓度较大的LiCl、少量
(钴酸锂)常用作锂离子电池的正极材料。以某海水(含浓度较大的LiCl、少量 、
、 、
、 等)为原料制备钴酸锂的一种流程如下:
等)为原料制备钴酸锂的一种流程如下:
已知:①
 的溶解度随温度升高而降低;
的溶解度随温度升高而降低;②常温下,几种难溶物质的溶度积数据如下:
| 物质 |  |  |  |  |  |
 | 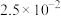 | 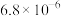 | 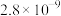 | 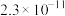 |  |
A.高温时“合成”反应的化学方程式为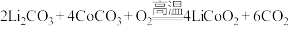 |
B.滤渣1主要成分有 、 、 |
C.“洗涤” 时最好选用冷水 时最好选用冷水 |
D.“除杂2”调pH=12时,溶液中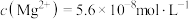 |
您最近一年使用:0次
2023-02-22更新
|
546次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高二下学期开学化学试题
5 . 某工厂产生的废渣中主要含有ZnO,另含有少量FeO、CuO、SiO2等,某科研人员设计的用废渣制取高纯ZnO的工艺流程图如图所示。

已知:25℃时,部分物质的Ksp相关信息如表所示:
(1)按照核外电子排布,把元素周期表划分为5个区。Zn位于_______ 区,基态铁原子价层电子的轨道表示式为_______
(2)“氧化”时发生反应的离子方程式为_______ 。
(3)“除铁”时除了加ZnO,还可以加入_______ (写出一种物质的化学式)。
(4)若“氧化”后所得滤液中c(Zn2+)=1.2mol/L,c(Cu2+)=0.022mol/L,“除铁”操作中为了使铁元素完全除去[c(Fe3+)<10-5mol/L除去完全],又不影响高纯ZnO的产量,可以调节pH的范围是_______ ,滤渣B的主要成分为_______ (填化学式)。
(5)有同学认为各步骤中加入的试剂不变,将该工艺流程设计为“酸浸”→“氧化”→“除铜”→“除铁”也可以除去Cu2+和Fe3+,并回收CuS和 ,该设计是否合理
,该设计是否合理_______ (填“是”或“否”),理由是_______ 。
(6)写出溶液D的主要溶质的电子式_______ 。

已知:25℃时,部分物质的Ksp相关信息如表所示:
 |  |  |  | CuS | ZnS |
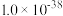 | 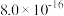 | 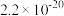 | 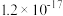 | 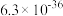 | 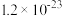 |
(2)“氧化”时发生反应的离子方程式为
(3)“除铁”时除了加ZnO,还可以加入
(4)若“氧化”后所得滤液中c(Zn2+)=1.2mol/L,c(Cu2+)=0.022mol/L,“除铁”操作中为了使铁元素完全除去[c(Fe3+)<10-5mol/L除去完全],又不影响高纯ZnO的产量,可以调节pH的范围是
(5)有同学认为各步骤中加入的试剂不变,将该工艺流程设计为“酸浸”→“氧化”→“除铜”→“除铁”也可以除去Cu2+和Fe3+,并回收CuS和
 ,该设计是否合理
,该设计是否合理(6)写出溶液D的主要溶质的电子式
您最近一年使用:0次
6 . 叠氮化钠(NaN3)用于汽车的安全气囊中,当发生碰撞时迅速分解放出氮气,使安全气囊充气。已知HN3水溶液呈弱酸性,下列叙述中正确的是
| A.0.001 mol∙L−1 HN3水溶液的pH=3 |
| B.0.001 mol∙L−1 HN3水溶液加水稀释,pH降低 |
| C.NaN3分解的化学方程式为:2NaN3=2Na+3N2↑ |
D.NaN3水溶液中:c(Na+)>c(N )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
您最近一年使用:0次
7 . 含硼化合物硼酸( )、硼氢化钠(
)、硼氢化钠( )、硼酸甲酯
)、硼酸甲酯 在工业上有重要用途。回答下列问题:
在工业上有重要用途。回答下列问题:
(1) 在水溶液中会发生如下反应:
在水溶液中会发生如下反应: (反应实质为水电离出的
(反应实质为水电离出的 被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因
被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因_______ 。
(2)利用硼砂(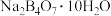 )制备硼酸(
)制备硼酸( )的流程如下图所示:
)的流程如下图所示:
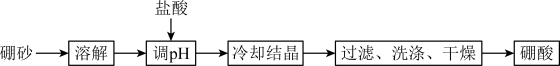
①“调 ”时需要控制溶液
”时需要控制溶液 ,写出用
,写出用 试纸检测溶液
试纸检测溶液 的操作方法:
的操作方法:_______ 。
②“调 ”后溶液中有硼酸生成,写出反应的离子方程式:
”后溶液中有硼酸生成,写出反应的离子方程式:_______ 。
③ 在水中电离方程式为:
在水中电离方程式为: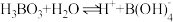 ,
,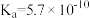 ,据此可判断
,据此可判断 属于
属于_______ 元弱酸,常温下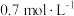 的硼酸溶液中
的硼酸溶液中 的浓度约为
的浓度约为_______ (计算结果保留小数点后一位)。
(3)利用硼酸和甲醇制备硼酸甲酯,发生的反应为: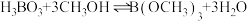 ,不同温度下,硼酸的转化率(
,不同温度下,硼酸的转化率( )随时间变化如图所示:
)随时间变化如图所示:

①该反应的
_______ (填“<”“=”或“>”)0。
②达到平衡时,升高温度,_______ [填“ ”或“
”或“ ”]增大的程度更大。
”]增大的程度更大。
 )、硼氢化钠(
)、硼氢化钠( )、硼酸甲酯
)、硼酸甲酯 在工业上有重要用途。回答下列问题:
在工业上有重要用途。回答下列问题:(1)
 在水溶液中会发生如下反应:
在水溶液中会发生如下反应: (反应实质为水电离出的
(反应实质为水电离出的 被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因
被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因(2)利用硼砂(
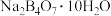 )制备硼酸(
)制备硼酸( )的流程如下图所示:
)的流程如下图所示:
①“调
 ”时需要控制溶液
”时需要控制溶液 ,写出用
,写出用 试纸检测溶液
试纸检测溶液 的操作方法:
的操作方法:②“调
 ”后溶液中有硼酸生成,写出反应的离子方程式:
”后溶液中有硼酸生成,写出反应的离子方程式:③
 在水中电离方程式为:
在水中电离方程式为: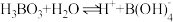 ,
,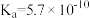 ,据此可判断
,据此可判断 属于
属于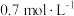 的硼酸溶液中
的硼酸溶液中 的浓度约为
的浓度约为(3)利用硼酸和甲醇制备硼酸甲酯,发生的反应为:
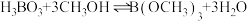 ,不同温度下,硼酸的转化率(
,不同温度下,硼酸的转化率( )随时间变化如图所示:
)随时间变化如图所示:
①该反应的

②达到平衡时,升高温度,
 ”或“
”或“ ”]增大的程度更大。
”]增大的程度更大。
您最近一年使用:0次
2023-02-20更新
|
55次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2022-2023学年高二上学期期末考试化学试题
22-23高一上·浙江杭州·期末
名校
解题方法
8 . 一氧化二氯(Cl2O)是国际公认的高效安全灭菌消毒剂,其部分性质如下:现用如图所示装置制备少量Cl2O。
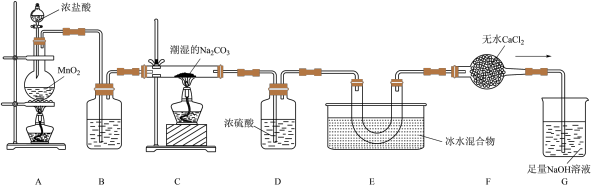
已知:常温下,Cl2O是棕黄色、有刺激性气味的气体,易溶于水;熔点:-120.6℃;沸点2.0℃。
(1)盛有浓盐酸的仪器的名称是_____ 。
(2)装置A中发生反应的离子方程式为______ 。
(3)装置B中的试剂是_____ (填名称)。
(4)装置C中固体产物为NaCl和NaHCO3,写出该反应的化学方程式_____ 。
(5)装置E中Cl2O的收率与装置C的温度和纯碱的含水量的关系如表所示,下列猜想明显不合理的是_____ 。

已知:常温下,Cl2O是棕黄色、有刺激性气味的气体,易溶于水;熔点:-120.6℃;沸点2.0℃。
(1)盛有浓盐酸的仪器的名称是
(2)装置A中发生反应的离子方程式为
(3)装置B中的试剂是
(4)装置C中固体产物为NaCl和NaHCO3,写出该反应的化学方程式
(5)装置E中Cl2O的收率与装置C的温度和纯碱的含水量的关系如表所示,下列猜想明显不合理的是
| 温度/℃ | 纯碱含水量/% | Cl2O收率/% |
| 0~10 | 5.44 | 67.85 |
| 0~10 | 7.88 | 89.26 |
| 10~20 | 8.00 | 64.24 |
| 30~40 | 10.25 | 52.63 |
| 30-40 | 12.50 | 30.38 |
| A.温度越高,Cl2O的收率越低 |
| B.纯碱含水量越高,Cl2O的收率越高 |
| C.随着纯碱含水量增大,Cl2O的收率先增大后减小 |
| D.温度较低时,纯碱含水量越高,Cl2O的收率越高,温度较高时,纯碱含水量越高,Cl2O的收率越低 |
您最近一年使用:0次
名校
9 . 工业上采用电化学法对煤进行脱硫处理(煤中含硫物质主要是 ),以减少硫排放。模拟装置如图所示。下列说法错误的是
),以减少硫排放。模拟装置如图所示。下列说法错误的是
 ),以减少硫排放。模拟装置如图所示。下列说法错误的是
),以减少硫排放。模拟装置如图所示。下列说法错误的是
| A.电子流向:b极→石墨2→电解质溶液→石墨1→a极 |
B.石墨1为阳极,发生氧化反应, 被氧化 被氧化 |
C.脱硫反应为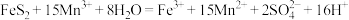 |
D.电路中转移 电子,理论上处理 电子,理论上处理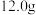  |
您最近一年使用:0次
2023-02-17更新
|
697次组卷
|
6卷引用:广东省佛山市南海区狮山石门高级中学2022-2023学年高二下学期3月月考化学试题
广东省佛山市南海区狮山石门高级中学2022-2023学年高二下学期3月月考化学试题浙江省杭州市富阳区场口中学2023-2024学年高二下学期3月月考化学试题黑龙江省大庆市2023届高三下学期第一次教学质量检测化学试题(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(选择题6-10)(已下线)专题10 电化学的综合应用湖南省衡阳市第一中学2023届高三下学期5月月考化学试题
10 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[ mol·L
mol·L ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和_______ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(2)“氧化”中添加适量的 的作用是将
的作用是将_______ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ 。
(4)“除杂1”的目的是_______ 。
(5)“除杂2”的目的是生成 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是_______ 。
(6)“沉锰”时会产生无色无味的一种气体,写出“沉锰”的离子方程式_______ 。
(7)由图像可知,从“操作A”所得溶液中得到 晶体需进行的操作是
晶体需进行的操作是_______ 、洗涤、干燥。若称取一定质量的 用标准
用标准 溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于100%,分析可能的原因是
溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于100%,分析可能的原因是_______ 。


相关金属离子[
 mol·L
mol·L ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的
 的作用是将
的作用是将(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是
(5)“除杂2”的目的是生成
 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是(6)“沉锰”时会产生无色无味的一种气体,写出“沉锰”的离子方程式
(7)由图像可知,从“操作A”所得溶液中得到
 晶体需进行的操作是
晶体需进行的操作是 用标准
用标准 溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于100%,分析可能的原因是
溶液滴定(操作过程产生的误差很小可忽略),计算所得样品质量分数大于100%,分析可能的原因是
您最近一年使用:0次



