解题方法
1 . 氯化亚铜(化学式可表示为CuCl)常用作有机合成工业中的催化剂,微溶于水、不溶于乙醇,在潮湿空气中易水解、易被氧化。某学习小组用工业废渣(主要成分为Cu2S和Fe2O3)制取CuCl并同时得到电路板蚀刻液,实验步骤如图:
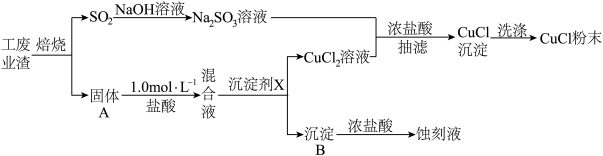
已知:
根据以上信息回答下列问题:
(1)写出焙烧过程中产生SO2的化学方程式:______ ;实验室中常用亚硫酸钠固体与70%的浓硫酸制备二氧化硫,若要达到控制反应速率的目的,图中可选用的装置是_____ (填标号)。
A.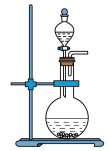 B.
B.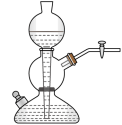 C.
C.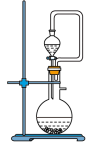 D.
D.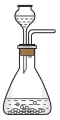
(2)混合液中加入的沉淀剂X可为______ ;(填化学式),调节溶液的pH至______ ,过滤得到CuCl2溶液。
(3)①向Na2SO3溶液中逐滴加入CuCl2溶液,再加入少量浓盐酸,混匀后倾倒出清液,抽滤、洗涤、干燥获得CuCl产品,该反应的离子方程式为______ 。
②抽滤也称减压过滤,请选择合适的仪器并组装抽滤的装置从溶液中得到CuCl产品,装置连接顺序为_____→_____→E→_____(填标号)。______
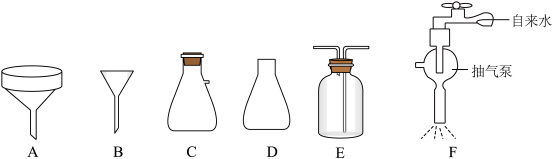
下列有关抽滤的说法错误的是_____ (填标号)。
A.原理为利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的
B.过滤速度快,可得到较干燥的沉淀
C.实验结束后,先关抽气泵,后拔开抽滤瓶接管
③抽滤过程中先用“去氧水”作洗涤剂洗涤产品,然后立即用无水酒精洗涤,并在70℃真空下干燥2h,冷却后密封包装,密封包装的原因是______ 。
(4)实验测得氯化亚铜蒸气的相对分子质量为199,则氯化亚铜的分子式为_____ ;氯化亚铜定量吸收CO后形成配合物Cu2(CO)2Cl2·2H2O(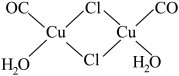 ),则Cu2(CO)2Cl2·2H2O中的配位体为
),则Cu2(CO)2Cl2·2H2O中的配位体为_____ (填化学式)。

已知:
| 金属阳离子 | 开始沉淀的pH | 完全沉淀的pH |
| Cu2+ | 4.8 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
(1)写出焙烧过程中产生SO2的化学方程式:
A.
 B.
B. C.
C. D.
D.
(2)混合液中加入的沉淀剂X可为
(3)①向Na2SO3溶液中逐滴加入CuCl2溶液,再加入少量浓盐酸,混匀后倾倒出清液,抽滤、洗涤、干燥获得CuCl产品,该反应的离子方程式为
②抽滤也称减压过滤,请选择合适的仪器并组装抽滤的装置从溶液中得到CuCl产品,装置连接顺序为_____→_____→E→_____(填标号)。

下列有关抽滤的说法错误的是
A.原理为利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的
B.过滤速度快,可得到较干燥的沉淀
C.实验结束后,先关抽气泵,后拔开抽滤瓶接管
③抽滤过程中先用“去氧水”作洗涤剂洗涤产品,然后立即用无水酒精洗涤,并在70℃真空下干燥2h,冷却后密封包装,密封包装的原因是
(4)实验测得氯化亚铜蒸气的相对分子质量为199,则氯化亚铜的分子式为
 ),则Cu2(CO)2Cl2·2H2O中的配位体为
),则Cu2(CO)2Cl2·2H2O中的配位体为
您最近一年使用:0次
2023-03-16更新
|
658次组卷
|
5卷引用:广西壮族自治区玉林市2022-2023学年高二下学期期中考试化学试题
广西壮族自治区玉林市2022-2023学年高二下学期期中考试化学试题河北省邯郸市2023届高三一模考试化学试题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(实验综合题)(已下线)专题16 实验题(已下线)工业流程题
名校
解题方法
2 . 用硫酸亚铁溶液除去烟气中的 ,主要物质的转化如图,下列说法
,主要物质的转化如图,下列说法不正确 的是
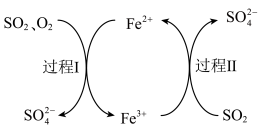
 ,主要物质的转化如图,下列说法
,主要物质的转化如图,下列说法
A. 最终转化为 最终转化为 |
B.过程I中, 作氧化剂 作氧化剂 |
C.过程II中,发生反应: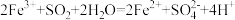 |
D.硫酸亚铁溶液吸收 后,所得的溶液呈碱性 后,所得的溶液呈碱性 |
您最近一年使用:0次
2023-03-15更新
|
1061次组卷
|
7卷引用:2023年北京市第一次普通高中学业水平合格性考试化学试题
解题方法
3 . 钌(Ru)为重要的稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为Ru、Pb、SiO2、Bi2O3,回收钌的工艺流程如图:

已知:“滤液1”中Ru元素和Bi元素存在形式为RuO 、BiO
、BiO 。
。
(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为_____ ;最佳反应温度为_____ 。

(2)已知甲酸的化学式为HCOOH,反应后产物为CO 。则“还原”过程中每生成1molRu(OH)4时,氧化剂和还原剂的物质的量之比为
。则“还原”过程中每生成1molRu(OH)4时,氧化剂和还原剂的物质的量之比为_____ 。
(3)“蒸馏”过程的化学反应方程式为_____ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为_____ 、_____ 。
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2=2Ru+6HCl。实验所得数据记录如表,则产品的纯度为_____ 。

已知:“滤液1”中Ru元素和Bi元素存在形式为RuO
 、BiO
、BiO 。
。(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为

(2)已知甲酸的化学式为HCOOH,反应后产物为CO
 。则“还原”过程中每生成1molRu(OH)4时,氧化剂和还原剂的物质的量之比为
。则“还原”过程中每生成1molRu(OH)4时,氧化剂和还原剂的物质的量之比为(3)“蒸馏”过程的化学反应方程式为
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2=2Ru+6HCl。实验所得数据记录如表,则产品的纯度为
| 实验序号 | 产品质量/g | 固体Ru质量/g |
| ① | 5.000 | 2.0210 |
| ② | 5.000 | 2.0190 |
| ③ | 5.000 | 2.0200 |
| ④ | 5.000 | 1.6200 |
您最近一年使用:0次
解题方法
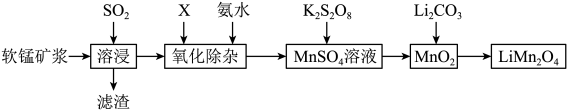
4 . 锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆(主要成分为 ,含少量
,含少量 、FeO、
、FeO、 、
、 等杂质)为原料制备锰酸锂的流程如图所示。
等杂质)为原料制备锰酸锂的流程如图所示。
(1) 的最外层电子排布式为
的最外层电子排布式为___________
(2)溶浸过程中为提高 吸收率可采取的措施有
吸收率可采取的措施有___________ (填序号)。
a.粉碎矿石
b.不断搅拌,使 和软锰矿浆充分接触
和软锰矿浆充分接触
c.减小通入 的流速
的流速
d.升高温度
(3)已知:室温下,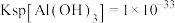 ,
,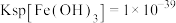 ,pH=7.1时
,pH=7.1时 开始沉淀。氧化除杂时(室温)除去
开始沉淀。氧化除杂时(室温)除去 溶液中的
溶液中的 、
、 (使其浓度小于
(使其浓度小于 ),需调节溶液pH范围为
),需调节溶液pH范围为___________ 。
(4) (结构为
(结构为 )在流程中的作用是
)在流程中的作用是___________ ,它与 溶液常温下混合一周,可以慢慢得到球形二氧化锰(
溶液常温下混合一周,可以慢慢得到球形二氧化锰( )。试写出该反应的离子方程式
)。试写出该反应的离子方程式___________ 。
(5)将 和
和 按4∶1的物质的量比配料,混合搅拌,然后升温至600~750℃,制取产品
按4∶1的物质的量比配料,混合搅拌,然后升温至600~750℃,制取产品 并生两种气体。则该反应的化学方程式为
并生两种气体。则该反应的化学方程式为___________ 。
(6)锰酸锂可充电电池的总反应为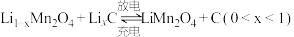
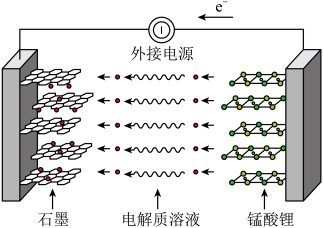
①充电时石墨电极是___________ (填“嵌锂”或“脱嵌”)过程。
②放电时,电池的正极反应式为___________ 。
 ,含少量
,含少量 、FeO、
、FeO、 、
、 等杂质)为原料制备锰酸锂的流程如图所示。
等杂质)为原料制备锰酸锂的流程如图所示。
(1)
 的最外层电子排布式为
的最外层电子排布式为(2)溶浸过程中为提高
 吸收率可采取的措施有
吸收率可采取的措施有a.粉碎矿石
b.不断搅拌,使
 和软锰矿浆充分接触
和软锰矿浆充分接触c.减小通入
 的流速
的流速d.升高温度
(3)已知:室温下,
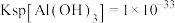 ,
,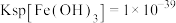 ,pH=7.1时
,pH=7.1时 开始沉淀。氧化除杂时(室温)除去
开始沉淀。氧化除杂时(室温)除去 溶液中的
溶液中的 、
、 (使其浓度小于
(使其浓度小于 ),需调节溶液pH范围为
),需调节溶液pH范围为(4)
 (结构为
(结构为 )在流程中的作用是
)在流程中的作用是 溶液常温下混合一周,可以慢慢得到球形二氧化锰(
溶液常温下混合一周,可以慢慢得到球形二氧化锰( )。试写出该反应的离子方程式
)。试写出该反应的离子方程式(5)将
 和
和 按4∶1的物质的量比配料,混合搅拌,然后升温至600~750℃,制取产品
按4∶1的物质的量比配料,混合搅拌,然后升温至600~750℃,制取产品 并生两种气体。则该反应的化学方程式为
并生两种气体。则该反应的化学方程式为(6)锰酸锂可充电电池的总反应为
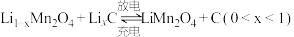

①充电时石墨电极是
②放电时,电池的正极反应式为
您最近一年使用:0次
名校
解题方法
5 . 铝灰主要含有Al2O3、Al,以及少量硅石和Fe的氧化物,利用铝灰制备净水剂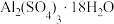 的工艺流程如图。
的工艺流程如图。

已知:金属离子浓度为0.1mol∙L-1时生成氢氧化物沉淀的pH
回答相关问题:
(1)酸浸时为确保安全应注意_______ ,酸浸充分后溶液中的金属阳离子是_______ 。
(2)操作I和II的名称是_______ 。
(3)若无氧化步骤,对实验的影响是_______ 。
(4)棕色沉淀含MnO2,操作①加入MnSO4反应的离子方程式是_______ ,判断该反应完成的现象是_______ 。
(5)操作②调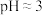 的原因是
的原因是_______ 。
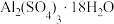 的工艺流程如图。
的工艺流程如图。
已知:金属离子浓度为0.1mol∙L-1时生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)酸浸时为确保安全应注意
(2)操作I和II的名称是
(3)若无氧化步骤,对实验的影响是
(4)棕色沉淀含MnO2,操作①加入MnSO4反应的离子方程式是
(5)操作②调
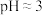 的原因是
的原因是
您最近一年使用:0次
2023·四川成都·二模
6 . 从一种阳极泥(主要成分为Cu、Ag、Pt、Au、Ag2Se、Cu2S)中回收重金属的工艺流程如图所示:
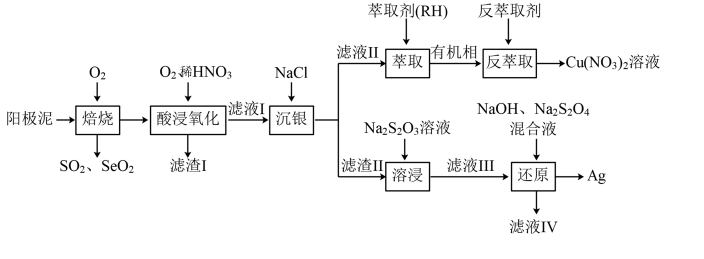
已知: 在碱性条件下很稳定。回答下列问题:
在碱性条件下很稳定。回答下列问题:
(1)Cu2S焙烧为CuO,该过程中还原剂与氧化剂的物质的量之比为_______ 。
(2)“滤渣I”的主要成分是_______ (填化学式);加快“酸浸氧化”速率的措施有_______ (填写一条即可)。
(3)萃取与反萃取的原理为:2RH+Cu2+ R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是
R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是_______ (填名称);该流程中的“反萃取剂”最好选用_______ (填标号)。
A.乙醇 B.HNO3溶液 C.盐酸 D.NaOH 溶液
(4)已知:Ag++2
 [Ag(S2O3)2]3− K=2.80×1013
[Ag(S2O3)2]3− K=2.80×1013
AgCl(s) Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10
Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10
①“溶浸”过程中,滤渣II被Na2S2O3溶液溶解的反应为:AgCl+2
 [Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为
[Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为_______ ;
②“滤液IV”可返回溶浸工序循环使用,循环多次后,即使调控Na2S2O3溶液浓度,银的浸出率仍会降低。试从化学平衡的角度解释可能的原因:_______ 。
(5)请从环保角度对该工艺流程提出合理的优化建议:_______ (写出一条即可)。

已知:
 在碱性条件下很稳定。回答下列问题:
在碱性条件下很稳定。回答下列问题:(1)Cu2S焙烧为CuO,该过程中还原剂与氧化剂的物质的量之比为
(2)“滤渣I”的主要成分是
(3)萃取与反萃取的原理为:2RH+Cu2+
 R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是
R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是A.乙醇 B.HNO3溶液 C.盐酸 D.NaOH 溶液
(4)已知:Ag++2

 [Ag(S2O3)2]3− K=2.80×1013
[Ag(S2O3)2]3− K=2.80×1013AgCl(s)
 Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10
Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10①“溶浸”过程中,滤渣II被Na2S2O3溶液溶解的反应为:AgCl+2

 [Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为
[Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为②“滤液IV”可返回溶浸工序循环使用,循环多次后,即使调控Na2S2O3溶液浓度,银的浸出率仍会降低。试从化学平衡的角度解释可能的原因:
(5)请从环保角度对该工艺流程提出合理的优化建议:
您最近一年使用:0次
2023-03-12更新
|
1189次组卷
|
5卷引用:第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)四川省成都市蓉城名校联盟2023届高三下学期第二次联考理综化学试题湖南省衡阳县2023届高三3月教学质量诊断性检测考试化学试题(已下线)2023年北京卷高考真题变式题(工业流程题)(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)
名校
解题方法
7 . NH3的合成及应用一直是科学研究的重要课题。
(1)以N2、H2合成NH3,Fe是常用的催化剂。基态Fe原子简化电子排布式为___________ 。
(2)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,

该反应的化学方程式为___________ 。
(3)我国化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①NaHCO3分解得Na2CO3, 的空间结构为
的空间结构为___________ 。
②1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3.NH3极易溶于水的原因是___________ 。
③反应时,向饱和NaCl溶液中先通入的气体是___________ 。
(4)NH3BH3(氨棚烷)的储氢量高,是具有广泛应用前景的储氢材料。比较沸点:NH3BH3___________ CH3CH3(填“>”或“<”)。
(5)HEC中的C、N、O三种元素都能与H元素形成含A-A(A表示C、N、O元素)键的氢化物。氢化物中A-A键的键能(kJ·moL⁻¹)如下表:
A-A键的键能依次降低的原因是___________ 。
(1)以N2、H2合成NH3,Fe是常用的催化剂。基态Fe原子简化电子排布式为
(2)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,

该反应的化学方程式为
(3)我国化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①NaHCO3分解得Na2CO3,
 的空间结构为
的空间结构为②1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3.NH3极易溶于水的原因是
③反应时,向饱和NaCl溶液中先通入的气体是
(4)NH3BH3(氨棚烷)的储氢量高,是具有广泛应用前景的储氢材料。比较沸点:NH3BH3
(5)HEC中的C、N、O三种元素都能与H元素形成含A-A(A表示C、N、O元素)键的氢化物。氢化物中A-A键的键能(kJ·moL⁻¹)如下表:
 |  | HO-OH |
| 346 | 247 | 207 |
A-A键的键能依次降低的原因是
您最近一年使用:0次
名校
解题方法
8 . 某研究性学习小组对实验室中 制取、收集、吸收以及
制取、收集、吸收以及 的还原性探究进行了如下实验设计。
的还原性探究进行了如下实验设计。

Ⅰ. 的收集和吸收
的收集和吸收
(1)用图甲装置收集 ,气体应从
,气体应从___________ (填“m”或“n”)口进入。
(2)已知 难溶于
难溶于 。图乙、丙、丁、戊四种装置中,不能用来吸收
。图乙、丙、丁、戊四种装置中,不能用来吸收 的是
的是___________ 。
Ⅱ. 的还原性探究
的还原性探究
利用如图装置,进行 还原
还原 的反应。
的反应。

已知: 与
与 反应的生成物为
反应的生成物为 、
、 和无毒气体X,且X不被浓硫酸和碱石灰吸收。
和无毒气体X,且X不被浓硫酸和碱石灰吸收。
(3)采用上图装置A作为 的发生装置,写出该反应的化学方程式
的发生装置,写出该反应的化学方程式___________ 。
(4)按气流从左到右的方向装置的正确连接顺序为:___________ 。
A→___________→___________→___________→___________→C(填字母,每个装置只用一次)。
(5)实验结束时,应首先___________ (填序号)。
①熄灭A装置的酒精灯
②熄灭B装置的酒精灯
(6)若称取1.6g 完全反应后,测得生成气体X的体积为224
完全反应后,测得生成气体X的体积为224 (标准状况下),通过计算推测X的化学式为
(标准状况下),通过计算推测X的化学式为___________ 。
(7)装置B中 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
 制取、收集、吸收以及
制取、收集、吸收以及 的还原性探究进行了如下实验设计。
的还原性探究进行了如下实验设计。
Ⅰ.
 的收集和吸收
的收集和吸收(1)用图甲装置收集
 ,气体应从
,气体应从(2)已知
 难溶于
难溶于 。图乙、丙、丁、戊四种装置中,不能用来吸收
。图乙、丙、丁、戊四种装置中,不能用来吸收 的是
的是Ⅱ.
 的还原性探究
的还原性探究利用如图装置,进行
 还原
还原 的反应。
的反应。
已知:
 与
与 反应的生成物为
反应的生成物为 、
、 和无毒气体X,且X不被浓硫酸和碱石灰吸收。
和无毒气体X,且X不被浓硫酸和碱石灰吸收。(3)采用上图装置A作为
 的发生装置,写出该反应的化学方程式
的发生装置,写出该反应的化学方程式(4)按气流从左到右的方向装置的正确连接顺序为:
A→___________→___________→___________→___________→C(填字母,每个装置只用一次)。
(5)实验结束时,应首先
①熄灭A装置的酒精灯
②熄灭B装置的酒精灯
(6)若称取1.6g
 完全反应后,测得生成气体X的体积为224
完全反应后,测得生成气体X的体积为224 (标准状况下),通过计算推测X的化学式为
(标准状况下),通过计算推测X的化学式为(7)装置B中
 与
与 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
2023-03-12更新
|
511次组卷
|
3卷引用:陕西省汉中市2020-2021学年高二下学期期中联考化学试题
陕西省汉中市2020-2021学年高二下学期期中联考化学试题河南省洛阳市宜阳县第一高级中学2022-2023学年高一下学期3月月考化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(实验综合题)
9 . CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要含CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:

下表是相关金属离子生成氢氧化物沉淀的
(1)写出“酸溶”时发生氧化还原反应的化学方程式_____________ 。
(2)“除铝”过程中需要调节溶液 的范围为
的范围为______________ ,写出该过程发生的离子方程式_________________ 。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________ ;上述“萃取”过程可表示为 (水层)
(水层) (有机层)
(有机层)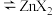 (有机层)
(有机层) (水层),由有机层获取
(水层),由有机层获取 溶液的操作名称是
溶液的操作名称是________ 。
(4)简述洗涤沉淀的操作_________________________ 。
(5)在空气中煅烧 生成钴氧化物和
生成钴氧化物和 ,测得充分煅烧后固体质量为
,测得充分煅烧后固体质量为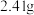 ,
, 的体积为
的体积为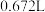 (标准状况),则该钴氧化物的化学式为
(标准状况),则该钴氧化物的化学式为____________ 。

下表是相关金属离子生成氢氧化物沉淀的

金属离子 | 开始沉淀的 | 沉淀完全的 |
| 7.6 | 9.4 |
| 3.0 | 5.0 |
| 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式
(2)“除铝”过程中需要调节溶液
 的范围为
的范围为(3)在实验室里,萃取操作用到的玻璃仪器主要有
 (水层)
(水层) (有机层)
(有机层)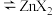 (有机层)
(有机层) (水层),由有机层获取
(水层),由有机层获取 溶液的操作名称是
溶液的操作名称是(4)简述洗涤沉淀的操作
(5)在空气中煅烧
 生成钴氧化物和
生成钴氧化物和 ,测得充分煅烧后固体质量为
,测得充分煅烧后固体质量为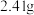 ,
, 的体积为
的体积为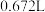 (标准状况),则该钴氧化物的化学式为
(标准状况),则该钴氧化物的化学式为
您最近一年使用:0次
10 . 黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),
(1)补全并配平该反应的化学方程式,标出电子转移的数目和方向:_______
□P4+□NaOH+□_______= □PH3↑+□NaH2PO2
标出电子转移的数目和方向:_________
方程式配平_______
(2)其中氧化剂和还原剂质量比为_______ 。
(1)补全并配平该反应的化学方程式,标出电子转移的数目和方向:_______
□P4+□NaOH+□_______= □PH3↑+□NaH2PO2
标出电子转移的数目和方向:
方程式配平
(2)其中氧化剂和还原剂质量比为
您最近一年使用:0次





