名校
1 . 二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如图所示。

下列叙述正确的是

下列叙述正确的是
A.海水酸化能引起HCO 浓度减小、CO 浓度减小、CO 浓度增大 浓度增大 |
| B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少 |
C.CO2能引起海水酸化,其原理为HCO ⇌H++ CO ⇌H++ CO |
| D.珊瑚周围藻类植物的生长不利于珊瑚的形成 |
您最近一年使用:0次
2020-11-17更新
|
247次组卷
|
2卷引用:山东省日照市莒县2020-2021学年高二11月模块考试化学试题
2 . 铂(78Pt)被誉为“第一重要的高技术金属”,因独特的物理化学性质,被广泛应用于汽车、石油化工、电气电子等现代工业中。水合肼还原精炼法是铂精炼的方法之一,流程如下:

已知:①氯铂酸铵[(NH4)2PtCl6],黄色,难溶于水,易溶于盐酸并生成H2PtCl6;
②氯亚铂酸铵[(NH4)2PtCl4],红色,易溶于水。
回答下列问题:
(1)铂位于周期表中第______ 周期,试写出一种金属铂在中学化学中的应用____________
(2)工业原料粗氯铂酸铵中含有大量氯化铵等可溶性的盐,在实验室中预处理时,需将样品溶解过滤后洗涤,洗涤沉淀方法是____________
(3)在还原溶解中观察到的现象:__________
(4)氧化沉淀过程的反应方程式为:___________
(5)有研究表明,氯铂酸铵制取金属铂,除了煅烧外,也可将其溶解于盐酸中,加入Zn,得到产品,反应过程有Zn+2HCl = ZnCl2+H2↑;_________
(6)水合肼还原精炼法在溶解时的固液比、溶液的酸度(盐酸浓度)、反应时间等对于精炼铂的产率,均有较大的影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示,由此可得最佳的反应条件是_________


已知:①氯铂酸铵[(NH4)2PtCl6],黄色,难溶于水,易溶于盐酸并生成H2PtCl6;
②氯亚铂酸铵[(NH4)2PtCl4],红色,易溶于水。
回答下列问题:
(1)铂位于周期表中第
(2)工业原料粗氯铂酸铵中含有大量氯化铵等可溶性的盐,在实验室中预处理时,需将样品溶解过滤后洗涤,洗涤沉淀方法是
(3)在还原溶解中观察到的现象:
(4)氧化沉淀过程的反应方程式为:
(5)有研究表明,氯铂酸铵制取金属铂,除了煅烧外,也可将其溶解于盐酸中,加入Zn,得到产品,反应过程有Zn+2HCl = ZnCl2+H2↑;
(6)水合肼还原精炼法在溶解时的固液比、溶液的酸度(盐酸浓度)、反应时间等对于精炼铂的产率,均有较大的影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示,由此可得最佳的反应条件是

您最近一年使用:0次
3 . 乙基叔丁基酸(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂,用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g) ETBE(g)ΔH。回答下列问题:
ETBE(g)ΔH。回答下列问题:
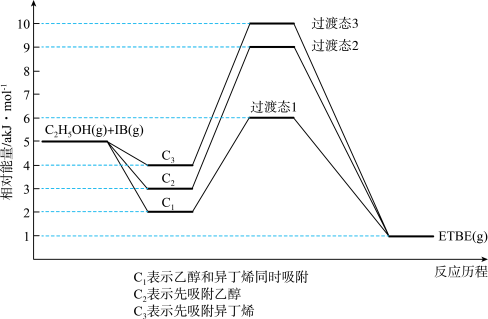
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的ΔH=______ akJ·mol-1,下列选项正确的是______ (填序号)。
a.反应历程的最优途径是C1
b.HZSM-5没有参加化学反应
c.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
d.升高反应温度有利于提高平衡产率
(2)向刚性容器中按物质的量之比1:1充入乙醇和异丁烯,在温度为378K与388K时异丁烯的转化率随时间变化如图所示。
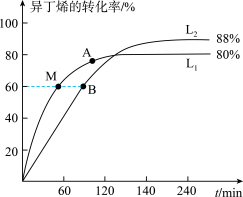
①图中A、M、B三点,逆反应速率由大到小的顺序为______ (用符号A、M、B填写)。
②388K时,容器内起始总压为P0Pa,用分压表示的该反应的平衡常数Kp=______ Pa-1(用含有P0的式子表示)。
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为:k=Ae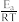 (其中,k为速率常数A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是
(其中,k为速率常数A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是_______ (填序号,k正、k逆为正、逆速率常数)。
a.其他条件不变,升高温度,k正增大,k逆变小
b.其他条件不变,使用催化剂,k正、k逆同倍数增大
c.其他条件不变,增大反应物浓度k正增大,k逆不变
d.其他条件不变,减小压强,k正、k逆都不变
已知反应速率v=v正-v逆=k正P(C2H5OH)P(IB)-k逆P(ETBE),计算图中M点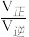 =
=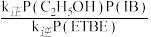 =
=_______ (保留两位小数)
 ETBE(g)ΔH。回答下列问题:
ETBE(g)ΔH。回答下列问题:
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的ΔH=
a.反应历程的最优途径是C1
b.HZSM-5没有参加化学反应
c.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
d.升高反应温度有利于提高平衡产率
(2)向刚性容器中按物质的量之比1:1充入乙醇和异丁烯,在温度为378K与388K时异丁烯的转化率随时间变化如图所示。

①图中A、M、B三点,逆反应速率由大到小的顺序为
②388K时,容器内起始总压为P0Pa,用分压表示的该反应的平衡常数Kp=
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为:k=Ae
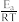 (其中,k为速率常数A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是
(其中,k为速率常数A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是a.其他条件不变,升高温度,k正增大,k逆变小
b.其他条件不变,使用催化剂,k正、k逆同倍数增大
c.其他条件不变,增大反应物浓度k正增大,k逆不变
d.其他条件不变,减小压强,k正、k逆都不变
已知反应速率v=v正-v逆=k正P(C2H5OH)P(IB)-k逆P(ETBE),计算图中M点
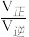 =
=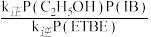 =
=
您最近一年使用:0次
名校
4 . 工业上生产环氧乙烷的反应为:2 CH2=CH2 (g) + O2 (g) = 2 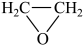 (g) ∆H = -106 kJ • mol−1,其反应机理如下:
(g) ∆H = -106 kJ • mol−1,其反应机理如下:
①Ag + O2=AgO2慢
②CH2=CH2+ AgO2 = + AgO 快
+ AgO 快
③CH2= CH2 + 6AgO =2CO2 + 2H2O + 6Ag 快
下列有关该反应的说法正确的是
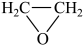 (g) ∆H = -106 kJ • mol−1,其反应机理如下:
(g) ∆H = -106 kJ • mol−1,其反应机理如下:①Ag + O2=AgO2慢
②CH2=CH2+ AgO2 =
 + AgO 快
+ AgO 快③CH2= CH2 + 6AgO =2CO2 + 2H2O + 6Ag 快
下列有关该反应的说法正确的是
| A.反应的活化能等于 106 kJ·mol−1 |
| B.工业上生产环氧乙烷的反应是一个焓减熵增的反应,所以能自发进行 |
| C.增大乙烯浓度能显著提高环氧乙烷的生成速率 |
| D.理论上 0.7 mol 乙烯参与反应最多可得到 0.6 mol 环氧乙烷 |
您最近一年使用:0次
2020-10-31更新
|
257次组卷
|
3卷引用:北京二中2020-2021学年高二上学期10月月考化学试题
名校
5 . 氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g) NH2CO2NH4(s) H1=-159.5kJ·mol-1
NH2CO2NH4(s) H1=-159.5kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) H2=+116.5kJ·mol
CO(NH2)2(s)+H2O(g) H2=+116.5kJ·mol
反应Ⅲ:H2O(1)=H2O(g) H3=+44.0kJ•mol-1
则反应:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(1) H=
CO(NH2)2(s)+H2O(1) H=___ kJ/mol
(2)将氨气与二氧化碳在有催化剂的反应器中反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
CO(NH2)2(s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:

①a点___ (填是或不是)处于平衡状态,T1之后尿素产率下降的原因是___ 。
②实际生产中,原料气带有水蒸气,图2表示CO2转化率与氨碳比 、水碳比
、水碳比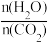 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___ ,测得b点氨的转化率为30%,则x=___ 。
③已知该反应的v(正)=k(逆)c2(NH3)c(CO2),v(逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是___ 。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)
 NH2CO2NH4(s) H1=-159.5kJ·mol-1
NH2CO2NH4(s) H1=-159.5kJ·mol-1反应Ⅱ:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) H2=+116.5kJ·mol
CO(NH2)2(s)+H2O(g) H2=+116.5kJ·mol反应Ⅲ:H2O(1)=H2O(g) H3=+44.0kJ•mol-1
则反应:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(1) H=
CO(NH2)2(s)+H2O(1) H=(2)将氨气与二氧化碳在有催化剂的反应器中反应2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
CO(NH2)2(s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
①a点
②实际生产中,原料气带有水蒸气,图2表示CO2转化率与氨碳比
 、水碳比
、水碳比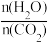 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是③已知该反应的v(正)=k(逆)c2(NH3)c(CO2),v(逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是
您最近一年使用:0次
名校
6 . 2018年是哈伯因发明用氮气和氢气合成氨的方法而获得诺贝尔奖100周年。 和
和 生成
生成 的反应为
的反应为 ,在Fe的催化作用下的反应历程如下(*表示吸附态)
,在Fe的催化作用下的反应历程如下(*表示吸附态)
化学吸附: ;
; 。
。
表面反应: ;
;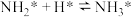 。
。
脱附: 。
。
其中, 的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。请回答下列问题:
的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。请回答下列问题:
(1)有利于提高合成氨平衡产率的条件有_____________ 。
A.低温 B.高温 C.低压
D.高压 E催化剂
(2)实际生产中,常用铁触媒作催化剂,控制温度为773K左右,压强为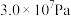 左右,原料气中
左右,原料气中 和
和 物质的量之比为1:2.8。分析说明原料气中
物质的量之比为1:2.8。分析说明原料气中 过量的两个理由
过量的两个理由__________ 、_______________ 。
(3)关于合成氨工艺的下列理解,正确的是_________ 。
A.合成氨反应在不同温度下的 和
和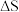 都小于零
都小于零
B.当温度压强一定时,在原料气( 和
和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率
的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C. 易液化,不断将液氨移去,有利于反应正向进行
易液化,不断将液氨移去,有利于反应正向进行
D.分离空气可得 通过天然气和水蒸气转化可得
通过天然气和水蒸气转化可得 原料气须经过净化处理,以防止催化剂中毒和发生安全事故
原料气须经过净化处理,以防止催化剂中毒和发生安全事故
 和
和 生成
生成 的反应为
的反应为 ,在Fe的催化作用下的反应历程如下(*表示吸附态)
,在Fe的催化作用下的反应历程如下(*表示吸附态)化学吸附:
 ;
; 。
。表面反应:
 ;
;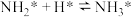 。
。脱附:
 。
。其中,
 的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。请回答下列问题:
的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。请回答下列问题:(1)有利于提高合成氨平衡产率的条件有
A.低温 B.高温 C.低压
D.高压 E催化剂
(2)实际生产中,常用铁触媒作催化剂,控制温度为773K左右,压强为
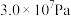 左右,原料气中
左右,原料气中 和
和 物质的量之比为1:2.8。分析说明原料气中
物质的量之比为1:2.8。分析说明原料气中 过量的两个理由
过量的两个理由(3)关于合成氨工艺的下列理解,正确的是
A.合成氨反应在不同温度下的
 和
和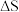 都小于零
都小于零B.当温度压强一定时,在原料气(
 和
和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率
的比例不变)中添加少量惰性气体,有利于提高平衡转化率C.
 易液化,不断将液氨移去,有利于反应正向进行
易液化,不断将液氨移去,有利于反应正向进行D.分离空气可得
 通过天然气和水蒸气转化可得
通过天然气和水蒸气转化可得 原料气须经过净化处理,以防止催化剂中毒和发生安全事故
原料气须经过净化处理,以防止催化剂中毒和发生安全事故
您最近一年使用:0次
2020-10-27更新
|
267次组卷
|
2卷引用:山东省临沂市费县地区化学2020-2021学年高二上学期9月月考化学试题
7 . 一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,其是重要的水的消毒剂。
(1)写出NH2Cl的电子式____________________ 。
(2)写出NH2Cl与水反应的化学方程式___________________________ 。
(3)一定条件下(T ℃、1 atm),可以用Cl2(g)和NH3(g)制得NH2Cl(g)同时得到HCl(g)。
已知部分化学键的键能如表所示:
写出该反应的热化学方程式____________________________________ 。
(1)写出NH2Cl的电子式
(2)写出NH2Cl与水反应的化学方程式
(3)一定条件下(T ℃、1 atm),可以用Cl2(g)和NH3(g)制得NH2Cl(g)同时得到HCl(g)。
已知部分化学键的键能如表所示:
| 化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
| 键能/(kJ·mol-1) | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式
您最近一年使用:0次
名校
解题方法
8 . 运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)反应:N2(g)+O2(g)⇌2NO(g) △H1=+180.5kJ·mol-1
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H2
已知CO的燃烧热为283.0 kJ·mol-1,则△H2=________ 。
(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g) ⇌2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)⇌N2O2(g)(快);v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢);v2正=k2正·c(N2O2)c(O2);v2逆=k2逆·c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_________ 。
②决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应_________ (填“Ⅰ”或“Ⅱ”),反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1______ E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是______ 。
A.k2正增大,c(N2O2)增大 B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小 D.k2正减小,c(N2O2)增大
(3)在一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),4min时达平衡,此时测得氮气的物质的量为0.2mol,则0-4min内用CO2表示的的平均速率为_______ kPa·min-1,用平衡分压表示的平衡常数KP=__________ (用含有P0的代数式表示)。达平衡后,若改变下列条件,既能加快反应速率又能提高NO的转化率的是_______
A.增大压强 B.降低温度 C.再加入0.5molNO、0.5molCO D.分离出部分N2
(1)反应:N2(g)+O2(g)⇌2NO(g) △H1=+180.5kJ·mol-1
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H2
已知CO的燃烧热为283.0 kJ·mol-1,则△H2=
(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g) ⇌2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)⇌N2O2(g)(快);v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢);v2正=k2正·c(N2O2)c(O2);v2逆=k2逆·c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
②决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应
A.k2正增大,c(N2O2)增大 B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小 D.k2正减小,c(N2O2)增大
(3)在一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),4min时达平衡,此时测得氮气的物质的量为0.2mol,则0-4min内用CO2表示的的平均速率为
A.增大压强 B.降低温度 C.再加入0.5molNO、0.5molCO D.分离出部分N2
您最近一年使用:0次
2020-10-21更新
|
508次组卷
|
4卷引用:山东省实验中学2020届高三下学期打靶模拟考试化学试题
名校
解题方法
9 . 电化学原理在工业生产中发挥着巨大的作用。
(1)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4

①阳极的电极反应式为_______
②阴极产生的气体为________
③右侧的离子交换膜为________ (填“阴”或“阳”)离子交换膜,阴极区a%_______ b%(填“>”“=”或“<”)
(2)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH )
)_________ (填“>”“<”或“=”)c(NO )。
)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为_______ 。
③理论上电路中每转移3mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是______ g。
(1)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4

①阳极的电极反应式为
②阴极产生的气体为
③右侧的离子交换膜为
(2)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH
 )
) )。
)。②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为
③理论上电路中每转移3mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是
您最近一年使用:0次
2020-10-18更新
|
1014次组卷
|
2卷引用:山东省实验中学2021届高三上学期第一次诊断考试化学试题
名校
解题方法
10 . 综合利用CO2、CO对构建低碳社会有重要意义。
(1) Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为____ 。
(2) 固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c发生的电极反应式:___________ 、_____________ 。

(3) 电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g)⇌CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g)。此时向容器中再通入0.35 mol CO气体,则此平衡将_____ (填“向正反应方向”“不”或“向逆反应方向”)移动。
(4) 已知:
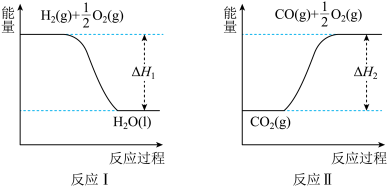
若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)⇌CH3OH(l)的ΔH,则ΔH=_____ 。
(5) 利用太阳能和缺铁氧化物可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图所示,若用1 mol缺铁氧化物与足量CO2完全反应可生成______ mol C(碳)。

(1) Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为
(2) 固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c发生的电极反应式:

(3) 电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g)⇌CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g)。此时向容器中再通入0.35 mol CO气体,则此平衡将
(4) 已知:

若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)⇌CH3OH(l)的ΔH,则ΔH=
(5) 利用太阳能和缺铁氧化物可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图所示,若用1 mol缺铁氧化物与足量CO2完全反应可生成

您最近一年使用:0次



