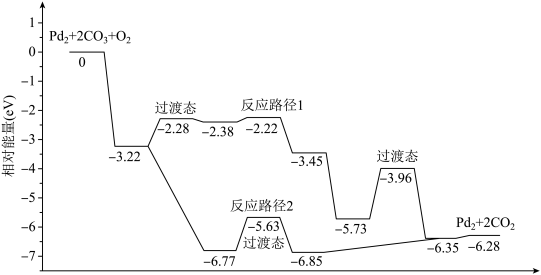
| A.该过程中有极性键和非极性键的断裂和生成 |
| B.反应路径2的催化效果更好 |
| C.催化剂不会改变整个反应的ΔH |
| D.路径1中最大能垒(活化能)E正=1.23eV |
(1)用H2S和天然气生产CS2的反应为CH4(g)+2H2S(g)
 CS2(l)+4H2(g)。
CS2(l)+4H2(g)。已知:I.CH4(g)+4S(s)
 CS2(g)+2H2S(g) ΔH1=akJ·mol-1;
CS2(g)+2H2S(g) ΔH1=akJ·mol-1;II.S(s)+H2(g)
 H2S(g) ΔH2=bkJ·mol-1;
H2S(g) ΔH2=bkJ·mol-1;Ⅲ.CS2(1)
 CS2(g) ΔH3=ckJ·mol-1。
CS2(g) ΔH3=ckJ·mol-1。则反应CH4(g)+2H2S(g)
 CS2(1)+4H2(g)的ΔH=
CS2(1)+4H2(g)的ΔH=(2)800℃时,将一定量的H2S气体充入1L密闭容器中,发生反应H2S(g)
 S(s)+H2(g),tmin后反应达到化学平衡状态,测得容器中H2与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度
S(s)+H2(g),tmin后反应达到化学平衡状态,测得容器中H2与H2S的质量浓度分别为0.02g/L、0.34g/L,则H2S的初始浓度(3)向恒压密闭容器中充入0.1molCH4和0.2molH2S,发生反应CH4(g)+2H2S(g)
 CS2(g)+4H2(g),测得不同温度下,CH4的平衡转化率(%)与温度(℃)的关系如图所示:
CS2(g)+4H2(g),测得不同温度下,CH4的平衡转化率(%)与温度(℃)的关系如图所示:
①1200℃,反应达到平衡时, H2S的物质的量分数为
②1200℃时,在恒温恒容时,欲提高CH4的平衡转化率,可以采取的措施是
A.使用高效催化剂 B.再充入CH4
C.再充入H2S D.充入He E.移走H2
(4)某溶液中含0.01mol/L Fe2+和某浓度的Mn2+,当S2-浓度至少为
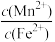 =
= 和NH3·H2O的形式存在,在一定条件下,NH
和NH3·H2O的形式存在,在一定条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下: 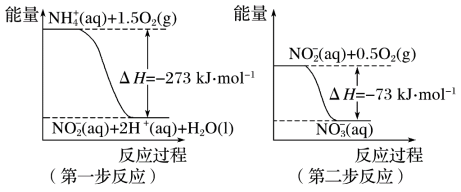
下列说法合理的是
A.该反应的催化剂是NO |
B.升高温度,两步反应速率均加快,有利于NH 转化成NO 转化成NO |
| C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态 |
D.1 mol NH 在第一步反应中与1 mol NO 在第一步反应中与1 mol NO 在第二步反应中失电子数之比为1:3 在第二步反应中失电子数之比为1:3 |
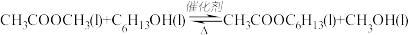
已知v正=k正χ(CH3COOCH3)·χ(C6H13OH),v逆=k逆χ(CH3COOC6H13)·χ(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,χ为备组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的

在曲线①、②、③中,k正—k逆值最小的曲线是
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到甲衡后,初始投料比
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法不正确的是
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
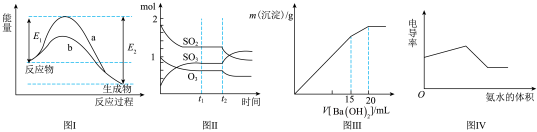
| A.图Ⅰ表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化 |
B.图Ⅱ表示一定条件下进行的反应 各成分的物质的量变化, 各成分的物质的量变化, 时刻改变的条件可能是缩小容器体积 时刻改变的条件可能是缩小容器体积 |
C.图Ⅲ表示某明矾溶液中加入 溶液,沉淀的质量与加入 溶液,沉淀的质量与加入 溶液体积的关系,在加入 溶液体积的关系,在加入 溶液时铝离子恰好沉淀完全 溶液时铝离子恰好沉淀完全 |
| D.电导率可表示溶液导电性的强弱,电导率越大导电性越强,图Ⅳ可表示向盐酸和醋酸混合溶液中滴入氨水过程中电导率的变化关系 |
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH3催化还原NOx可消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H=-112 kJ·mol-1;
③适量的N2和O2完全反应,每生成5.6 L(标准状况下)NO时,吸收22.5 kJ的热量。则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=
(2)在汽车排气系统中安装三元催化转化器,可发生下列反应:2NO(g)+2CO(g)
 2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示:
2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示: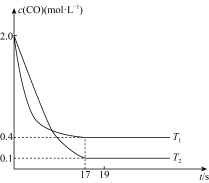
①该反应的逆反应为
②温度为T1时,反应达到平衡时NO的转化率为
③温度为T2时,该反应的平衡常数K=
(3)目前烟气脱硝采用的技术有选择性非催化还原法(SNCR)脱硝技术和选择性催化还原法(SCR)脱硝技术。若用NH3作还原剂,则主要反应可表示为4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O △H<0,其中体系温度对SNCR技术脱硝效率的影响如图所示:
4N2(g)+6H2O △H<0,其中体系温度对SNCR技术脱硝效率的影响如图所示: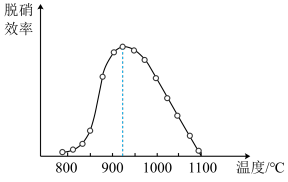
①SNCR技术脱硝的最佳温度为
②由题给信息分析,当体系温度过高时,SNCR技术脱硝效率降低,其可能的原因是
 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。
回答下列问题:
(1)
 中Fe元素的化合价为
中Fe元素的化合价为(2)“碱浸”中发生反应的离子方程式为
(3)“浸取”中加入
 的作用为
的作用为(4)已知碳酸锂的分解温度为
 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为(5)写出“焙烧”过程中生成锰酸锂的化学方程式
8 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)化学家GethardErtl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如图:

下列说法正确的是
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)关于合成氨工艺的理解,下列错误的是
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量
C.合成氨工业采用10MPa一30MPa的高压,是因常压下N2和H2的转化率不高
D.将合成后混合气体中的氨液化,剩余气体可以循环利用
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1∶3时,平衡混合物中氨的体积分数[φ(NH3)]。

①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3)
②在250℃、1.0×104kPa下,N2的转化率为
(4)N2和H2在铁作催化剂作用下从145℃就开始反应,随着温度上升,单位时间内NH3产率增大,但温度高于900℃后,单位时间内NH3产率逐渐下降的原因
(5)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol•min-1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,氨气分解反应活化能最大的是
②温度为T,在一体积固定的密闭容器中加入2molNH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g) N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
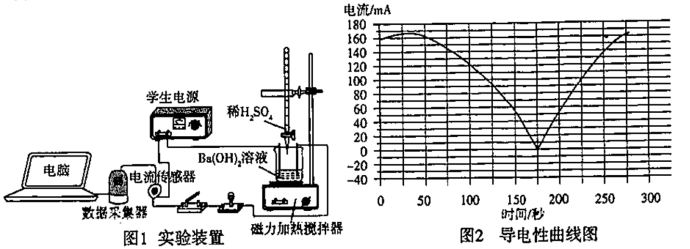
A.该反应的离子方程式是 Ba2+ +2OH- +SO +2H+=BaSO4↓+ 2H2O +2H+=BaSO4↓+ 2H2O |
| B.反应在经历大约270秒时,放出的热量也达到最大值。 |
| C.导电能力最低点表示 Ba(OH)2溶液和 H2SO4溶液恰好完全反应 |
| D.用盐酸代替H2SO4溶液,测得的导电性曲线和上述曲线相同 |
(1)已知:2NO(g)+O2(g)
 2NO2(g)△H=-113.0kJ·mol-1
2NO2(g)△H=-113.0kJ·mol-12SO2(g)+O2(g)
 2SO3(g)△H=-196.6kJ·mol-1
2SO3(g)△H=-196.6kJ·mol-1写出SO2与NO2反应生成SO3和NO的热化学反应方程式
(2)汽车尾气的净化装置中发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g)△H<0。在密闭容器中充入10molCO和8molNO,发生上述反应,如图为平衡时NO的体积分数与温度,压强的关系。
N2(g)+2CO2(g)△H<0。在密闭容器中充入10molCO和8molNO,发生上述反应,如图为平衡时NO的体积分数与温度,压强的关系。
①该反应达到平衡后,为在提高反应速率同时提高NO的转化率,可采取的措施有
a.升高温度 b.增加CO的浓度 c.缩小容器的体积 d.改用高效催化剂
②压强为10MPa、温度为T1下,若反应进行到10min达到平衡状态,容器的体积为2L;用CO2的浓度变化表示的平均反应速率v(CO2)=
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图所示,则N极应连接电源的




