名校
解题方法
1 . 甲醇制烯烃(MTO)是煤制烯烃工艺路线的核心技术。煤制烯烃主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的液化发生的主要反应之一为
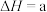 kJ⋅mol
kJ⋅mol ,在不同温度下,K(500°C)
,在不同温度下,K(500°C)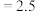 (mol⋅L
(mol⋅L ),K(700°C)
),K(700°C)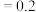 (mol⋅L
(mol⋅L )
)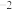 。
。
①
___________ 0(填“>”、“<”、“=”)。
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内 、CO、
、CO、 物质的量分别为2 mol、1 mol、3 mol,则此时生成
物质的量分别为2 mol、1 mol、3 mol,则此时生成 的速率
的速率___________ 消耗 的速率(填“>”、“<”、“=”)。
的速率(填“>”、“<”、“=”)。
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
Ⅰ.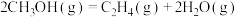
 kJ⋅mol
kJ⋅mol
Ⅱ.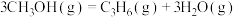
 kJ⋅mol
kJ⋅mol
Ⅲ.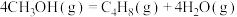
 kJ⋅mol
kJ⋅mol
① 转化为
转化为 的热化学方程式为Ⅳ:
的热化学方程式为Ⅳ: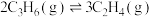
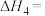
___________ 。
②加入 作为稀释剂,反应Ⅰ中
作为稀释剂,反应Ⅰ中 的产率将
的产率将___________ (填“增大”、“减小”或“不变”)。
(3)为研究不同条件对反应的影响,测得不同温度下平衡时 、
、 和
和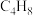 的物质的量分数变化,如图所示:
的物质的量分数变化,如图所示:
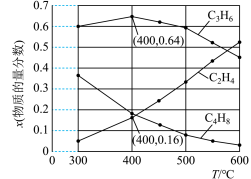
①随着温度的升高, 的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是___________ 。
②体系总压为0.1 MPa,400℃时反应Ⅳ的平衡常数
___________ 。
(1)煤的液化发生的主要反应之一为

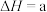 kJ⋅mol
kJ⋅mol ,在不同温度下,K(500°C)
,在不同温度下,K(500°C)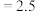 (mol⋅L
(mol⋅L ),K(700°C)
),K(700°C)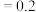 (mol⋅L
(mol⋅L )
)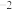 。
。①

②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内
 、CO、
、CO、 物质的量分别为2 mol、1 mol、3 mol,则此时生成
物质的量分别为2 mol、1 mol、3 mol,则此时生成 的速率
的速率 的速率(填“>”、“<”、“=”)。
的速率(填“>”、“<”、“=”)。(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
Ⅰ.
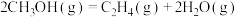
 kJ⋅mol
kJ⋅mol
Ⅱ.
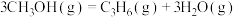
 kJ⋅mol
kJ⋅mol
Ⅲ.
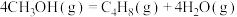
 kJ⋅mol
kJ⋅mol
①
 转化为
转化为 的热化学方程式为Ⅳ:
的热化学方程式为Ⅳ: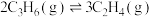
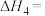
②加入
 作为稀释剂,反应Ⅰ中
作为稀释剂,反应Ⅰ中 的产率将
的产率将(3)为研究不同条件对反应的影响,测得不同温度下平衡时
 、
、 和
和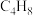 的物质的量分数变化,如图所示:
的物质的量分数变化,如图所示:
①随着温度的升高,
 的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是②体系总压为0.1 MPa,400℃时反应Ⅳ的平衡常数

您最近一年使用:0次
名校
解题方法
2 . 甲醇是重要的工业原料。
(1)已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
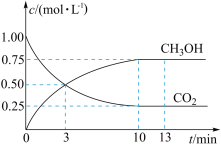
①T℃时,计算该反应的平衡常数为_______ (结果保留3位有效数字)。
②若保持温度和容器体积不变,13min时,向容器中充入1molCO2(g)和1molH2O(g),此时,该反应的v正_______ v逆(填“>”、“<”或=)。
③已知下列物质总键能(1mol物质所含化学键的键能之和)的数据如表,由此可计算表中a=_______ 。
(2)已知:(Ⅰ)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
(Ⅱ)CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ•mol-1
CO(g)+H2O(g) △H2=+41.1kJ•mol-1
(Ⅲ)2H2(g)+CO(g) CH3OH(g) △H3
CH3OH(g) △H3
①△H3=_______ kJ/mol。
②在一定温度下,已知反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为K1、K2、K3,则K3=________ (用K1、K2表示)。
(1)已知CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
①T℃时,计算该反应的平衡常数为
②若保持温度和容器体积不变,13min时,向容器中充入1molCO2(g)和1molH2O(g),此时,该反应的v正
③已知下列物质总键能(1mol物质所含化学键的键能之和)的数据如表,由此可计算表中a=
| 物质 | CO2 | H2 | CH3OH | H2O |
| 总键能/kJ•mol | 1620 | a | 2047 | 930 |
 CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1(Ⅱ)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1kJ•mol-1
CO(g)+H2O(g) △H2=+41.1kJ•mol-1(Ⅲ)2H2(g)+CO(g)
 CH3OH(g) △H3
CH3OH(g) △H3①△H3=
②在一定温度下,已知反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为K1、K2、K3,则K3=
您最近一年使用:0次
名校
解题方法
3 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
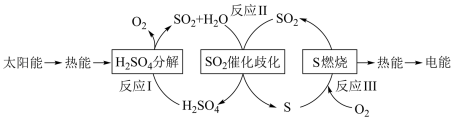
(1)反应I: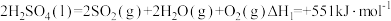
反应Ⅲ: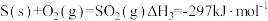
①反应I在_______ (填“高温”“低温”“任何温度”)条件下易自发进行。
②反应Ⅱ的热化学方程式:_______ 。
(2) 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
i.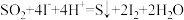
ⅱ.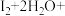
_______ 
_______ +_______ 
(3)探究(2)中i、ii反应速率与 歧化反应速率的关系,实验如下:分别将
歧化反应速率的关系,实验如下:分别将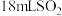 饱和溶液加入到
饱和溶液加入到 下列试剂中,密闭放置观察现象。(已知:
下列试剂中,密闭放置观察现象。(已知: 易溶解在
易溶解在 溶液中)
溶液中)
①B是A的对比实验,则
_______ 。
②比较A、B、C,可得出的结论是_______ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因_______ 。

(1)反应I:
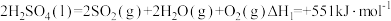
反应Ⅲ:
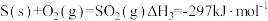
①反应I在
②反应Ⅱ的热化学方程式:
(2)
 可以作为水溶液中
可以作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。i.
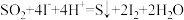
ⅱ.
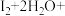


(3)探究(2)中i、ii反应速率与
 歧化反应速率的关系,实验如下:分别将
歧化反应速率的关系,实验如下:分别将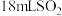 饱和溶液加入到
饱和溶液加入到 下列试剂中,密闭放置观察现象。(已知:
下列试剂中,密闭放置观察现象。(已知: 易溶解在
易溶解在 溶液中)
溶液中)| A | B | C | D | |
| 试剂组成 | 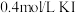 | 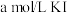 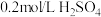 | 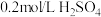 | 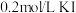 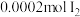 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色变成黄色,出现浑浊较A快 |

②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因
您最近一年使用:0次
名校
解题方法
4 . 下列叙述不正确的是
| A.物质发生化学变化一定会伴有能量的变化 |
| B.可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关 |
| C.水蒸气变为液态水时放出的能量就是该变化的反应热 |
| D.同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的ΔH相同 |
您最近一年使用:0次
名校
5 . 如图是煤的综合利用过程中化工产业链的一部分。
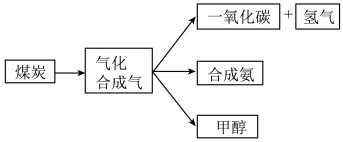
依题意回答下列问题:
(1)煤的气化发生的主要反应是:C(s)+H2O(g)=CO(g)+H2(g)
①已知:C(s)+O2(g)=CO2(g) ΔH= ̶393.0kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH= ̶242.0kJ·mol-1
O2(g)=H2O(g) ΔH= ̶242.0kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH= ̶283.0kJ·mol-1
O2(g)=CO2(g) ΔH= ̶283.0kJ·mol-1
煤气化时发生主要反应的热化学方程式是:C(s)+H2O(g)=CO(g)+H2(g) ∆H=_______ kJ·mol-1
②298K时,0.5mol液态CH3OH完全燃烧生成二氧化碳和液态水,放出362.8kJ的热量。写出表示CH3OH摩尔燃烧焓的热化学方程式:_______ 。
(2)在一密闭容器中发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH= ̶92.4kJ·mol-1达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
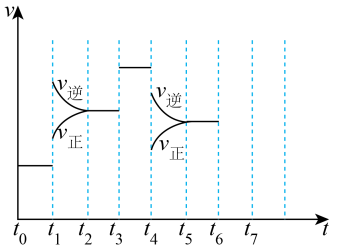
①判断t1、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻_______ ; t4时刻_______ 。
②依据①中的结论,下列时间段中,氨的百分含量最高的是_______ 。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)某温度时合成甲醇的反应:CO(g)+2H2(g)⇌CH3OH(g) ΔH= ̶ 90.8 kJ·mol-1,在容积固定的密闭容器中,各物质的浓度如下表所示:
①前2min的反应速率υ(H2) = _______ 。
②该温度下的平衡常数为_______ (可用分数表示)。

依题意回答下列问题:
(1)煤的气化发生的主要反应是:C(s)+H2O(g)=CO(g)+H2(g)
①已知:C(s)+O2(g)=CO2(g) ΔH= ̶393.0kJ·mol-1
H2(g)+
 O2(g)=H2O(g) ΔH= ̶242.0kJ·mol-1
O2(g)=H2O(g) ΔH= ̶242.0kJ·mol-1CO(g)+
 O2(g)=CO2(g) ΔH= ̶283.0kJ·mol-1
O2(g)=CO2(g) ΔH= ̶283.0kJ·mol-1煤气化时发生主要反应的热化学方程式是:C(s)+H2O(g)=CO(g)+H2(g) ∆H=
②298K时,0.5mol液态CH3OH完全燃烧生成二氧化碳和液态水,放出362.8kJ的热量。写出表示CH3OH摩尔燃烧焓的热化学方程式:
(2)在一密闭容器中发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH= ̶92.4kJ·mol-1达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。

①判断t1、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻
②依据①中的结论,下列时间段中,氨的百分含量最高的是
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)某温度时合成甲醇的反应:CO(g)+2H2(g)⇌CH3OH(g) ΔH= ̶ 90.8 kJ·mol-1,在容积固定的密闭容器中,各物质的浓度如下表所示:
浓度 时间 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 |
| 0 | 1.0 | 1.8 | 0 |
| 2min | 0.5 | c | 0.5 |
| 4min | 0.4 | 0.6 | 0.6 |
| 6min | 0.4 | 0.6 | 0.6 |
②该温度下的平衡常数为
您最近一年使用:0次
名校
解题方法
6 . 下列有关能量的判断和表示方法正确的是
| A.由C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1,可知:石墨比金刚石更稳定 |
| B.等质量的C2H5OH(g)和C2H5OH(l)分别完全燃烧,后者放出的热量更多 |
| C.由H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ·mol-1,可知:含1mol HCl的溶液与含1mol NH3•H2O的溶液混合,放出热量等于57.3kJ |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1; 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
您最近一年使用:0次
解题方法
7 . 填空。
(1)23gC2H6O(l)和一定量的氧气混合点燃,恰好完全反应,生成CO2(g)和H2O(l),放出683.5kJ的热量。写出该反应的热化学方程式___________ 。
(2)白磷与氧气可发生如下反应: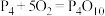 。已知断裂下列化学键需要吸收的能量分别为:
。已知断裂下列化学键需要吸收的能量分别为: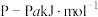 、
、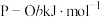 、
、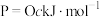 、
、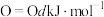 。
。
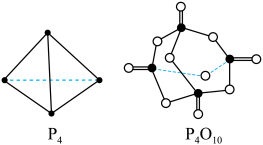
根据图中的分子结构和有关数据估算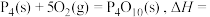
___________ 
(3)在1200℃时,天然气脱硫工艺中会发生下列反应
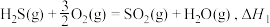
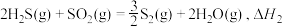
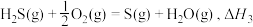
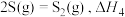
则
___________ (用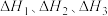 表示)
表示)
(4)合成氨反应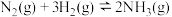 过程中的能量变化如图所示。回答下列问题:
过程中的能量变化如图所示。回答下列问题:
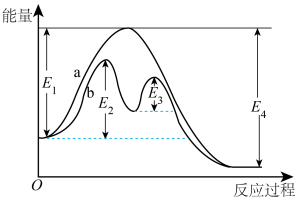
该反应的
___________  (用
(用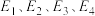 表示,
表示,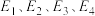 均>0)。反应达到平衡时,升高温度,N2的转化率
均>0)。反应达到平衡时,升高温度,N2的转化率___________ 。该反应过程___________ (填“a”或“b”)有催化剂参与。反应达到平衡时,加入催化剂,N2的转化率___________ 。
(1)23gC2H6O(l)和一定量的氧气混合点燃,恰好完全反应,生成CO2(g)和H2O(l),放出683.5kJ的热量。写出该反应的热化学方程式
(2)白磷与氧气可发生如下反应:
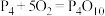 。已知断裂下列化学键需要吸收的能量分别为:
。已知断裂下列化学键需要吸收的能量分别为: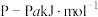 、
、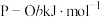 、
、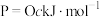 、
、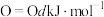 。
。
根据图中的分子结构和有关数据估算
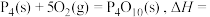

(3)在1200℃时,天然气脱硫工艺中会发生下列反应
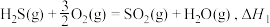
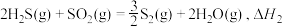
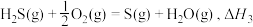
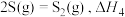
则

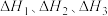 表示)
表示)(4)合成氨反应
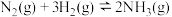 过程中的能量变化如图所示。回答下列问题:
过程中的能量变化如图所示。回答下列问题:
该反应的

 (用
(用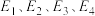 表示,
表示,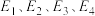 均>0)。反应达到平衡时,升高温度,N2的转化率
均>0)。反应达到平衡时,升高温度,N2的转化率
您最近一年使用:0次
8 . 下图是飞船和空间站中利用Sabatier反应再生氧气的大体流程。
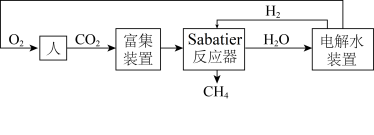
(1)已知:2H2(g)+O2(g) 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
则Sabatier反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=___________ 。
(2)二氧化碳的富集装置如图所示。
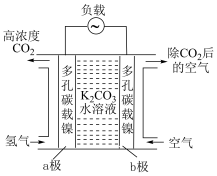
①该富集法采用___________ 原理(填“原电池”或“电解池”)。当a极上消耗1molH2,并保持电解液溶质不变时,b极上除去的CO2在标准状况下的体积为___________ 。
②工作一段时间后,K2CO3溶液的pH___________ (填“变大”“变小”或“不变”)。
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是___________ 。
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是___________ 。
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=___________ (用P0表示)。已知Kp是以分压表示的平衡常数,分压=总压×物质的量分数。
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为___________ (填化学式)。

(1)已知:2H2(g)+O2(g)
 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1CH4(g)+2O2(g)
 CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1则Sabatier反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=(2)二氧化碳的富集装置如图所示。

①该富集法采用
②工作一段时间后,K2CO3溶液的pH
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为
| 离子种类 | H+ | OH- |  SO SO | Cl- |  CO CO | K+ | Na+ |
| 摩尔电导率×104(S·m2·mol-1) | 349.82 | 198.0 | 79.8 | 76.34 | 72.0 | 73.52 | 50.11 |
您最近一年使用:0次
解题方法
9 . 甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
已知:①CO(g)+1/2O2(g)=CO2(g) H1
H1
②H2(g)+1/2O2(g)=H2O(g) ΔH2
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3
回答下列问题:
(1)CO(g)+2H2(g) CH3OH(g)的平衡常数K表达式
CH3OH(g)的平衡常数K表达式___________ ,该反应的反应热ΔH4=__________ (用ΔH1、ΔH2、ΔH3)。
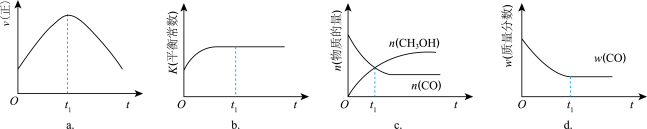
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是___________ (填选项字母,单选)。
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=___________ ,T1℃时,CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=___________ 。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:___________ 。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________ 。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___________ 。
 CH3OH(g)。
CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g)
 H1
H1 ②H2(g)+1/2O2(g)=H2O(g) ΔH2
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3
回答下列问题:
(1)CO(g)+2H2(g)
 CH3OH(g)的平衡常数K表达式
CH3OH(g)的平衡常数K表达式(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g)
 CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:
您最近一年使用:0次
名校
解题方法
10 . 已知下列反应:O2(g)+C(s) CO2(g) K1;2C(s)+O2(g)
CO2(g) K1;2C(s)+O2(g) 2CO(g) K2; 则反应2CO(g)+O2(g)
2CO(g) K2; 则反应2CO(g)+O2(g) 2CO2(g)的平衡常数为
2CO2(g)的平衡常数为
 CO2(g) K1;2C(s)+O2(g)
CO2(g) K1;2C(s)+O2(g) 2CO(g) K2; 则反应2CO(g)+O2(g)
2CO(g) K2; 则反应2CO(g)+O2(g) 2CO2(g)的平衡常数为
2CO2(g)的平衡常数为A.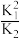 | B.2K1-K2 | C.K12×K2 | D.2K1+K2 |
您最近一年使用:0次
2023-10-05更新
|
298次组卷
|
17卷引用:福建省龙岩市六县一中2021-2022学年高二上学期期中联考化学试题
福建省龙岩市六县一中2021-2022学年高二上学期期中联考化学试题福建省武平县第一中学2021-2022学年高二上学期期中考试化学试题福建省长汀县第一中学2022-2023学年高二上学期第一次月考化学试题福建省永春华侨中学2022-2023学年高二上学期期中考试化学试题重庆市2021-2022学年高二上学期期中考试化学试题贵州省黔西南州2021~2022学年高二上学期期中考试化学试题云南省昆明市第一中学2021-2022学年高二下学期期中考试化学试题辽宁省葫芦岛市协作校2021-2022学年高二上学期第二次考试化学试题浙江省金华市江南中学2021-2022学年高二上学期期中考试化学试题四川省邻水实验学校2021-2022学年高二上学期期中考试化学试题陕西省渭南市尚德中学2021-2022学年高二上学期第二次质量检测化学试题广东省深圳市龙华中学2021-2022学年高二上学期第二次考试化学试题云南省保山市高(完)中C、D类学校2022-2023学年高二上学期10月份联考化学试题四川省南充高级中学2023-2024学年高二上学期10月月考化学试题云南省昆明市第一中学2023-2024学年高二上学期期中化学试题陕西省延安市延川县中学2023-2024学年高二上学期第一次月考化学试题云南省文山州广南县第十中学校2023-2024学年高二上学期10月月考化学试题



