解题方法
1 . 氮氧化物对环境及人类活动影响日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
已知:N2 (g)+O2(g)=2NO(g) ΔH₁=+182.4kJ·mol-1

4NH3 (g)+4NO(g)+O2 (g)=4N2 (g)+6H2O(l) ΔH3
(1)ΔH₃=___________ 。
(2)某研究小组将2molNH₃、3molNO和一定量的O₂充入2L密闭容器中,在催化剂表面发生反应,NO的转化率随温度变化的情况如图所示。在5min内,温度从420K升高到580K,此时段内v(NO)=___________ 。

Ⅱ.NO还可用CO还原:2NO(g)+2CO(g)═N₂(g)+2CO2 (g),在密闭容器中充入5molCO和4molNO,平衡时NO的体积分数与温度、压强的关系如图所示,已知温度T1>T2。
(3)该反应是___________ 反应。(填“放热”或“吸热”)
(4)若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的___________ 点。

Ⅲ.在实验室中,产生的NO可用O₂氧化,再用NaOH溶液吸收。将2molNO(g)、lmolO2 (g)和lmolHe(g)通入反应器,在温度T、压强ρ条件下进行反应2NO(g)+O2 (g)═2NO2 (g)和2NO2 (g)═N2O4 (g)。
(5)平衡时,若O2、NO2与N2O4三者的物质的量相等,则NO转化率为___________ ,反应2NO(g)+O2 (g)═2NO2 (g)平衡常数Kₚ=___________ (用含ρ的代数式表示)。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
已知:N2 (g)+O2(g)=2NO(g) ΔH₁=+182.4kJ·mol-1

4NH3 (g)+4NO(g)+O2 (g)=4N2 (g)+6H2O(l) ΔH3
(1)ΔH₃=
(2)某研究小组将2molNH₃、3molNO和一定量的O₂充入2L密闭容器中,在催化剂表面发生反应,NO的转化率随温度变化的情况如图所示。在5min内,温度从420K升高到580K,此时段内v(NO)=

Ⅱ.NO还可用CO还原:2NO(g)+2CO(g)═N₂(g)+2CO2 (g),在密闭容器中充入5molCO和4molNO,平衡时NO的体积分数与温度、压强的关系如图所示,已知温度T1>T2。
(3)该反应是
(4)若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的

Ⅲ.在实验室中,产生的NO可用O₂氧化,再用NaOH溶液吸收。将2molNO(g)、lmolO2 (g)和lmolHe(g)通入反应器,在温度T、压强ρ条件下进行反应2NO(g)+O2 (g)═2NO2 (g)和2NO2 (g)═N2O4 (g)。
(5)平衡时,若O2、NO2与N2O4三者的物质的量相等,则NO转化率为
您最近一年使用:0次
解题方法
2 . 一定温度下,向2L恒容密闭容器中加入2molMoS2、4molH2及4molNa2CO3,发生反应: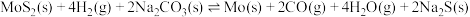 ,10min时达到平衡,测得气体的起始压强与平衡压强之比为4∶5。下列说法正确的是
,10min时达到平衡,测得气体的起始压强与平衡压强之比为4∶5。下列说法正确的是
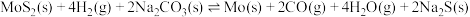 ,10min时达到平衡,测得气体的起始压强与平衡压强之比为4∶5。下列说法正确的是
,10min时达到平衡,测得气体的起始压强与平衡压强之比为4∶5。下列说法正确的是A.该反应的平衡常数表达式为 |
B.0~10min内,用CO表示的平均反应速率 |
| C.增加MoS2的物质的量,可以提高H2的平衡转化率 |
| D.10min时,向容器中再加入2molH2O(g)、2molH2(g)及1molCO(g),平衡逆向移动 |
您最近一年使用:0次
3 . “碳达峰、碳中和”是我国社:会发展瓜大战略之一,“㨏中和”可通过以下方法实现。
Ⅰ.用 和
和 合成甲醇:
合成甲醇: 。
。
(1)一定温度下,向 恒容密闭容器中通入
恒容密闭容器中通入 和
和 的混合气体,
的混合气体, 时,
时, 的质量减少了
的质量减少了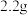 ,则
,则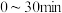 内,
内,
_______ ,此时 的转化率为
的转化率为_______ 。
(2)在恒温恒容密闭容器中进行该反应,下列能说明该反应达到平衡状态的是_______ (填字母)。
a.混合气体的密度不变
b.混合气体的平均摩尔质量不变
c.
d.断开 ,同时生成
,同时生成
Ⅱ. 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
①
②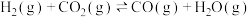
(3)反应①一般认为通过如下两个步骤来实现,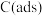 为吸附活性炭。
为吸附活性炭。

反应①的反应历程的能量变化图正确的是_______ (填字母)。

Ⅲ.用电化学方法将 转化为
转化为 实现再利用,转化的基本原理如图所示。
实现再利用,转化的基本原理如图所示。

(4)①M极为原电池的_______ 极(填“正”或“负”),发生_______ (填“氧化”或“还原”)反应。
②该电池外电路中电子流向为_______ (填“M→负载→N”或“N→负载→M”)。N极的电极反应式为_______ 。
Ⅰ.用
 和
和 合成甲醇:
合成甲醇: 。
。(1)一定温度下,向
 恒容密闭容器中通入
恒容密闭容器中通入 和
和 的混合气体,
的混合气体, 时,
时, 的质量减少了
的质量减少了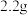 ,则
,则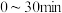 内,
内,
 的转化率为
的转化率为(2)在恒温恒容密闭容器中进行该反应,下列能说明该反应达到平衡状态的是
a.混合气体的密度不变
b.混合气体的平均摩尔质量不变
c.

d.断开
 ,同时生成
,同时生成
Ⅱ.
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:①

②
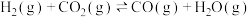
(3)反应①一般认为通过如下两个步骤来实现,
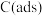 为吸附活性炭。
为吸附活性炭。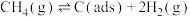

反应①的反应历程的能量变化图正确的是

Ⅲ.用电化学方法将
 转化为
转化为 实现再利用,转化的基本原理如图所示。
实现再利用,转化的基本原理如图所示。
(4)①M极为原电池的
②该电池外电路中电子流向为
您最近一年使用:0次
解题方法
4 . 恒温恒容条件下发生反应: ,反应进行到不同时间测得各物质的浓度如图所示,下列说法正确的是
,反应进行到不同时间测得各物质的浓度如图所示,下列说法正确的是
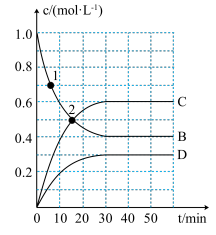
 ,反应进行到不同时间测得各物质的浓度如图所示,下列说法正确的是
,反应进行到不同时间测得各物质的浓度如图所示,下列说法正确的是
A.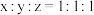 |
| B.点1:v(正)>v(逆),点2:v(正)=v(逆) |
C. 时,v(D)=0.01mol·L-1·min-1 时,v(D)=0.01mol·L-1·min-1 |
| D.当气体密度不变时,反应达到平衡 |
您最近一年使用:0次
5 . 用酸性高锰酸钾溶液与草酸 溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是
溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是

 溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是
溶液反应来探究浓度和温度对反应速率的影响(假设溶液体积可以加和),设计的实验方案和得到的速率图像如下,下列说法错误的是| 实验编号 | 室温下,试管中所加试剂及其用量/ | 实验温度/ | 溶液颜色褪至无色所需时间/ | |||
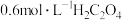 溶液 溶液 |  |  溶液 溶液 | 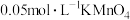 溶液 溶液 | |||
| Ⅰ |  | 2.0 | 2.0 | 3.0 | 20 | 1.4 |
| Ⅱ | 2.0 |  | 2.0 | 3.0 |  | 2.6 |
| Ⅲ | 2.0 | 3.0 | 2.0 | 3.0 | 45 | 1.0 |

A.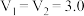 |
| B.实验Ⅰ、Ⅱ的目的是探究浓度对速率的影响 |
C. 后反应速率逐渐减小的原因是浓度变化对速率的影响为主要因素 后反应速率逐渐减小的原因是浓度变化对速率的影响为主要因素 |
D.实验Ⅲ中,从反应开始至 溶液褪至无色时间段内, 溶液褪至无色时间段内,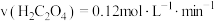 |
您最近一年使用:0次
名校
解题方法
6 . 将2molX和2molY充入2L密闭容器中进行反应: ,2min末该反应达到平衡时生成0.8molZ,测得Q的浓度为
,2min末该反应达到平衡时生成0.8molZ,测得Q的浓度为 ,下列叙述错误的是
,下列叙述错误的是
 ,2min末该反应达到平衡时生成0.8molZ,测得Q的浓度为
,2min末该反应达到平衡时生成0.8molZ,测得Q的浓度为 ,下列叙述错误的是
,下列叙述错误的是| A.a的值为2 |
B.平衡时X的浓度为0.8 |
| C.平衡时Y的物质的量为0.8mol |
D.0~2min内Y的反应速率为0.6 |
您最近一年使用:0次
2023-06-23更新
|
189次组卷
|
3卷引用:河南省平顶山市第一高级中学2022-2023学年高一下学期6月阶段测试化学试题
名校
解题方法
7 . 氮的化合物被广泛应用于工业、航天、医药等领域。请回答下列问题:
(1)氨气可作为脱硝剂。在恒温恒容的密闭容器中充入一定量的NO和 ,在一定条件下发生反应:
,在一定条件下发生反应: 。该反应达到平衡状态的标志是___________(填序号)。
。该反应达到平衡状态的标志是___________(填序号)。
(2)一定条件下,在5L密闭容器内,发生反应: ,
, 的物质的量随时间变化的情况如表:
的物质的量随时间变化的情况如表:
①0~2s内用 表示的该反应的平均反应速率为
表示的该反应的平均反应速率为___________  ;5s时,
;5s时, 的转化率为
的转化率为___________ 。
②为加快反应速率,可以采取的措施是___________ (填序号)。
a.恒容时充入He(g)
b.恒压时充入He(g)
c.恒容时充入 (g)
(g)
(3)已知: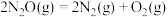 。不同温度
。不同温度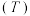 下,
下, 分解半衰期随起始压强的变化情况如图所示(图中半衰期指任一浓度
分解半衰期随起始压强的变化情况如图所示(图中半衰期指任一浓度 减小一半时所需的时间),则
减小一半时所需的时间),则
___________ (填“>”“=”或“<”)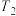 。若温度为
。若温度为 、起始压强为
、起始压强为 ,则反应至
,则反应至 时,体系压强
时,体系压强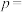
___________ kPa(用 表示)。
表示)。

(1)氨气可作为脱硝剂。在恒温恒容的密闭容器中充入一定量的NO和
 ,在一定条件下发生反应:
,在一定条件下发生反应: 。该反应达到平衡状态的标志是___________(填序号)。
。该反应达到平衡状态的标志是___________(填序号)。A.反应速率 |
| B.容器内压强不再变化 |
C.容器内 |
D.12molN—H键断裂的同时生成5molN N键 N键 |
 ,
, 的物质的量随时间变化的情况如表:
的物质的量随时间变化的情况如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
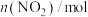 | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
 表示的该反应的平均反应速率为
表示的该反应的平均反应速率为 ;5s时,
;5s时, 的转化率为
的转化率为②为加快反应速率,可以采取的措施是
a.恒容时充入He(g)
b.恒压时充入He(g)
c.恒容时充入
 (g)
(g)(3)已知:
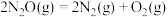 。不同温度
。不同温度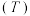 下,
下, 分解半衰期随起始压强的变化情况如图所示(图中半衰期指任一浓度
分解半衰期随起始压强的变化情况如图所示(图中半衰期指任一浓度 减小一半时所需的时间),则
减小一半时所需的时间),则
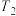 。若温度为
。若温度为 、起始压强为
、起始压强为 ,则反应至
,则反应至 时,体系压强
时,体系压强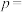
 表示)。
表示)。
您最近一年使用:0次
2023-06-13更新
|
78次组卷
|
2卷引用:河南省平顶山市鲁山县第一高级中学2022-2023学年高一下学期6月月考化学试题
8 . 煤的气化和液化是工业上获得清洁能源的重要手段。
I.煤的气化的重要反应为
 。
。
(1)下列叙述能说明上述反应达到平衡状态的是___________(填序号)。
II.煤的液化主要产品是甲醇等,甲醇是一种重要的基础化工原料,工业上可通过多种途径合成甲醇。
(2)二氧化碳和氢气在一定条件下也可合成甲醇:
 。将
。将 和
和 充入1L恒容密闭容器中,在一定条件下合成甲醇,测得
充入1L恒容密闭容器中,在一定条件下合成甲醇,测得 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示:

①
___________ 0(填“>”或“<”)。
②1150K下,若2min时反应达到平衡,则0~2min内,
___________  。
。
③已知c点时容器内的压强为p,则在1150K下该反应的压强平衡常数
___________ ( 是用气体的分压替代浓度计算的平衡常数,气体分压=总压
是用气体的分压替代浓度计算的平衡常数,气体分压=总压 物质的量分数)。
物质的量分数)。
I.煤的气化的重要反应为

 。
。(1)下列叙述能说明上述反应达到平衡状态的是___________(填序号)。
A.单位时间内生成 的同时生成 的同时生成 |
B.混合气体中组分的质量百分含量: |
C.反应速率 |
| D.在恒温恒容密闭容器中,混合气体的密度不变 |
II.煤的液化主要产品是甲醇等,甲醇是一种重要的基础化工原料,工业上可通过多种途径合成甲醇。
(2)二氧化碳和氢气在一定条件下也可合成甲醇:

 。将
。将 和
和 充入1L恒容密闭容器中,在一定条件下合成甲醇,测得
充入1L恒容密闭容器中,在一定条件下合成甲醇,测得 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示:
①

②1150K下,若2min时反应达到平衡,则0~2min内,

 。
。③已知c点时容器内的压强为p,则在1150K下该反应的压强平衡常数

 是用气体的分压替代浓度计算的平衡常数,气体分压=总压
是用气体的分压替代浓度计算的平衡常数,气体分压=总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
解题方法
9 . 图像更能直接地体现化学反应伴随的现象,如能量、速率、浓度等物理量的变化。下列说法错误的是


A.由图①可知,  , ,  ,则 ,则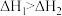 |
B.图②表示不同温度下,c(X)随时间t的变化,则正反应的 ,M点正反应速率 ,M点正反应速率 点逆反应速率 点逆反应速率 |
C.图③所示反应的热化学方程式为  |
D.图④中t时刻改变的条件可能是增大 的浓度,同时减小 的浓度,同时减小 的浓度 的浓度 |
您最近一年使用:0次
10 . 一定温度下,向2.0L恒容密闭容器中充入 ,发生反应:
,发生反应: 。反应中测得的部分数据见下表:
。反应中测得的部分数据见下表:
下列说法错误的是
 ,发生反应:
,发生反应: 。反应中测得的部分数据见下表:
。反应中测得的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
 | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A.0s时,正反应速率最大,逆反应速率为0 |
B.0~50s内,用 表示的平均反应速率 表示的平均反应速率 |
C.250s时,反应已达到平衡, 的平衡转化率为20% 的平衡转化率为20% |
D.当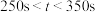 时,反应处于停止状态 时,反应处于停止状态 |
您最近一年使用:0次



