 气体和
气体和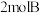 气体在
气体在 的密闭容器中混合并在一定条件下发生如下反应:
的密闭容器中混合并在一定条件下发生如下反应: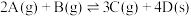 ,若经
,若经 后测得
后测得 的浓度为
的浓度为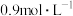 ,则下列几种说法中正确的是
,则下列几种说法中正确的是①
 末物质
末物质 的物质的量为
的物质的量为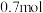
②用物质
 表示的平均反应速率为
表示的平均反应速率为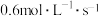
③
 时,物质
时,物质 的转化率为
的转化率为
④用
 来表示反应速率,其速率之比为2:1:3
来表示反应速率,其速率之比为2:1:3| A.①③④ | B.①②③④ |
| C.②④ | D.③④ |
2 . “碳一化学”是指以碳单质或分子中含一个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。回答下列问题:
(1)我国用铜基催化剂,由CO2加氢制甲醇已工业化,部分反应历程如图所示(带*微粒为催化剂表面的吸附物种,氢原子没有全部标出),由CO2*→CH2O*+OH*过程的焓变△H=△H1+△H2+

(2)
 催化重整技术制合成气是研究热点之一,具有广阔的市场前景、经济效应和社会意义,发生的主要反应如下:
催化重整技术制合成气是研究热点之一,具有广阔的市场前景、经济效应和社会意义,发生的主要反应如下:主反应:
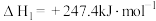
副反应:
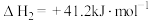
一定温度下,向某2L恒容密闭容器中充入2molCO2和1molCH4,使起始压强为 ,30s后上述主、副反应达到平衡,此时测得CO的物质的量为1.7mol,H2O的物质的量为0.1mol。
,30s后上述主、副反应达到平衡,此时测得CO的物质的量为1.7mol,H2O的物质的量为0.1mol。
①平衡时的总压强为 的代数式表示)。
的代数式表示)。
②在0~30s内,用CO2表示的平均反应速率
 。
。
③该温度下,副反应的压强平衡常数
(3)一定条件下,水气变换反应:
 的中间产物是HCOOH。温度为T0℃时,在密封石英管内充满0.1mol·L-1HCOOH水溶液,HCOOH(aq)的分解反应如下(分解产物均完全溶于水):
的中间产物是HCOOH。温度为T0℃时,在密封石英管内充满0.1mol·L-1HCOOH水溶液,HCOOH(aq)的分解反应如下(分解产物均完全溶于水):i.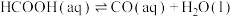
 (快反应);
(快反应);
ⅱ.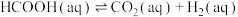
 (慢反应)。
(慢反应)。
研究发现,H+仅对反应i有催化加速作用,反应i速率远大于反应ⅱ,故近似认为反应i建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
①部分物质浓度与反应时间的变化关系如图所示,试推测CO的浓度随反应时间的变化趋势是
A.增大 B.减小 C.先增大后减小 D.先减小后增大

②t1min后,c(HCOOH)/c(CO)的值
I.已知:
 ①
①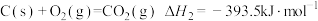 ②
② ③
③(1)某反应的平衡常数表达式为
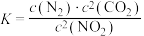 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:II.往恒容密闭容器中通入一定量
 ,发生反应
,发生反应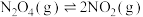 ,随温度升高,气体颜色变深。
,随温度升高,气体颜色变深。(2)图甲为该反应平衡时有关物理量
 随某条件X(其他条件不变)变化的关系图。X,
随某条件X(其他条件不变)变化的关系图。X, 可以分别表示___________(填字母)。
可以分别表示___________(填字母)。
A.温度 ,逆反应速率 ,逆反应速率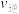 | B.温度 ,混合气体的密度 ,混合气体的密度 |
C.反应物浓度 ,平衡常数 ,平衡常数 | D.反应物浓度 , , 转化率 转化率 |
(3)图乙为
 时,体系中各物质的物质的量浓度随时间变化关系图。
时,体系中各物质的物质的量浓度随时间变化关系图。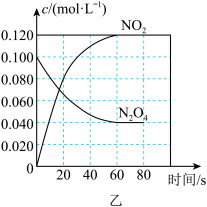
①在
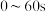 时段,反应速率
时段,反应速率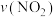 为
为 。
。②
 后,改变反应温度为
后,改变反应温度为 ,
, 以
以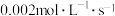 的平均速率降低,经
的平均速率降低,经 后又达到平衡。则
后又达到平衡。则
 合成甲醇,反应方程式为:
合成甲醇,反应方程式为:
 。在
。在 时,体积为2L的恒容容器中充入物质的量之和为3mol的
时,体积为2L的恒容容器中充入物质的量之和为3mol的 和CO,达到平衡时
和CO,达到平衡时 的体积分数(V%)与
的体积分数(V%)与 的关系如图所示。
的关系如图所示。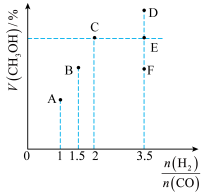
(1)当起始
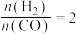 ,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率
(2)B点的平衡常数为
(3)当起始
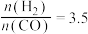 时,达到平衡状态后,
时,达到平衡状态后, 的体积分数可能是图像中的
的体积分数可能是图像中的(4)由下图可知:
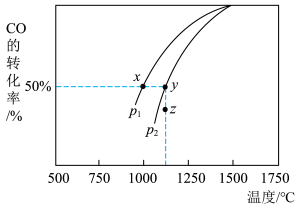
①该反应的

②相同起始量达到x、y时,容器内气体密度
 。
。③当压强为
 时,在z点:
时,在z点:
 。
。
 )是重要的有机化工中间体,可用于合成维生素。通过
)是重要的有机化工中间体,可用于合成维生素。通过 和
和 合成
合成 的主要反应为:
的主要反应为:Ⅰ.

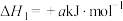
Ⅱ.
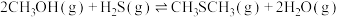
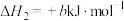
回答下列问题:
(1)计算反应
 的ΔH=
的ΔH= 。
。(2)
 时,向恒容密闭容器中充入一定量
时,向恒容密闭容器中充入一定量 和
和 发生反应,下列事实能说明反应达到平衡状态的是
发生反应,下列事实能说明反应达到平衡状态的是 和
和 ,
, 的平衡转化率将
的平衡转化率将A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C.
 的体积分数不再发生变化 D.
的体积分数不再发生变化 D. 和
和 的物质的量之比不再变化
的物质的量之比不再变化(3)
 时,按物质的量之比为1︰2向压强为
时,按物质的量之比为1︰2向压强为 的恒压密闭容器中充入
的恒压密闭容器中充入 和
和 发生反应,达到平衡时,
发生反应,达到平衡时, 的转化率为80%,
的转化率为80%, 的体积分数为5%。
的体积分数为5%。①计算
 的选择性为
的选择性为 的选择性
的选择性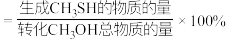 )。
)。②反应Ⅰ的平衡常数

 是用分压表示的平衡常数)。
是用分压表示的平衡常数)。(4)在
 、反应压力为0.7 Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中
、反应压力为0.7 Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中 转化率、
转化率、 选择性随温度的变化如图甲所示,催化机理如图乙所示。
选择性随温度的变化如图甲所示,催化机理如图乙所示。

 分压表示的反应速率为
分压表示的反应速率为②结合催化机理分析,当温度高于370℃时,
 转化率随温度升高而降低的原因可能为
转化率随温度升高而降低的原因可能为③从化学键的角度描述ⅲ→ⅰ脱水的过程:
 。如图所示,在恒容密闭容器中,反应温度为T1时,c(HOCH2CH2OH)和c(H2)随时间t的变化分别为曲线I和Ⅱ,反应温度为T2时,c(H2)随时间t的变化为曲线Ⅲ。下列判断正确的是
。如图所示,在恒容密闭容器中,反应温度为T1时,c(HOCH2CH2OH)和c(H2)随时间t的变化分别为曲线I和Ⅱ,反应温度为T2时,c(H2)随时间t的变化为曲线Ⅲ。下列判断正确的是
| A.ΔH>0 |
| B.a、b两时刻生成乙二醇的速率:v(a)=v(b) |
C.在T2温度下,反应在0~t2内的平均速率为 |
| D.其他条件相同,在T1温度下,起始时向该容器中充入一定量的氮气,则反应达到平衡的时间小于t1 |
 的利用技术,将
的利用技术,将 转化为能源是缓解温室效应和解决能源问题的方案之一。请回答下列问题:
转化为能源是缓解温室效应和解决能源问题的方案之一。请回答下列问题:(1)某科研小组用电化学方法将
 转化为
转化为 实现再利用,转化的基本原理如图甲所示。
实现再利用,转化的基本原理如图甲所示。
①M极发生的电极反应式为
②工作一段时间后,N电极室中的溶液

(2)由
 和
和 制备合成气(
制备合成气( 、
、 ),再由合成气制备
),再由合成气制备 的反应转化关系如图乙所示,制备合成气的反应中,若生成
的反应转化关系如图乙所示,制备合成气的反应中,若生成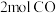 ,反应Ⅰ和Ⅱ中共转移电子的物质的量为
,反应Ⅰ和Ⅱ中共转移电子的物质的量为
(3)科学家提出以TO2为催化剂, 光热化学循环分解法,达到减少大气中CO2含量的目的,反应机理和相关数据入图丙所示,全过程的热化学方程式为

| 物质的量 | 物质 | 完全断键所需吸收的总能量 |
| 1mol |  | 1598kJ |
| 1mol |  | 1072kJ |
| 1mol |  | 496kJ |
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:反应ⅰ:
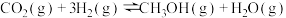
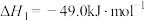
反应ⅱ:

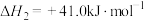
反应ⅲ:


一定温度和催化剂条件下,一定量的
 、
、 和
和 (已知
(已知 不参与反应)在总压强为
不参与反应)在总压强为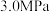 的密闭容器中进行上述反应,平衡时
的密闭容器中进行上述反应,平衡时 的转化率、
的转化率、 和
和 的选择性随温度的变化曲线如图丁所示。
的选择性随温度的变化曲线如图丁所示。
①图丁中曲线b表示物质
 ”“
”“ ”或“
”或“ ”)。
”)。②某温度下,
 反应到达平衡,测得容器中
反应到达平衡,测得容器中 的体积分数为12.5%。此时用
的体积分数为12.5%。此时用 的分压表示
的分压表示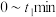 内的反应速率
内的反应速率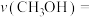
 。
。
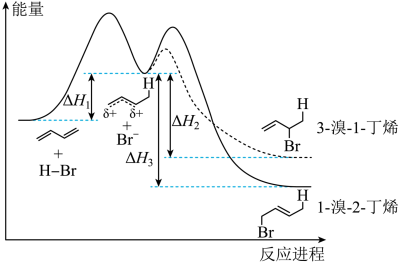
| A.反应时间越长,得到1-溴-2-丁烯的比例越大 |
B.tmin内生成1-溴-2-丁烯的平均速率为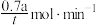 |
C.1,3-丁二烯与HBr反应生成3-溴-1-丁烯的反应热为 |
D. 与烯烃结合的第一步为决速步, 与烯烃结合的第一步为决速步, 进攻时活化能小的方向得到3-溴-1-丁烯 进攻时活化能小的方向得到3-溴-1-丁烯 |
(1)某温度下在容积为1L密闭容器中,X、Y、Z三种气态物后的物质的量随时间变化曲线如图。

①该反应的化学方程式是
②
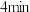 时,正反应速率
时,正反应速率(2)一定条件下,在5L密闭容器内,反应
 的物质的量随时间变化如表:
的物质的量随时间变化如表:| 时间/s |  |  |  |  |  |  |
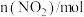 | 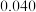 |  |  | 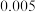 | 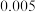 | 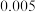 |
 表示
表示 内该反应的平均速率为
内该反应的平均速率为 ,在第5s时,NO2转化率为
,在第5s时,NO2转化率为 的体积分数为
的体积分数为②为加快反应速率,可以采取的措施是
a.升高温度b.恒容时充入He(g)
(3)反应
 ,在一定温度下
,在一定温度下 密闭容器内,在该反应已经达到平衡状态的是
密闭容器内,在该反应已经达到平衡状态的是a.
 b.容器内压强保持不变c.
b.容器内压强保持不变c.
d.容器内的密度保持不变e.容器内混合气体平均相对分子质量不变
f.
 g.容器内气体颜色不变
g.容器内气体颜色不变

| A.a点:正反应速率大于逆反应速率 |
| B.b点:净反应速率等于零,反应处于停正状态 |
C.上述可逆反应中X、Y、Z的化学计量数之比为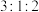 |
D.该可逆反应在该反应条件下达到最大限度时,Y的平衡转化率为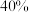 |



