名校
解题方法
1 . 在一定温度下发生反应 ,在
,在 的恒容密闭容器中把
的恒容密闭容器中把 和
和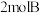 混合,
混合, 后反应达到平衡时生成
后反应达到平衡时生成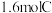 ,测得
,测得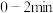 反应速率
反应速率 .则下列说法错误的是
.则下列说法错误的是
 ,在
,在 的恒容密闭容器中把
的恒容密闭容器中把 和
和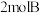 混合,
混合, 后反应达到平衡时生成
后反应达到平衡时生成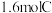 ,测得
,测得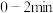 反应速率
反应速率 .则下列说法错误的是
.则下列说法错误的是A. | B.平衡时D的体积分数是25% |
C.A的平衡浓度是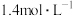 | D.B的转化率是40% |
您最近一年使用:0次
名校
解题方法
2 . 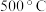 ,将
,将 和
和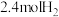 充入体积为
充入体积为 的已装有催化剂的恒容密闭容器中发生合成氨反应
的已装有催化剂的恒容密闭容器中发生合成氨反应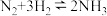 ,“此反应放热,下列说法正确的是
,“此反应放热,下列说法正确的是
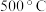 ,将
,将 和
和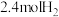 充入体积为
充入体积为 的已装有催化剂的恒容密闭容器中发生合成氨反应
的已装有催化剂的恒容密闭容器中发生合成氨反应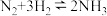 ,“此反应放热,下列说法正确的是
,“此反应放热,下列说法正确的是A.平衡时, 的浓度可能为 的浓度可能为 |
| B.容器内气体的密度不再随时间改变说明该反应已达到平衡状态 |
C.若已知生成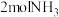 放出 放出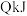 的热量,则该反应达平衡时放出的热量小于 的热量,则该反应达平衡时放出的热量小于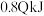 |
D.反应平衡后,向容器中充入一定体积的氨气,使容器中气体总压强增大,则 、 、 均增大 均增大 |
您最近一年使用:0次
名校
解题方法
3 . CI4分)某化学小组欲测定酸性条件下 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为
溶液反应的化学反应速率,所用试剂为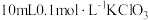 溶液和
溶液和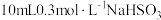 溶液,所得溶液中
溶液,所得溶液中 的浓度
的浓度 随时间变化的曲线如图1和
随时间变化的曲线如图1和 的速率
的速率 随时间的变化关系如图2:
随时间的变化关系如图2:_____ 。
 (已配平)
(已配平)
(2)根据实验数据可知,该反应在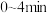 的平均反应速率
的平均反应速率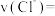
_____ 。
(3)下列说法正确的是_____
A.若纵坐标为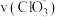 的
的 曲线与图2中的曲线不能重合
曲线与图2中的曲线不能重合
B.图中阴影部分的面积表示 时间内
时间内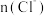 的增大
的增大
C.后期反应速率下降的主要原因是反应物浓度减少
(4)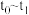 段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
已知: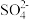 对该反应无影响;
对该反应无影响;
可供选择的试剂有:A. 固体 B.
固体 B. 固体C.
固体C. D.
D.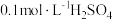 E.
E.
①方案I中所选试剂_____ ,方案Ⅱ中所选试剂_____ 。
②方案Ⅱ烧杯①中加入 水的作用是
水的作用是_____ 。
③除方案I和方案Ⅱ外,请再提出一种可能加快化学反应速率的假设_____ 。
 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为
溶液反应的化学反应速率,所用试剂为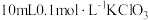 溶液和
溶液和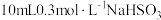 溶液,所得溶液中
溶液,所得溶液中 的浓度
的浓度 随时间变化的曲线如图1和
随时间变化的曲线如图1和 的速率
的速率 随时间的变化关系如图2:
随时间的变化关系如图2: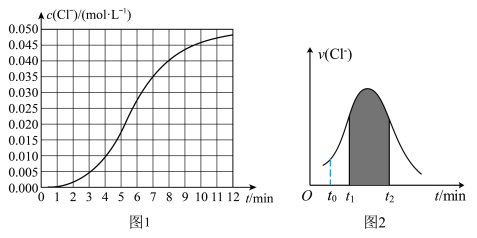
 (已配平)
(已配平)(2)根据实验数据可知,该反应在
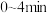 的平均反应速率
的平均反应速率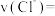
(3)下列说法正确的是
A.若纵坐标为
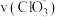 的
的 曲线与图2中的曲线不能重合
曲线与图2中的曲线不能重合B.图中阴影部分的面积表示
 时间内
时间内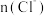 的增大
的增大C.后期反应速率下降的主要原因是反应物浓度减少
(4)
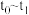 段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:已知:
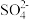 对该反应无影响;
对该反应无影响;可供选择的试剂有:A.
 固体 B.
固体 B. 固体C.
固体C. D.
D.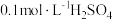 E.
E.
| 方案 | 假设 | 数据处理 | 具体实验操作 |
| I | 反应产物 对反应有催化作用,加快了化学反应速率 对反应有催化作用,加快了化学反应速率 | 取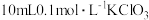 溶液于烧杯中,先加入_____(填字母),再加入 溶液于烧杯中,先加入_____(填字母),再加入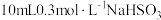 溶液。 溶液。 | 绘制溶液中 浓度 浓度 随时间变化的曲线与图1对比 随时间变化的曲线与图1对比 |
| Ⅱ | 反应中溶液酸性增强,加快了化学反应速率 | 分别向两个烧杯中加入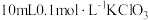 溶液。 溶液。烧杯①:加入  水: 水:烧杯②:加入  _____(填字母)。 _____(填字母)。再分别向两个烧杯中加入 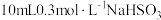 溶液。 溶液。 |
②方案Ⅱ烧杯①中加入
 水的作用是
水的作用是③除方案I和方案Ⅱ外,请再提出一种可能加快化学反应速率的假设
您最近一年使用:0次
名校
4 . 碘是国防、工业、农业、医药等部门和行业所依赖的重要原料,海水提碘是从海藻中提取元素碘的技术。
Ⅰ.海带提碘(海带中碘元素以I-形式存在)
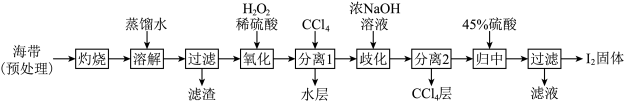
(1)“氧化”过程涉及到的离子方程式是________ ,请设计一种检验氧化后所得溶液含I2的方法:________ 。
(2)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为________ ;向分离得到的含I-和 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为________ 。
Ⅱ.获取重要的还原剂-HI
(3)H2和I2反应生成HI过程能量变化如图所示,1molH2(g)、1molHI(g)分子中化学键断裂时分别要吸收能量436kJ、299kJ,则1molI2(g)分子中化学键断裂时需吸收的能量为________ kJ。

(4)Bodensteins研究了反应: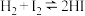 。温度为T时,在体积均为10L的密闭容器中进行实验,测得气体混合物中氢气的物质的量与反应时间t的关系如表:
。温度为T时,在体积均为10L的密闭容器中进行实验,测得气体混合物中氢气的物质的量与反应时间t的关系如表:
前40min的平均速率v(HI)=________ 。
Ⅲ.生命延续-心脏起搏器中的Li-I2电池
(5)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为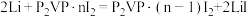 ,其工作原理如图所示:
,其工作原理如图所示:
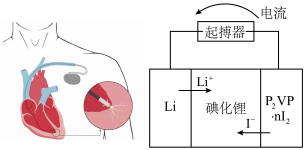
①正极发生的电极反应式为________ ;
②放电时,转移0.6×6.02×1023个电子,负极质量减少________ g。
Ⅰ.海带提碘(海带中碘元素以I-形式存在)

(1)“氧化”过程涉及到的离子方程式是
(2)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为
 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为Ⅱ.获取重要的还原剂-HI
(3)H2和I2反应生成HI过程能量变化如图所示,1molH2(g)、1molHI(g)分子中化学键断裂时分别要吸收能量436kJ、299kJ,则1molI2(g)分子中化学键断裂时需吸收的能量为

(4)Bodensteins研究了反应:
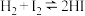 。温度为T时,在体积均为10L的密闭容器中进行实验,测得气体混合物中氢气的物质的量与反应时间t的关系如表:
。温度为T时,在体积均为10L的密闭容器中进行实验,测得气体混合物中氢气的物质的量与反应时间t的关系如表:| 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 |
| 1molH2(g)、1molI2(g) | n(H2)mol | 1 | 0.5 | 0.32 | 0.24 | 0.20 |
Ⅲ.生命延续-心脏起搏器中的Li-I2电池
(5)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为
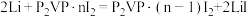 ,其工作原理如图所示:
,其工作原理如图所示:
①正极发生的电极反应式为
②放电时,转移0.6×6.02×1023个电子,负极质量减少
您最近一年使用:0次
5 . 硅元素更是无机非金属材料的主角,无机非金属材料与人类社会的发展与进步息息相关。
Ⅰ.建筑领域的基石材料-硅酸盐
(1)烧制普通玻璃的原料是________ ,使用HF溶液刻蚀玻璃的化学方程式:________ 。
(2)实验室不用带玻璃塞的试剂瓶盛装氢氧化钠溶液,写出相关原理反应的离子方程式:________ 。
(3)制备陶瓷和普通水泥都需要以黏土为原料,黏土的主要成分是铝硅酸盐,可以将其使用氧化物形式表示,例如Na2SiO3,其氧化物形式为Na2O·SiO2。某种黏土的主要成分为Na[AlSi3O8],将其表示为氧化物的形式为aNa2O·bAl2O3·cSiO2,则a:b:c=________ 。(最简整数比)
Ⅱ.现代信息的明星材料-硅
工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:________ 。
(5)为提高流化床反应器中的反应速率,可以采取的操作有:________ 。(填2个)
(6)还原炉中发生的化学反应方程式为________ 。
(7)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有________ 。
(8)已知反应 ,一定温度下,向2L恒容密闭容器中充入一定量的
,一定温度下,向2L恒容密闭容器中充入一定量的 、
、 和Si(s)发生反应,经过10min达到后,体系中H2、SiHCl3(g)的物质的量浓度分别为2mol·L-1、1mol·L-1。则,从反应开始到10min时SiCl4的平均速率为
和Si(s)发生反应,经过10min达到后,体系中H2、SiHCl3(g)的物质的量浓度分别为2mol·L-1、1mol·L-1。则,从反应开始到10min时SiCl4的平均速率为________ 。
Ⅰ.建筑领域的基石材料-硅酸盐
(1)烧制普通玻璃的原料是
(2)实验室不用带玻璃塞的试剂瓶盛装氢氧化钠溶液,写出相关原理反应的离子方程式:
(3)制备陶瓷和普通水泥都需要以黏土为原料,黏土的主要成分是铝硅酸盐,可以将其使用氧化物形式表示,例如Na2SiO3,其氧化物形式为Na2O·SiO2。某种黏土的主要成分为Na[AlSi3O8],将其表示为氧化物的形式为aNa2O·bAl2O3·cSiO2,则a:b:c=
Ⅱ.现代信息的明星材料-硅
工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

(5)为提高流化床反应器中的反应速率,可以采取的操作有:
(6)还原炉中发生的化学反应方程式为
(7)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有
(8)已知反应
 ,一定温度下,向2L恒容密闭容器中充入一定量的
,一定温度下,向2L恒容密闭容器中充入一定量的 、
、 和Si(s)发生反应,经过10min达到后,体系中H2、SiHCl3(g)的物质的量浓度分别为2mol·L-1、1mol·L-1。则,从反应开始到10min时SiCl4的平均速率为
和Si(s)发生反应,经过10min达到后,体系中H2、SiHCl3(g)的物质的量浓度分别为2mol·L-1、1mol·L-1。则,从反应开始到10min时SiCl4的平均速率为
您最近一年使用:0次
6 . 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为_______ 。
(2)反应开始至2min,气体Y的平均反应速率是_______ 。
(3)该条件下,化学平衡常数K=_______ (只书写计算式)。
(4)若升高温度,化学平衡常数K值减小,则上述反应的正反应是_____ (填“吸热”或“放热”)反应。
(5)若上述反应在2min后的, 内反应速率与反应时间关系如图所示:
内反应速率与反应时间关系如图所示:

①下列时刻各改变一种不同的外界条件分别是:
_______ ,
_______ 。
②X的转化率最高的时间段_______ (填字母)。
A. B.
B. C.
C. D.
D.

(1)该反应的化学方程式为
(2)反应开始至2min,气体Y的平均反应速率是
(3)该条件下,化学平衡常数K=
(4)若升高温度,化学平衡常数K值减小,则上述反应的正反应是
(5)若上述反应在2min后的,
 内反应速率与反应时间关系如图所示:
内反应速率与反应时间关系如图所示:
①下列时刻各改变一种不同的外界条件分别是:


②X的转化率最高的时间段
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
名校
解题方法
7 . 一定温度下,在2L的密闭容器中发生如下反应:
 ,B、C的物质的量随时间变化的关系如图1,达平衡后在
,B、C的物质的量随时间变化的关系如图1,达平衡后在 、
、 、
、 、
、 时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
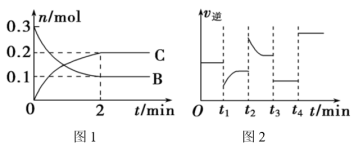
下列说法正确的是

 ,B、C的物质的量随时间变化的关系如图1,达平衡后在
,B、C的物质的量随时间变化的关系如图1,达平衡后在 、
、 、
、 、
、 时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
下列说法正确的是
A. ,反应开始至2min内, ,反应开始至2min内,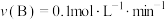 |
B. 时改变的条件是降温,平衡逆向移动 时改变的条件是降温,平衡逆向移动 |
C. 时改变的条件可能是减小 时改变的条件可能是减小 ,平衡正向移动 ,平衡正向移动 |
D. 时可能是减小压强,平衡不移动, 时可能是减小压强,平衡不移动, 时可能是使用催化剂, 时可能是使用催化剂,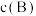 不变 不变 |
您最近一年使用:0次
名校
8 . 研究表明,用可控 界面材料也可催化
界面材料也可催化 还原合成甲醇:
还原合成甲醇: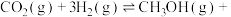

 。将6.0
。将6.0
 和8.0
和8.0
 充入体积为2L的恒温恒容密闭容器中发生该反应,测得起始压强为35
充入体积为2L的恒温恒容密闭容器中发生该反应,测得起始压强为35 ,
, 的物质的量随时间的变化如图中实线所示。下列说法正确的是
的物质的量随时间的变化如图中实线所示。下列说法正确的是

 界面材料也可催化
界面材料也可催化 还原合成甲醇:
还原合成甲醇: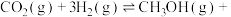

 。将6.0
。将6.0
 和8.0
和8.0
 充入体积为2L的恒温恒容密闭容器中发生该反应,测得起始压强为35
充入体积为2L的恒温恒容密闭容器中发生该反应,测得起始压强为35 ,
, 的物质的量随时间的变化如图中实线所示。下列说法正确的是
的物质的量随时间的变化如图中实线所示。下列说法正确的是
A.1~4min(实线)内, 约为 约为 |
B.该条件下的实线对应的 为0.02 为0.02 |
| C.要变成虚线,可能的条件是升高温度或加入催化剂 |
| D.当气体的平均摩尔质量或密度一定时,化学反应达平衡状态 |
您最近一年使用:0次
2024-02-01更新
|
156次组卷
|
4卷引用:河南省郑州市宇华实验学校2023-2024学年高三下学期开学化学试题
河南省郑州市宇华实验学校2023-2024学年高三下学期开学化学试题安徽省亳州市2023-2024学年高三上学期期末考试化学试题(已下线)选择题11-16(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
9 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。
I.可利用CH4与CO2制备合成气(CO、H2),在某一刚性密闭容器中CH4、CO2的分压分别为15kPa、20kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)研究表明CO的生成速率ν(CO)=1.28×10-2 p(CH4)·p(CO2) (kPa·s-1),某时刻测得p(H2)=10kPa,则该时刻v(CH4)=___________ kPa·s-1。
(2)达到平衡后,测得CO的产率为50%,则该反应的平衡常数Kp=___________ 。
(3)科学家提出制备“合成气反应历程分两步:反应①:CH4(g) C(ads) + 2H2(g) (慢反应),反应②:C(ads) + CO2(g)
C(ads) + 2H2(g) (慢反应),反应②:C(ads) + CO2(g)  2CO(g) (快反应),上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:CH4与CO2制备合成气的热化学方程式为
2CO(g) (快反应),上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:CH4与CO2制备合成气的热化学方程式为___________ ,能量变化图中:E5+E1___________ E4+E2(填“>”、“<”或“=”)。

II.利用CO2催化加氢制甲醇,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2,发生以下反应:
①CO2(g)+3H2 (g) CH3OH (g)+H2O(g) ΔH1= -49.4kJ/mol
CH3OH (g)+H2O(g) ΔH1= -49.4kJ/mol
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
③CO(g)+2H2(g) CH3OH(g) ΔH3= -90.6kJ/mol
CH3OH(g) ΔH3= -90.6kJ/mol
反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。

(4)①体系中CO2的物质的量分数受温度的影响不大,原因是___________ 。
② 如上图X、Y分别代表___________ 、___________ (填化学式)。
I.可利用CH4与CO2制备合成气(CO、H2),在某一刚性密闭容器中CH4、CO2的分压分别为15kPa、20kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。(1)研究表明CO的生成速率ν(CO)=1.28×10-2 p(CH4)·p(CO2) (kPa·s-1),某时刻测得p(H2)=10kPa,则该时刻v(CH4)=
(2)达到平衡后,测得CO的产率为50%,则该反应的平衡常数Kp=
(3)科学家提出制备“合成气反应历程分两步:反应①:CH4(g)
 C(ads) + 2H2(g) (慢反应),反应②:C(ads) + CO2(g)
C(ads) + 2H2(g) (慢反应),反应②:C(ads) + CO2(g)  2CO(g) (快反应),上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:CH4与CO2制备合成气的热化学方程式为
2CO(g) (快反应),上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:CH4与CO2制备合成气的热化学方程式为
II.利用CO2催化加氢制甲醇,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2,发生以下反应:
①CO2(g)+3H2 (g)
 CH3OH (g)+H2O(g) ΔH1= -49.4kJ/mol
CH3OH (g)+H2O(g) ΔH1= -49.4kJ/mol②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol③CO(g)+2H2(g)
 CH3OH(g) ΔH3= -90.6kJ/mol
CH3OH(g) ΔH3= -90.6kJ/mol反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。

(4)①体系中CO2的物质的量分数受温度的影响不大,原因是
② 如上图X、Y分别代表
您最近一年使用:0次
2023-11-23更新
|
139次组卷
|
2卷引用:河南省郑州市实验中学2023-2024学年高三上学期期中考试化学试题
解题方法
10 . 一定温度下,向2L密闭容器中加入 ,发生反应
,发生反应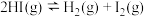 物质的量随时间的变化如图所示。
物质的量随时间的变化如图所示。

(1)0~2min内的平均反应速率
___________ ,该温度下, 的平衡常数K=
的平衡常数K=___________ 。
(2)相同温度下,若开始加入 的物质的量是原来的2倍,则
的物质的量是原来的2倍,则___________ 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时 的体积分数
的体积分数
(3)在 反应中,正反应速率为
反应中,正反应速率为 ,逆反应速率为
,逆反应速率为 。其中
。其中 、
、 为速率常数,则
为速率常数,则
___________ (以K和 表示)。
表示)。
(4)实验室用Zn和稀硫酸制取 ,加入少量下列试剂中的
,加入少量下列试剂中的___________ ,产生 的速率将增大。
的速率将增大。
a. b.
b. c.
c. d.
d.
(5)氢气用于工业合成氨;
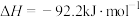 ,一定温度下,在容积恒定的密闭容器中,一定量的
,一定温度下,在容积恒定的密闭容器中,一定量的 和
和 反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。

其中 时刻所对应的实验条件改变是
时刻所对应的实验条件改变是___________ ,平衡常数最大的时间段是___________ 。
 ,发生反应
,发生反应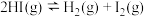 物质的量随时间的变化如图所示。
物质的量随时间的变化如图所示。
(1)0~2min内的平均反应速率

 的平衡常数K=
的平衡常数K=(2)相同温度下,若开始加入
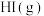 的物质的量是原来的2倍,则
的物质的量是原来的2倍,则a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时
 的体积分数
的体积分数(3)在
 反应中,正反应速率为
反应中,正反应速率为 ,逆反应速率为
,逆反应速率为 。其中
。其中 、
、 为速率常数,则
为速率常数,则
 表示)。
表示)。(4)实验室用Zn和稀硫酸制取
 ,加入少量下列试剂中的
,加入少量下列试剂中的 的速率将增大。
的速率将增大。a.
 b.
b. c.
c. d.
d.
(5)氢气用于工业合成氨;

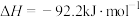 ,一定温度下,在容积恒定的密闭容器中,一定量的
,一定温度下,在容积恒定的密闭容器中,一定量的 和
和 反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示。
其中
 时刻所对应的实验条件改变是
时刻所对应的实验条件改变是
您最近一年使用:0次



