名校
1 . 氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①“焙烧”时发生的主要反应的化学方程式为MnCO3+2 NH4Cl MnCl2+2NH3↑+CO2↑+H2O
MnCl2+2NH3↑+CO2↑+H2O
②菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
③相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
④常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。回答下列问题:
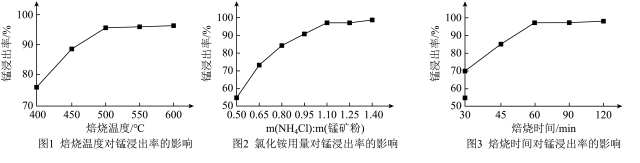
(1)分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:___________ 。
(2)浸出液“净化除杂”过程如下:①加入MnO2。用离子方程式表示MnO2的作用___________ ;
②调节溶液的pH,除去Fe3+、Al3+。溶液恰当的pH范围为___________ ;
③加入NH4F将Ca2+、Mg2+除去,两种沉淀共存时溶液中c(Ca2+)=1×10-5mol·L-1,则c(Mg2+)=___________ 。
(3)碳化结晶过程中发生反应的离子方程式为______________________ 。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,可以得到重要的无机功能材料MnO2,该电极的电极反应式为______________________ 。
(5)25℃时,向0 .1mol/L NH3·H2O溶液中通入HCl气体,溶液中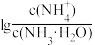 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________ 。

A.C点的溶液中:c(NH3·H2O)>c(NH4+)
B.NH3·H2O的Kb=1.0×10-4.7
C.pOH=3的溶液中:c(NH4+)+c(H+) +c(NH3·H2O)=0.1mol/L+c(OH-)
D.pOH=7的溶液中的溶质是NH4Cl

已知:①“焙烧”时发生的主要反应的化学方程式为MnCO3+2 NH4Cl
 MnCl2+2NH3↑+CO2↑+H2O
MnCl2+2NH3↑+CO2↑+H2O②菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
③相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
④常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。回答下列问题:
(1)分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:

(2)浸出液“净化除杂”过程如下:①加入MnO2。用离子方程式表示MnO2的作用
②调节溶液的pH,除去Fe3+、Al3+。溶液恰当的pH范围为
③加入NH4F将Ca2+、Mg2+除去,两种沉淀共存时溶液中c(Ca2+)=1×10-5mol·L-1,则c(Mg2+)=
(3)碳化结晶过程中发生反应的离子方程式为
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,可以得到重要的无机功能材料MnO2,该电极的电极反应式为
(5)25℃时,向0 .1mol/L NH3·H2O溶液中通入HCl气体,溶液中
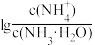 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是
A.C点的溶液中:c(NH3·H2O)>c(NH4+)
B.NH3·H2O的Kb=1.0×10-4.7
C.pOH=3的溶液中:c(NH4+)+c(H+) +c(NH3·H2O)=0.1mol/L+c(OH-)
D.pOH=7的溶液中的溶质是NH4Cl
您最近一年使用:0次
名校
2 . 常温下,钠盐(Na2XO3)溶液中微粒浓度的变化关系如图所示[pOH=-lgc(OH-)]。下列说法正确的是


A.曲线N表示 与pOH的变化关系 与pOH的变化关系 |
| B.常温下,Ka2(H2XO3)=10-10 |
C.当pOH=2时, NaHXO3溶液中: |
| D.向Na2XO3溶液中滴加稀盐酸至中性时,溶液中:c(Na+)=2c(HXO3-)+2c(XO32-) |
您最近一年使用:0次
2019-02-17更新
|
872次组卷
|
4卷引用:【全国百强校】湖南省长沙市长郡中学2019届高三上学期第一次适应性考试(一模)理科综合化学试题
3 . “绿水青山就是金山银山”。研究含氮和含硫化合物的性质在工业生产和环境保护中有重要意义。
(1)制备硫酸可以有如下两种途径:
2SO2(g)+O2(g)=2SO3(g)ΔH=-198 kJ· mol-1
SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=-41.8 kJ· mol-1
若CO的标准燃烧热为 283 kJ· mol-1,则1 mol NO2和1 mol CO反应生成CO2和NO的能量变化示意图中E2=________ kJ· mol-1。

(2)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,用NaOH溶液吸收SO2。当溶液中HSO3-、SO32-离子浓度相等时,溶液的pH约为_______________ 。
(3)连二亚硫酸钠(Na2S2O4)具有强还原性,废水处理时可在弱酸性条件下加入亚硫酸氢钠电解产生连二亚硫酸根,进而将废水中的HNO2还原成无害气体排放,连二亚硫酸根氧化为原料循环电解。产生连二亚硫酸根的电极反应式为________________ ,连二亚硫酸根与HNO2(HNO2的电离常数为Ka=5.1×10-4)反应的离子方程式为________________________________ 。
(4)锅炉烟道气含CO、SO2,可通过如下反应回收硫:2CO(g)+SO2(g) S(l)+2CO2(g)。某温度下在2 L恒容密闭容器中通入2 mol SO2和一定量的CO发生反应,5 min后达到平衡,生成1 mol CO2。
S(l)+2CO2(g)。某温度下在2 L恒容密闭容器中通入2 mol SO2和一定量的CO发生反应,5 min后达到平衡,生成1 mol CO2。
①其他条件不变时,随着温度的升高,SO2的平衡转化率变化如图A,请解释其原因________________________________ 。(已知硫的沸点约是445°C)
②保持其他条件不变,第8分钟时,将容器体积迅速压缩至1 L,在10分钟时达到平衡,CO的物质的量变化了1 mol。请在图B中画出SO2浓度6~11分钟的变化曲线。______

(1)制备硫酸可以有如下两种途径:
2SO2(g)+O2(g)=2SO3(g)ΔH=-198 kJ· mol-1
SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=-41.8 kJ· mol-1
若CO的标准燃烧热为 283 kJ· mol-1,则1 mol NO2和1 mol CO反应生成CO2和NO的能量变化示意图中E2=

(2)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,用NaOH溶液吸收SO2。当溶液中HSO3-、SO32-离子浓度相等时,溶液的pH约为
(3)连二亚硫酸钠(Na2S2O4)具有强还原性,废水处理时可在弱酸性条件下加入亚硫酸氢钠电解产生连二亚硫酸根,进而将废水中的HNO2还原成无害气体排放,连二亚硫酸根氧化为原料循环电解。产生连二亚硫酸根的电极反应式为
(4)锅炉烟道气含CO、SO2,可通过如下反应回收硫:2CO(g)+SO2(g)
 S(l)+2CO2(g)。某温度下在2 L恒容密闭容器中通入2 mol SO2和一定量的CO发生反应,5 min后达到平衡,生成1 mol CO2。
S(l)+2CO2(g)。某温度下在2 L恒容密闭容器中通入2 mol SO2和一定量的CO发生反应,5 min后达到平衡,生成1 mol CO2。①其他条件不变时,随着温度的升高,SO2的平衡转化率变化如图A,请解释其原因
②保持其他条件不变,第8分钟时,将容器体积迅速压缩至1 L,在10分钟时达到平衡,CO的物质的量变化了1 mol。请在图B中画出SO2浓度6~11分钟的变化曲线。

您最近一年使用:0次
名校
4 . 20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )
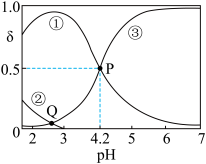

| A.①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线 |
| B.20℃时,H2C2O4的二级电离平衡常数Ka2=1×10-4.2 |
| C.Q点对应溶液中lgc(H+)<lgc(OH-) |
| D.0.100mol·L-1的NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4) |
您最近一年使用:0次
2019-06-02更新
|
968次组卷
|
8卷引用:湖北省十堰市2018届高三元月调研考试理综化学试题
名校
5 . 已知K、Ka、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合所得溶液中,c(NH4+)=c(Cl-)则溶液显__________ (填"酸""碱"或"中")性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=__________ ;
(2)25℃,H2SO3 HSO3-+H+,其电离平衡常数Ka=1×10-2 mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=
HSO3-+H+,其电离平衡常数Ka=1×10-2 mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=__________ ;
(3)高炉炼铁中发生的反应有:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH<0
Fe(s)+CO2(g) ΔH<0
①该反应的平衡常数表达式K=__________ ;
②已知1100℃时,K=0.25,则平衡时CO的转化率为__________ ;
③在该温度下,若测得高炉中c(CO2)=0.020mol/L,c(CO)=0.1 mol/L,则此时反应速率v正__________ (填">""<"或"=")v逆
(1)25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合所得溶液中,c(NH4+)=c(Cl-)则溶液显
(2)25℃,H2SO3
 HSO3-+H+,其电离平衡常数Ka=1×10-2 mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=
HSO3-+H+,其电离平衡常数Ka=1×10-2 mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=(3)高炉炼铁中发生的反应有:FeO(s)+CO(g)
 Fe(s)+CO2(g) ΔH<0
Fe(s)+CO2(g) ΔH<0①该反应的平衡常数表达式K=
②已知1100℃时,K=0.25,则平衡时CO的转化率为
③在该温度下,若测得高炉中c(CO2)=0.020mol/L,c(CO)=0.1 mol/L,则此时反应速率v正
您最近一年使用:0次
名校
6 . 分别调节0.01mol·L-1HCOOH溶液、0.01mol·L-1氨水的pH,系统中微粒浓度的负对数值(-lgc)与pH的关系分别如下图所

下列说法错误 的是

下列说法
A.25℃时, 的lgK=-4.7 的lgK=-4.7 |
| B.25℃时,0.01mol·L-1HCOOH溶液的pH为3.7 |
| C.HCOONa溶液中加入NH4Cl至溶液呈中性:c(Cl-)>c(Na+)>c(HCOO-) |
D.HCOONa溶液中加入KHSO3至溶液呈中性:c(HCOOH) +c(H2SO3) = c( ) ) |
您最近一年使用:0次
2019-02-13更新
|
461次组卷
|
3卷引用:【市级联考】江苏省南京市、盐城市2019届高三下学期第一次模拟考试化学试题
名校
7 . (山西省晋中市2019届高三1月高考适应性考试理科综合)碲被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属其工艺流程如下:
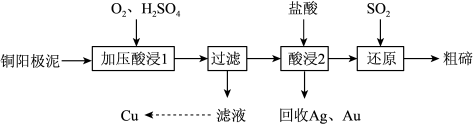
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是_________ ,其中“加压”的目的是_____ 。写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式__________ 。
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为_______ 。要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是_________ 。
(3)写出“还原”反应中发生的离子方程式__________ 。
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为____ 。
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=____ (已知:H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)

已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为
(3)写出“还原”反应中发生的离子方程式
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=
您最近一年使用:0次
名校
8 . 25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸溶液滴定10.00mL 0.1mol/L的MOH溶液,滴定过程中加入醋酸溶液的体积(V)与溶液中lg[c(H+)/c(OH-)]的关系如图所示(V=0时,lg[c(H+)c(OH-)]=-12)。下列说法不正确的是


| A.MOH是一元强碱 |
| B.a 点:V(CH3COOH)=10.00mL |
| C.b R:c(M+)>(CH3COOH)>C(H+)>c(OH-) |
| D.25℃时,CH3COO-的水解平衡常数约为5.9×10-10 |
您最近一年使用:0次
2019-02-07更新
|
736次组卷
|
4卷引用:【市级联考】山西省晋中市2019届高三上学期1月高考适应性考试理科综合化学试题
名校
解题方法
9 . 利用传感技术测定一定浓度碳酸钠溶液的 pH与温度( T)的关系, 曲线如图,下列分析错误的是


| A.碳酸钠水解是吸热反应 |
| B.ab 段说明水解平衡正向移动 |
| C.bc 段说明水解平衡逆向移动 |
| D.水的电离平衡也对 pH 产生影响 |
您最近一年使用:0次
2020-04-17更新
|
180次组卷
|
7卷引用:上海市徐汇区2015年高考二模化学试题
上海市徐汇区2015年高考二模化学试题上海市徐汇、松江、金山区2015届高三4月学习能力诊断(二模)化学试题四川省南充市高中 2020 届第二次高考适应性考试理综化学试题(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题(已下线)第3讲 盐类的水解平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)陕西省西安市长安区第一中学2021-2022学年高二下学期期中考试化学试题四川省射洪中学校2022-2023学年高二下学期3月月考化学试题
名校
10 . 常温下,向20.00mL0.1mol·L-1KOH溶液中滴加0.1 mol·L -1HA(弱酸)溶液,混合溶液中水电离出的c(OH-)与HA溶液体积之间的关系如图I所示:向20.00mL0.1 mol ·L-1 HA溶液中滴加0. 1mol ·L-1 KOH溶液,混合溶液中水电离出的c(OH-)与KOH溶液体积之间的关系如图II所示。
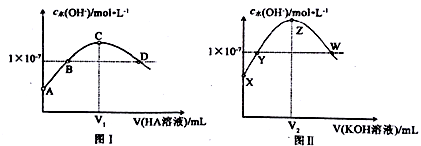
下列有关说法正确的是

下列有关说法正确的是
| A.A点、X点对应溶液中水的电离程度相同 |
| B.B点、Y点对应溶液的pH相等 |
| C.C点、Z点对应溶液中都存在:c(OH-)=c(H+)+c(HA) |
| D.D点、W点对应溶液中分别都存在:c(K+)=c(A-) |
您最近一年使用:0次
2019-01-20更新
|
1591次组卷
|
5卷引用:湖南省怀化市第三中学2022届高三下学期第三次模拟预测化学试题
湖南省怀化市第三中学2022届高三下学期第三次模拟预测化学试题【市级联考】河南省南阳市2019届高三上学期期末考试理科综合化学试题(已下线)2019年高考总复习巅峰冲刺-专题07 电解质溶液应试策略四川省宜宾市叙州区第一中学2020届高三一诊模拟理综化学试题山东省济南市历城第二中学2019-2020学年高二12月月考化学试题



