解题方法
1 . 在一恒温恒容的密闭容器中放入一定量的液体W,发生反应W(l)═P(g)+2Q(g)。下列可以作为该反应达到平衡状态的判断依据的是
| A.2v正(P)=v逆(Q) | B.Q的体积分数保持不变 |
| C.气体的平均相对分子质量保持不变 | D.c(P):c(Q)=1:2 |
您最近一年使用:0次
2 . 某温度下,在恒容密闭容器中发生反应:3A(g)+bB(g)⇌cC(g)+2D(s),12s时测得c(C)=0.4mol/L,A、B浓度变化如图所示。下列说法中正确的是

| A.b=l,c=2 |
| B.0~2s,A的平均反应速率为0.05mol•L﹣1•s﹣1 |
| C.图中两曲线相交时,反应达平衡状态 |
| D.充入He增大压强,反应速率加快 |
您最近一年使用:0次
解题方法
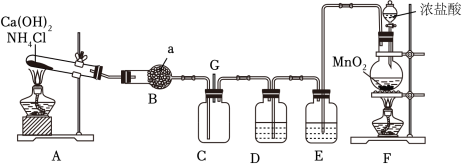
3 . 工业上常用浓氨水检验运输氯气的管道是否泄漏。某同学为验证干燥、纯净的氨气与氯气的反应,设计装置如图所示,C装置为氯气与氨气反应的装置。
(1)装置A中发生的化学反应方程式是___________ 。
(2)仪器a的名称为___________ ,装置B的作用是 ___________ 。
(3)装置F中浓盐酸发生反应时体现的性质是___________ 。若要得到标准状况下112mLCl2,需MnO2的质量为 ___________ 。
(4)为得到干燥、纯净的氯气,D、E分别应盛放的试剂是___________ 、___________ (填序号)。
①饱和NaCl溶液 ②浓NaOH溶液 ③浓硫酸 ④饱和NaHCO3溶液
(5)通入C装置的两根导管左边较长、右边较短,目的是___________ 。实验过程中观察到装置C内出现浓厚的白烟并在容器内壁凝结,经检验发现另一生成物是空气的主要成分之一。写出反应的化学方程式:___________ 。
(1)装置A中发生的化学反应方程式是
(2)仪器a的名称为
(3)装置F中浓盐酸发生反应时体现的性质是
(4)为得到干燥、纯净的氯气,D、E分别应盛放的试剂是
①饱和NaCl溶液 ②浓NaOH溶液 ③浓硫酸 ④饱和NaHCO3溶液
(5)通入C装置的两根导管左边较长、右边较短,目的是
您最近一年使用:0次
4 . 根据下列实验操作和现象所得出的结论或解释正确的是
| 选项 | 实验操作和现象 | 结论或解释 |
| A | 检验SO2气体中是否混有SO3(g):将气体通入Ba(NO3)2溶液,有白色沉淀生成 | 混有SO3(g) |
| B | 淀粉﹣KI溶液中通入少量Cl2,再通入SO2,溶液先出现蓝色,后蓝色褪去 | 还原性:SO2>I﹣>Cl﹣ |
| C | 用蘸有浓氨水的玻璃棒靠近某有色气体X,出现白烟 | 该气体只能是HCl |
| D | 用大理石和盐酸反应制取CO2气体,将气体立即通入一定浓度的Na2SiO3溶液中,出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 下列描述及相应的化学方程式或离子方程式正确的是
| A.FeS与浓硫酸反应制取H2S:FeS+H2SO4(浓)=FeSO4+H2S↑ |
B.Cu与浓硝酸制NO:3Cu+8H++2 =3Cu2++2NO↑+4H2 =3Cu2++2NO↑+4H2 |
C.石英砂与焦炭制粗硅:SiO2+C Si+CO2↑ Si+CO2↑ |
D.用饱和NaHSO3溶液除去SO2中的HCl: +H+=H2O+SO2↑ +H+=H2O+SO2↑ |
您最近一年使用:0次
名校
6 . 下列有关比较错误的是
A.酸性: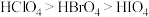 | B.硬度: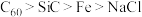 |
C.键长: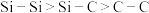 | D.熔、沸点:金刚石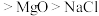 |
您最近一年使用:0次
7 . 下列物质分离或提纯所采用的方法最合适的是
| A.用蒸馏法分离甲醇和乙醇 | B.用蒸馏法分离苯和水 |
| C.用酒精萃取碘水中的单质碘 | D.用过滤法分离 和 和 |
您最近一年使用:0次
解题方法
8 . 元素化合价和物质类别是认识物质的两个重要维度,如图是氮元素的“价一类二维图”。
(1)Y的化学式为___________ , 的用途有
的用途有___________ (任写一种)。
(2)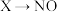 的化学方程式为
的化学方程式为___________ 。
(3)检验 中阳离子的实验操作和现象为
中阳离子的实验操作和现象为___________ 。
(4)向 浓度分别为
浓度分别为 和
和 的
的 和
和 的混合酸中加入过量的铜屑,待反应结束后,可产生标准状况下的
的混合酸中加入过量的铜屑,待反应结束后,可产生标准状况下的
___________  (反应中气体只生成
(反应中气体只生成 )。
)。
(5)汽车尾气中会产生大量的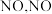 生成过程中的能量变化如图所示:
生成过程中的能量变化如图所示: 和
和 完全反应生成
完全反应生成 ,会
,会___________ (填“吸收”或“放出”)___________  能量。
能量。
②利用催化剂可将汽车尾气中的 和
和 转化为两种无毒气体,化学方程式为
转化为两种无毒气体,化学方程式为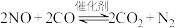 。向一恒容密闭容器中充入
。向一恒容密闭容器中充入 和
和 。下列可以表明上述反应已达到平衡状态的是
。下列可以表明上述反应已达到平衡状态的是___________ (填字母)。
A.容器中的气体压强保持不变
B. 的浓度不再改变
的浓度不再改变
C.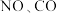 的浓度之比为
的浓度之比为
D.相同时间内,若反应消耗 同时生成
同时生成
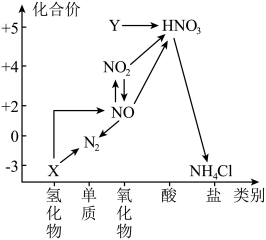
(1)Y的化学式为
 的用途有
的用途有(2)
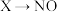 的化学方程式为
的化学方程式为(3)检验
 中阳离子的实验操作和现象为
中阳离子的实验操作和现象为(4)向
 浓度分别为
浓度分别为 和
和 的
的 和
和 的混合酸中加入过量的铜屑,待反应结束后,可产生标准状况下的
的混合酸中加入过量的铜屑,待反应结束后,可产生标准状况下的
 (反应中气体只生成
(反应中气体只生成 )。
)。(5)汽车尾气中会产生大量的
 生成过程中的能量变化如图所示:
生成过程中的能量变化如图所示: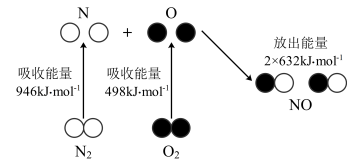
 和
和 完全反应生成
完全反应生成 ,会
,会 能量。
能量。②利用催化剂可将汽车尾气中的
 和
和 转化为两种无毒气体,化学方程式为
转化为两种无毒气体,化学方程式为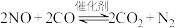 。向一恒容密闭容器中充入
。向一恒容密闭容器中充入 和
和 。下列可以表明上述反应已达到平衡状态的是
。下列可以表明上述反应已达到平衡状态的是A.容器中的气体压强保持不变
B.
 的浓度不再改变
的浓度不再改变C.
 的浓度之比为
的浓度之比为
D.相同时间内,若反应消耗
 同时生成
同时生成
您最近一年使用:0次
解题方法
9 . 乙酸正丁酯是优良的有机溶剂,在石油加工、制药工程等领域均有广泛应用。在实验室中,乙酸正丁酯可通过正丁醇和冰醋酸在强酸催化及加热条件下合成,实验装置如图所示。反应中生成的水可以与正丁醇或乙酸正丁酯形成共沸混合物被蒸出。使用分水器可在反应进行的同时分离出生成的水,并使有机相流回反应瓶中。实验步骤如下:
②关闭分水器旋塞,并在分水器带旋塞的一侧预先加入适量的水,再向反应装置中依次加入5mL(55mmol)正丁醇、3.4mL(60mmol)冰醋酸和0.05mL浓硫酸,加入一粒沸石。
③将反应液温度控制在T1℃并保持15分钟,然后升温至回流状态。当___________,停止加热。将分水器中的液体导入分液漏斗中,将水层分出。
④依次用5mL水、5mL10%碳酸钠溶液、5mL水洗涤有机层。
⑤有机层用无水硫酸镁干燥。常压蒸馏,在T2℃时收集馏分。
已知各化合物及相关共沸物在常压下的沸点如下表所示:
回答下列问题:
(1)仪器A的名称为___________ ;仪器B中进水口为___________ (填“a”或“b”)。
(2)正丁醇的密度为___________ g·cm-3。
(3)步骤③中停止加热的标志是___________ 。
(4)T1和T2的范围分别是___________ (填标号)。
a.T1>90℃,T2>120℃ b.T1>90℃,T2<12℃
c.T1<90℃,T2>120℃ d.T1<90℃,T2<120℃
(5)冰醋酸略过量的原因是___________ ,若最终得到产品的质量为5.12g,测得纯度为98%,则反应的产率为___________ (结果保留一位小数)。
(6)步骤③中,有一处操作明显错误使得产率降低,正确做法是___________ 。
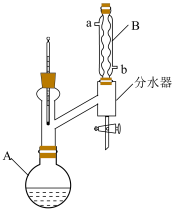
②关闭分水器旋塞,并在分水器带旋塞的一侧预先加入适量的水,再向反应装置中依次加入5mL(55mmol)正丁醇、3.4mL(60mmol)冰醋酸和0.05mL浓硫酸,加入一粒沸石。
③将反应液温度控制在T1℃并保持15分钟,然后升温至回流状态。当___________,停止加热。将分水器中的液体导入分液漏斗中,将水层分出。
④依次用5mL水、5mL10%碳酸钠溶液、5mL水洗涤有机层。
⑤有机层用无水硫酸镁干燥。常压蒸馏,在T2℃时收集馏分。
已知各化合物及相关共沸物在常压下的沸点如下表所示:
| 化合物 | 乙酸 | 正丁醇 | 乙酸丁酯醋 |
| 沸点 | 117.9℃ | 117.3℃ | 126.6℃ |
| 共沸物 | 正丁醇—水 | 乙酸正丁酯—水 | 乙酸正丁酯—正丁醇—水 |
| 沸点 | 92.7℃ | 90.7℃ | 90.7℃ |
(1)仪器A的名称为
(2)正丁醇的密度为
(3)步骤③中停止加热的标志是
(4)T1和T2的范围分别是
a.T1>90℃,T2>120℃ b.T1>90℃,T2<12℃
c.T1<90℃,T2>120℃ d.T1<90℃,T2<120℃
(5)冰醋酸略过量的原因是
(6)步骤③中,有一处操作明显错误使得产率降低,正确做法是
您最近一年使用:0次
解题方法
10 . 锂离子电池是新能源重要组成部分,废旧锂电池的回收利用意义重大。某研究小组对废弃的锂电池正极材料LiCoO2进行氯化处理以回收Li、Co等金属,工艺流程如下:
(1)已知Co的原子序数为27,则其在元素周期表中的位置是___________ 。
(2)已知“烧渣”是LiCl、CoCl2和SiO2的混合物,则“500℃焙烧”反应生成的氧化产物与还原产物的物质的量之比为___________ ;滤饼2成分的化学式为___________ 。
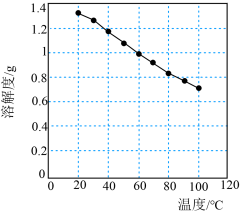
(3)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3,将温度升至90℃是为了提高沉淀反应速率和___________ 。得到碳酸锂沉淀的操作为___________ (填标号)。
b.加热后,趁热过滤
c.蒸发浓缩、冷却结晶
(4)取100mL滤液2,其中c(Li+)=0.10mol·L-1,为使锂元素的回收率不低于80%,则至少应加入Na2CO3固体的物质的量为___________ mol[已知Ksp(Li2CO3)=3.6×10-4,忽略溶液体积变化]。
(5)将碳酸锂(Li2CO3)与CoCO3按n(Li):n(Co)=1:1的比例配合,然后在空气中于700℃烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为___________ 。
(6)钴的某种氧化物的晶胞结构如图所示,该立方晶胞参数为apm。___________ 。
②设阿伏加德罗常数的值为NA,则该晶胞的密度为___________ g·cm-3。

(1)已知Co的原子序数为27,则其在元素周期表中的位置是
(2)已知“烧渣”是LiCl、CoCl2和SiO2的混合物,则“500℃焙烧”反应生成的氧化产物与还原产物的物质的量之比为
(3)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3,将温度升至90℃是为了提高沉淀反应速率和
b.加热后,趁热过滤
c.蒸发浓缩、冷却结晶
(4)取100mL滤液2,其中c(Li+)=0.10mol·L-1,为使锂元素的回收率不低于80%,则至少应加入Na2CO3固体的物质的量为
(5)将碳酸锂(Li2CO3)与CoCO3按n(Li):n(Co)=1:1的比例配合,然后在空气中于700℃烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为
(6)钴的某种氧化物的晶胞结构如图所示,该立方晶胞参数为apm。
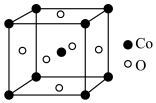
②设阿伏加德罗常数的值为NA,则该晶胞的密度为
您最近一年使用:0次



