名校
1 . 七校某化学兴趣小组发现有一瓶无色澄清透明溶液,已知其只含下列离子中的若干种,且每种离子的数目相等: 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 ,分别取100ml溶液进行以下4组实验:
,分别取100ml溶液进行以下4组实验:
①向其中加入过量盐酸,滴加过程中均无气泡和沉淀生成。
②用pH试纸检测溶液呈碱性。
③做焰色试验,发现火焰呈黄色。
④加入足量 溶液,产生白色沉淀。
溶液,产生白色沉淀。
(1)由步骤①可以判断一定不存在的离子有___________ 。
(2)由以上实验操作能够判断的阳离子一定有___________ ,根据电中性原则能否确定含有 ,
,___________ (填“能”或“否”),请设计实验检验 :
:___________ ,书写检验 的离子方程式:
的离子方程式:___________ 。
(3)取实验①的酸性溶液加入铜片,产生气泡,经测定该气体为NO,溶液变蓝,请写出该反应的离子方程式:___________ 。
(4)电荷守恒是学习化学的重要思维方法。某 、
、 混合溶液中含有
混合溶液中含有 、
、 物质的量分别为
物质的量分别为 、
、 ,求溶液中
,求溶液中 的物质的量为
的物质的量为___________ mol。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 ,分别取100ml溶液进行以下4组实验:
,分别取100ml溶液进行以下4组实验:①向其中加入过量盐酸,滴加过程中均无气泡和沉淀生成。
②用pH试纸检测溶液呈碱性。
③做焰色试验,发现火焰呈黄色。
④加入足量
 溶液,产生白色沉淀。
溶液,产生白色沉淀。(1)由步骤①可以判断一定不存在的离子有
(2)由以上实验操作能够判断的阳离子一定有
 ,
, :
: 的离子方程式:
的离子方程式:(3)取实验①的酸性溶液加入铜片,产生气泡,经测定该气体为NO,溶液变蓝,请写出该反应的离子方程式:
(4)电荷守恒是学习化学的重要思维方法。某
 、
、 混合溶液中含有
混合溶液中含有 、
、 物质的量分别为
物质的量分别为 、
、 ,求溶液中
,求溶液中 的物质的量为
的物质的量为
您最近一年使用:0次
2023-11-08更新
|
354次组卷
|
3卷引用:宁夏银川市唐徕中学2023-2024学年高一上学期期中考试化学试题
名校
2 . 向一定浓度的 溶液中滴加
溶液中滴加 溶液,其电导率随滴入溶液体积变化的曲线如图所示。下列分析正确的是
溶液,其电导率随滴入溶液体积变化的曲线如图所示。下列分析正确的是

 溶液中滴加
溶液中滴加 溶液,其电导率随滴入溶液体积变化的曲线如图所示。下列分析正确的是
溶液,其电导率随滴入溶液体积变化的曲线如图所示。下列分析正确的是
A.ab段发生反应的离子方程式是: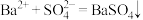 |
B.c点溶液中大量存在的离子是 、 、 |
| C.b、d两点对应溶液中的离子总数目相等 |
D.bc段发生反应的离子方程式是: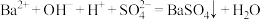 |
您最近一年使用:0次
2023-11-06更新
|
483次组卷
|
4卷引用:宁夏银川市育才中学2023-2024学年高一上学期11月期中考试化学试题
名校
3 . 二氧化氯(ClO2)具有强氧化性,是优良的饮用水消毒剂。ClO2常温下为黄绿色气体,熔点-59℃,沸点11℃,极易溶于水且不与水反应,浓的ClO2受热时易爆炸。我国广泛使用的方法是用干燥的Cl2与NaClO2固体反应制取ClO2,实验室模拟制备ClO2装置如图所示:
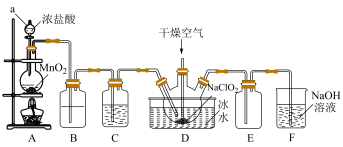
(1)仪器a的名称是:___________ ,装置A中反应的离子方程式为:___________ 。
(2)装置B中盛装的试剂是___________ ,装置C中试剂的作用是:___________ 。
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②___________ 。
(4)装置E为ClO2的收集装置,应将其置于___________ 水浴中(填“热”或“冰”)。
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:___________ 。
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若___________ (填“实验现象”),则假设1成立。

(1)仪器a的名称是:
(2)装置B中盛装的试剂是
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②
(4)装置E为ClO2的收集装置,应将其置于
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若
您最近一年使用:0次
2023-11-06更新
|
632次组卷
|
2卷引用:宁夏银川市第二中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
4 . 三硫代碳酸钠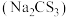 又名全硫碳酸钠,常温下是一种玫瑰红色针状固体。在农业上用作杀菌剂和杀虫剂,在工业上用于处理废水中的重金属离子和黄铁矿浮选中的捕获剂。某课外兴趣小组对
又名全硫碳酸钠,常温下是一种玫瑰红色针状固体。在农业上用作杀菌剂和杀虫剂,在工业上用于处理废水中的重金属离子和黄铁矿浮选中的捕获剂。某课外兴趣小组对 的一些性质进行了探究性实验。
的一些性质进行了探究性实验。
已知: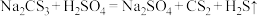
 和
和 均有毒,且
均有毒,且 不溶于水,沸点
不溶于水,沸点 ,与
,与 某些性质相似。
某些性质相似。
实验1.探究 的性质:
的性质:
(1)用离子方程式表示步骤②中溶液变红色的原因___________ 。
(2)由以上操作及现象,下列关于 说法正确的是___________。
说法正确的是___________。
实验2.测定 溶液的浓度:
溶液的浓度:
实验步骤如下:
I.取实验1中配置的 溶液
溶液 置于仪器中,打开
置于仪器中,打开 ,通入一段时间氮气;
,通入一段时间氮气;
II.关闭 ,打开分液漏斗活塞,滴入足量
,打开分液漏斗活塞,滴入足量 稀硫酸,关闭活塞;
稀硫酸,关闭活塞;
III.反应结束后,再打开 ,通入一段时间的热氮气;
,通入一段时间的热氮气;
IV.将B中沉淀进行过滤、洗涤、干燥、称量,得到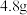 固体。
固体。
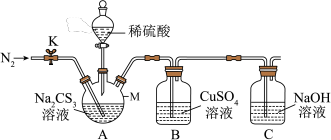
(3)仪器 的名称是
的名称是___________ ,滴入稀硫酸后,仪器 中的现象是
中的现象是___________ 。
(4)B中发生反应的离子方程式为___________ ,过滤后洗涤沉淀的操作是___________ 。
(5)反应结束后通入一段时间的热氮气的作用是___________ 。
(6)根据实验数据计算,该 溶液的物质的量浓度为
溶液的物质的量浓度为___________ 。
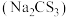 又名全硫碳酸钠,常温下是一种玫瑰红色针状固体。在农业上用作杀菌剂和杀虫剂,在工业上用于处理废水中的重金属离子和黄铁矿浮选中的捕获剂。某课外兴趣小组对
又名全硫碳酸钠,常温下是一种玫瑰红色针状固体。在农业上用作杀菌剂和杀虫剂,在工业上用于处理废水中的重金属离子和黄铁矿浮选中的捕获剂。某课外兴趣小组对 的一些性质进行了探究性实验。
的一些性质进行了探究性实验。已知:
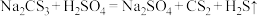
 和
和 均有毒,且
均有毒,且 不溶于水,沸点
不溶于水,沸点 ,与
,与 某些性质相似。
某些性质相似。实验1.探究
 的性质:
的性质:| 步骤 | 操作及现象 |
| ① | 取一定量 固体溶于蒸馏水,配成 固体溶于蒸馏水,配成 溶液 溶液 |
| ② | 取①中配置的溶液少许于试管中,滴加几滴酚酞溶液,溶液变成红色 |
| ③ | 取①中配置的溶液少许于另一只试管,滴加用硫酸酸化的 溶液,紫色褪去 溶液,紫色褪去 |
(1)用离子方程式表示步骤②中溶液变红色的原因
(2)由以上操作及现象,下列关于
 说法正确的是___________。
说法正确的是___________。| A.易溶于水 | B.溶液保存时用玻璃塞 | C.应密封保存 | D.有还原性 |
实验2.测定
 溶液的浓度:
溶液的浓度:实验步骤如下:
I.取实验1中配置的
 溶液
溶液 置于仪器中,打开
置于仪器中,打开 ,通入一段时间氮气;
,通入一段时间氮气;II.关闭
 ,打开分液漏斗活塞,滴入足量
,打开分液漏斗活塞,滴入足量 稀硫酸,关闭活塞;
稀硫酸,关闭活塞;III.反应结束后,再打开
 ,通入一段时间的热氮气;
,通入一段时间的热氮气;IV.将B中沉淀进行过滤、洗涤、干燥、称量,得到
 固体。
固体。
(3)仪器
 的名称是
的名称是 中的现象是
中的现象是(4)B中发生反应的离子方程式为
(5)反应结束后通入一段时间的热氮气的作用是
(6)根据实验数据计算,该
 溶液的物质的量浓度为
溶液的物质的量浓度为
您最近一年使用:0次
2023-11-06更新
|
316次组卷
|
5卷引用:宁夏石嘴山市第三中学2024届高三第一次模拟考试理综-化学试题
名校
5 . 已知反应:2NO(g)+2H2(g)  N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
下列说法中不正确的是
 N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
N2(g)+2H2O(g)生成N2的速率与NO、H2的初始浓度的关系为v=kcx(NO)•cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。| 实验数据 | 初始浓度(mol·L-1) | 生成N2的初始速率(mol·L-1·s-1) | |
| c(NO) | c(H2) | ||
| 1 | 2.00×10-3 | 6.00×10-3 | 1.92×10-3 |
| 2 | 1.00×10-3 | 6.00×10-3 | 4.80×10-4 |
| 3 | 2.00×10-3 | 3.00×10-3 | 9.60×10-4 |
| A.关系式中x=2、y=1 |
| B.800℃时,k的值为8×104 |
| C.反应体系的二种物质中,H2(g)的浓度对反应速率影响更大 |
| D.当其他条件不变时,升高温度,速率常数将增大 |
您最近一年使用:0次
名校
解题方法
6 . 相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是
A.溶液密度ρ可表示为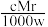 | B.物质的量浓度c可表示为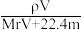 |
C.溶液的质量分数w%可表示为 | D.相对分子质量Mr可表示为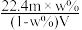 |
您最近一年使用:0次
2023-10-29更新
|
1152次组卷
|
42卷引用:宁夏贺兰县景博中学2019-2020学年高一上学期第一次月考化学试题
宁夏贺兰县景博中学2019-2020学年高一上学期第一次月考化学试题2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷(已下线)2018年9月16日《每日一题》人教必修1- 每周一测湖南省长沙市周南梅溪湖中学2018-2019学年高一下学期一模检测化学试题【全国百强校】四川省成都市石室中学2018-2019学年高一上学期10月月考化学试题广东省揭阳市惠来县第一中学2018-2019学年高一上学期期中考试化学试题辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题人教版高一化学必修1第一章—第三章综合测试题江西省南昌市新建区第一中学2019—2020学年高一上学期第一次月考化学试题鲁科版高中化学必修1第一章《认识化学科学》测试卷云南省丽江市华坪县第一中学2019—2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题河北省沧州市第一中学2019-2020学年高二4月月考化学试题(已下线)【南昌新东方】2019 雷氏学校 高一上第一次月考(已下线)考点02 物质的量与阿伏加德罗常数-2020年高考化学命题预测与模拟试题分类精编江西省南昌市八一中学2019-2020学年高一下学期开学考试(5月)化学试题浙江省诸暨中学2019-2020学年高二下学期期中考试化学试题(已下线)【南昌新东方】4.进贤一中 田荣达江西省南昌新建一中2020-2021学年高一上学期第一次月考化学试题黑龙江省齐齐哈尔市讷河市拉哈一中2020-2021学年高一上学期12月月考化学试题江西省南昌市进贤县第一中学2020-2021学年高一上学期第一次月考化学试题(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)河南省郑州市第一中学2020-2021学年高一上学期第一次月考化学试题陕西省周至县第四中学2021-2022学年高三上学期10月月考化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)陕西省西安市第一中学2021-2022学年高一上学期10月月考化学试题湖北省荆州中学2021-2022学年高一上学期期末考试化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题内蒙古鄂尔多斯市第一中学2022-2023 学年高一上学期期末考试化学试题湖北省部分重点中学2022-2023年高一上学期期末联合考试化学试题(已下线)第12讲 物质的量浓度的相关计算-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)第2讲 物质的浓度及溶液配制黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题湖南省部分学校2023-2024学年高三上学期第二次联考化学试题辽宁省东北育才学校科学高中部2023-2024学年高一上学期第一次月考化学试题山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题天津市第一中学2023-2024学年高一上学期月考(第三章单元测验1)化学试题广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
名校
解题方法
7 . 工业上用赤铁矿(含Fe2O3、FeO,也含有(Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4•7H2O的工艺流程如图:

(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为:_______ 、_______ 。
(2)向滤渣I中加入过量的试剂a名称为_______ ,加入过量试剂b后所得滤渣Ⅲ的主要成分化学式为_______ 。
(3)操作④为_______ ,过滤、洗涤、干燥;需要隔绝空气的主要原因是:_______ 。
(4)实验室常用酸性高锰酸钾溶液滴定硫酸亚铁,称取FeSO4•7H2O晶体样品3.475克,溶于稀硫酸,用0.100mol/L的酸性高锰酸钾标准溶液滴定,消耗标准液体积20.00mL,达滴定终点的现象为_______ ,绿矾样品的质量分数为_______ 。

(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为:
(2)向滤渣I中加入过量的试剂a名称为
(3)操作④为
(4)实验室常用酸性高锰酸钾溶液滴定硫酸亚铁,称取FeSO4•7H2O晶体样品3.475克,溶于稀硫酸,用0.100mol/L的酸性高锰酸钾标准溶液滴定,消耗标准液体积20.00mL,达滴定终点的现象为
您最近一年使用:0次
名校
解题方法
8 . 研究发现,以CO2和NH3为原料合成尿素的反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH分两步完成,其能量变化如图所示:
CO(NH2)2(s)+H2O(g) ΔH分两步完成,其能量变化如图所示:
第一步:2NH3(g)+CO2(g) NH2COONH4(s) ΔH1
NH2COONH4(s) ΔH1
第二步:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ΔH2
CO(NH2)2(s)+H2O(g) ΔH2
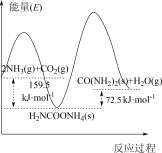
(1)合成尿素的决速反应是_____ (填“第一步”或“第二步”)反应,理由是_____ 。
(2)已知合成尿素2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH的活化能Ea(逆)为194kJ∙mol-1,该反应在
CO(NH2)2(s)+H2O(g) ΔH的活化能Ea(逆)为194kJ∙mol-1,该反应在_____ (填“高温”、“低温”或“任意温度”)下可自发进行。
(3)对于2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ∙mol-1,在T℃时,K=0.5;向1L的三个密闭容器中,按不同方式投入相应的物质,保持容器容积不变,测得反应达到平衡时的有关数据如下:
2SO3(g) ΔH=-196.6kJ∙mol-1,在T℃时,K=0.5;向1L的三个密闭容器中,按不同方式投入相应的物质,保持容器容积不变,测得反应达到平衡时的有关数据如下:
则 =
=_____ ;
_____ 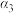 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
 CO(NH2)2(s)+H2O(g) ΔH分两步完成,其能量变化如图所示:
CO(NH2)2(s)+H2O(g) ΔH分两步完成,其能量变化如图所示:第一步:2NH3(g)+CO2(g)
 NH2COONH4(s) ΔH1
NH2COONH4(s) ΔH1第二步:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2
CO(NH2)2(s)+H2O(g) ΔH2
(1)合成尿素的决速反应是
(2)已知合成尿素2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ΔH的活化能Ea(逆)为194kJ∙mol-1,该反应在
CO(NH2)2(s)+H2O(g) ΔH的活化能Ea(逆)为194kJ∙mol-1,该反应在(3)对于2SO2(g)+O2(g)
 2SO3(g) ΔH=-196.6kJ∙mol-1,在T℃时,K=0.5;向1L的三个密闭容器中,按不同方式投入相应的物质,保持容器容积不变,测得反应达到平衡时的有关数据如下:
2SO3(g) ΔH=-196.6kJ∙mol-1,在T℃时,K=0.5;向1L的三个密闭容器中,按不同方式投入相应的物质,保持容器容积不变,测得反应达到平衡时的有关数据如下:| 容器 | A | B | C | |
| 物质投入量 | 2molSO2和1molO2 | 2molSO3 | 1.6molSO20.8molO2和0.4molSO3 | |
| 平衡时数据 | 反应能量变化的绝对值(kJ) |  |  |  |
| 反应物转化率 |  |  | 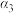 | |
 =
=
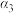 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
名校
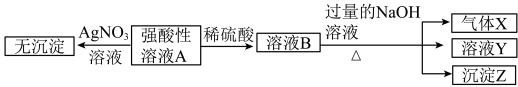
9 . 某强酸性无色溶液中可能含表中离子中的若干种离子。
实验I:取少量该强酸性溶液A进行如图实验。
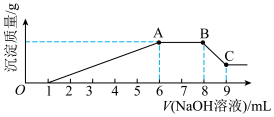
实验II:为了进一步确定该溶液的组成,取100mL原溶液A,向该溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
回答下列问题:
(1)不进行实验就可以推断出,表中的离子一定不存在的有_______ 种。
(2)气体X的电子式为_______ ,沉淀Z的化学式为_______ 。
(3)写出实验II的图示中BC段对应反应的离子方程式:_______ 。
(4)A点对应的固体质量为_______ g。
(5)通过实验I可以确定该溶液中一定存在的阴离子是_______ 。推算该溶液中阴离子的浓度为_______ mol•L-1。
| 阳离子 | Mg2+、NH 、Ba2+、Al3+、Fe2+ 、Ba2+、Al3+、Fe2+ |
| 阴离子 | SiO 、MnO 、MnO 、Cl⁻、NO 、Cl⁻、NO 、CO 、CO |

实验II:为了进一步确定该溶液的组成,取100mL原溶液A,向该溶液中滴加1mol•L-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,表中的离子一定不存在的有
(2)气体X的电子式为
(3)写出实验II的图示中BC段对应反应的离子方程式:
(4)A点对应的固体质量为
(5)通过实验I可以确定该溶液中一定存在的阴离子是
您最近一年使用:0次
名校
10 . 已知W、X、Y、Z均为短周期元素,常温下它们的最高价氧化物对应的水化物溶液(浓度均为0.01mo•L-1)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是
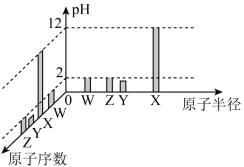

| A.X的氢化物具有还原性 |
| B.气态氢化物的热稳定性:Y>Z |
| C.简单离子半径:Z>Y>W>X |
| D.W无最高正价 |
您最近一年使用:0次
2023-10-22更新
|
494次组卷
|
2卷引用:宁夏银川市第二中学2023-2024学年高三上学期统练二化学试题



