1 . NaBiO3(铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉[主要成分是Bi2S3,含少量SiO2、Cu2S、FeS2 等杂质]为原料制备铋酸钠的流程如下:

请回答下列问题:
(1)浸渣的主要成分___________ ;Cu在周期表中的位置是第四周期,___________ 族;基态Cu+的电子排布式是___________ 。
(2)检验“酸浸”液中是否含Fe2+,可选择K3[Fe(CN)6]溶液。能证明不存在Fe2+的实验现象是___________ 。
(3)“除铁”时需调节溶液的pH为3.7,这时溶液中的Fe3+已沉淀完全。从平衡原理解释加入CuO如何除去Fe3+___________ ;从沉淀溶解平衡角度计算Fe(OH)3的溶度积常数Ksp[Fe(OH)3]=___________
(4)已知Ksp[Cu(OH)2]=2.0×10-20,Cu2+(aq)+4NH3·H2O(aq) [Cu(NH3)4]2+(aq)+4H2O(l)的平衡常数K1=2.0×1013。Cu(OH)2(s)+4 NH3·H2O(aq)
[Cu(NH3)4]2+(aq)+4H2O(l)的平衡常数K1=2.0×1013。Cu(OH)2(s)+4 NH3·H2O(aq) [Cu(NH3)4]+(ag)+2OH-(aq)+ 4H2O(l)的平衡常数K2=
[Cu(NH3)4]+(ag)+2OH-(aq)+ 4H2O(l)的平衡常数K2=___________ 。
(5)写出“氧化”步骤对应的离子方程式:___________
(6)探究NaBiO3的性质:
结合上述实验及所学知识,在酸性条件下, 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是___________ (填化学式),这些物质中元素基态原子中未成对电子数最多的是___________ (填元素名称)。

请回答下列问题:
(1)浸渣的主要成分
(2)检验“酸浸”液中是否含Fe2+,可选择K3[Fe(CN)6]溶液。能证明不存在Fe2+的实验现象是
(3)“除铁”时需调节溶液的pH为3.7,这时溶液中的Fe3+已沉淀完全。从平衡原理解释加入CuO如何除去Fe3+
(4)已知Ksp[Cu(OH)2]=2.0×10-20,Cu2+(aq)+4NH3·H2O(aq)
 [Cu(NH3)4]2+(aq)+4H2O(l)的平衡常数K1=2.0×1013。Cu(OH)2(s)+4 NH3·H2O(aq)
[Cu(NH3)4]2+(aq)+4H2O(l)的平衡常数K1=2.0×1013。Cu(OH)2(s)+4 NH3·H2O(aq) [Cu(NH3)4]+(ag)+2OH-(aq)+ 4H2O(l)的平衡常数K2=
[Cu(NH3)4]+(ag)+2OH-(aq)+ 4H2O(l)的平衡常数K2=(5)写出“氧化”步骤对应的离子方程式:
(6)探究NaBiO3的性质:
| 实验 | 操作 | 现象 |
| Ⅰ | 取少量NaBiO3粉末于试管中,加入浓盐酸,振荡;用镊子夹一块湿润的淀粉KI试纸放置在试管口上方 | 浅黄色固体溶解,产生黄绿色气体,试纸变蓝 |
| Ⅱ | 在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末,振荡 | 无色溶液变紫红色溶液 |
 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是
您最近一年使用:0次
名校
解题方法
2 . 2022年诺贝尔化学奖授子在发展点击化学方面做出贡献的科学家。点击化学的代表反应为CuCl催化的叠氮—炔基Husigen环加成反应,常用的无机试剂有 、
、 等。
等。
(1)铜在元素周期表中位置为___________ ,基态 的价电子排布式为
的价电子排布式为___________ 。
(2)N、S、O、F的第一电离能由大到小顺序为___________ 。
(3) 的分子结构如图所示,键角
的分子结构如图所示,键角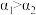 的原因主要是
的原因主要是___________ 。 是叠氮酸(
是叠氮酸( )的钠盐,
)的钠盐, 在常温下是液体,沸点相对较高,为308.8K,主要原因是
在常温下是液体,沸点相对较高,为308.8K,主要原因是___________ 。 分子的空间结构如图所示(图中键长单位为
分子的空间结构如图所示(图中键长单位为 )。
)。 、
、 和
和 的共价键键长分别为
的共价键键长分别为 、
、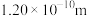 和
和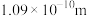 ;试画出
;试画出 分子的结构式
分子的结构式___________ 。___________ ,设 为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为
为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为___________  。
。
 、
、 等。
等。(1)铜在元素周期表中位置为
 的价电子排布式为
的价电子排布式为(2)N、S、O、F的第一电离能由大到小顺序为
(3)
 的分子结构如图所示,键角
的分子结构如图所示,键角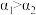 的原因主要是
的原因主要是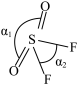
 是叠氮酸(
是叠氮酸( )的钠盐,
)的钠盐, 在常温下是液体,沸点相对较高,为308.8K,主要原因是
在常温下是液体,沸点相对较高,为308.8K,主要原因是 分子的空间结构如图所示(图中键长单位为
分子的空间结构如图所示(图中键长单位为 )。
)。 、
、 和
和 的共价键键长分别为
的共价键键长分别为 、
、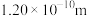 和
和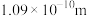 ;试画出
;试画出 分子的结构式
分子的结构式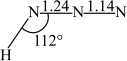
 为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为
为阿伏伽德罗常数的值,晶胞参数为apm,该晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
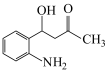
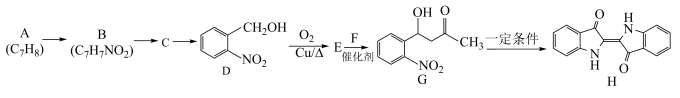
3 . 靛蓝类色素是人类所知最古老的色素之一,广泛用于食品、医药和印染工业。靛蓝(化合物H)的一种合成路线如下所示(部分反应条件或试剂略去)。___________ 。
(2)化合物J为D的同分异构体,同时满足下列条件的J的结构简式为___________ (写一种)。
①含有苯环;②含有三个不同取代基;③1molJ最多消耗3molNaOH溶液
(3)化合物E的名称为___________ 。
(4)根据化合物G的结构特征,分析预测其可能得化学性质,完成下表。
(5)下列关于靛蓝(化合物H)的说法不正确的是___________ 。
a.该物质易溶于水
b.分子中的所有碳原子的杂化方式相同
c.分子中存在由p轨道“头碰头”形成的π键
d.1 mol靛蓝与H2加成时最多可消耗9 mol H2
(6)以 和CH3COOH为原料,制备化合物M(含有两个六元环),合成路线如下:
和CH3COOH为原料,制备化合物M(含有两个六元环),合成路线如下:___________ 、___________ 。
已知: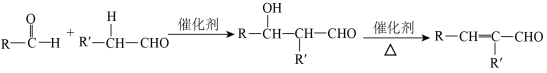
(2)化合物J为D的同分异构体,同时满足下列条件的J的结构简式为
①含有苯环;②含有三个不同取代基;③1molJ最多消耗3molNaOH溶液
(3)化合物E的名称为
(4)根据化合物G的结构特征,分析预测其可能得化学性质,完成下表。
| 序号 | 反应试剂、条件 | 反应形成的新结构 | 反应类型 |
| a | Fe/HCl |
| |
| b | 消去反应 |
(5)下列关于靛蓝(化合物H)的说法不正确的是
a.该物质易溶于水
b.分子中的所有碳原子的杂化方式相同
c.分子中存在由p轨道“头碰头”形成的π键
d.1 mol靛蓝与H2加成时最多可消耗9 mol H2
(6)以
 和CH3COOH为原料,制备化合物M(含有两个六元环),合成路线如下:
和CH3COOH为原料,制备化合物M(含有两个六元环),合成路线如下: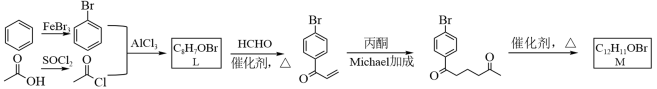
您最近一年使用:0次
2024-01-24更新
|
328次组卷
|
2卷引用:2024届宁夏石嘴山市大武口区石嘴山市第三中学高三下学期三模考试理综试题-高中化学
名校
解题方法
4 . 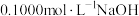 溶液滴定
溶液滴定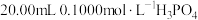 溶液时,
溶液时,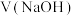 、各含磷元素微粒的
、各含磷元素微粒的 和
和 的关系如图。下列说法中正确的是
的关系如图。下列说法中正确的是
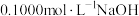 溶液滴定
溶液滴定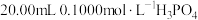 溶液时,
溶液时,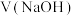 、各含磷元素微粒的
、各含磷元素微粒的 和
和 的关系如图。下列说法中正确的是
的关系如图。下列说法中正确的是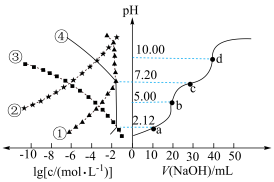
A.①为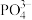 的 的 与 与 的关系 的关系 |
B.b点时,溶液中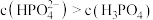 |
C. 的 的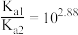 |
D.d点时,溶液中存在着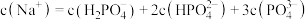 |
您最近一年使用:0次
2024-01-22更新
|
2006次组卷
|
15卷引用:宁夏石嘴山市第三中学2024届高三第一次模拟考试理综-化学试题
宁夏石嘴山市第三中学2024届高三第一次模拟考试理综-化学试题2024年1月广西普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”广西卷真题完全解读与考后提升(已下线)选择题11-14(已下线)热点18 电解质溶液图像分析重庆市第七中学校2023-2024学年高三下学期2月月考化学试题辽宁省沈阳市东北育才学校2023-2024学年高三下学期第六次模拟考试化学试卷辽宁省沈阳市东北育才学校2023-2024学年高三下学期第六次模拟考试化学试卷(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)山东省济宁市第一中学2023-2024学年高三下学期3月月考化学试题湖南省长沙市雅礼中学2023-2024学年高三下学期月考(八)化学试题湖南省雅礼中学2024届高三下学期综合自主压轴测试 (一)化学题2024届四川省绵阳市涪城区南山中学高三下学期模拟预测理综试题-高中化学湖南省湘楚名校2023-2024学年高二下学期5月月考化学试题黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期阶段考试(八)化学试题
名校
5 . 由于存在同种电解质溶液的浓度差而产生电动势的电池称为浓差电池。利用浓差电池电解硫酸钠溶液可以制得氧气、氢气、硫酸和氢氧化钠,其装置如图所示(a、b电极均为石墨电极,已知:溶液A为1L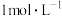
 溶液;溶液B为1L
溶液;溶液B为1L 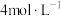
 溶液)。下列说法不正确的是
溶液)。下列说法不正确的是

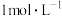
 溶液;溶液B为1L
溶液;溶液B为1L 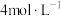
 溶液)。下列说法不正确的是
溶液)。下列说法不正确的是
A.电池放电过程中Ag(2)为正极,电极反应为 |
B.b电极为电解池阴极,电极反应式为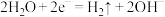 |
| C.c、d离子交换膜依次为阴离子交换膜、阳离子交换膜 |
D.电池从开始工作到停止放电,电解池理论上可制得80g  |
您最近一年使用:0次
2024-01-21更新
|
644次组卷
|
2卷引用:宁夏回族自治区石嘴山市第三中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
6 . 某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2。
2CuO+TeO2。
(1)为提高酸浸速率,可采用的措施是__________ 。
(2)煅烧时,Cr2O3发生反应的化学方程式为______ 。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有________ (写化学式)。
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。已知含铬酸性废水中存在着CrO 和Cr2O
和Cr2O 相互转化的平衡,请用离子方程式表示它们之间的转化反应
相互转化的平衡,请用离子方程式表示它们之间的转化反应________ 。
(5)测定某固体产品中Na2Cr2O7含量的方法如下:称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。
①氧化还原滴定过程中的离子方程式为_______ 。
②滴定到达终点的现象是________ 。
③若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中Na2Cr2O7的纯度为_______ %。[已知M(Na2Cr2O7)=262g·mol-1,计算结果保留三位有效数字]

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2
 2CuO+TeO2。
2CuO+TeO2。(1)为提高酸浸速率,可采用的措施是
(2)煅烧时,Cr2O3发生反应的化学方程式为
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。已知含铬酸性废水中存在着CrO
 和Cr2O
和Cr2O 相互转化的平衡,请用离子方程式表示它们之间的转化反应
相互转化的平衡,请用离子方程式表示它们之间的转化反应(5)测定某固体产品中Na2Cr2O7含量的方法如下:称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。
①氧化还原滴定过程中的离子方程式为
②滴定到达终点的现象是
③若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中Na2Cr2O7的纯度为
您最近一年使用:0次
名校
解题方法
7 . 现将有铜的印刷线路板浸入120mL氯化铁浓溶液中,有9.6g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶解的物质。(设溶液体积不变,且不考虑金属离子水解)。请回答下列问题:
(1)充分反应后,溶液中存在4.8g不溶物的成分为___________ (用化学式表示)。
(2)充分反应后溶液中一定不存在的金属离子为___________ 。
(3)比较 、
、 、
、 的氧化性大小:
的氧化性大小:___________ 。
(4)试计算最后溶液中 离子的物质的量浓度
离子的物质的量浓度___________ mol/L。
(1)充分反应后,溶液中存在4.8g不溶物的成分为
(2)充分反应后溶液中一定不存在的金属离子为
(3)比较
 、
、 、
、 的氧化性大小:
的氧化性大小:(4)试计算最后溶液中
 离子的物质的量浓度
离子的物质的量浓度
您最近一年使用:0次
名校
8 . Fe、Co、 Ni 是重要的过渡金属元素。 回答下列问题:
(1)基态 Co 原子的核外电子排布式为_______ ,其在元素周期表中的位置为_______ 。
(2)镍能形成多种配合物,如正四面体形的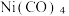 和正方形的
和正方形的 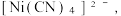 正八面体形的[Ni(NH3)6]2+等。
正八面体形的[Ni(NH3)6]2+等。
①CO与CN⁻原子总数、价电子总数相同,具有相似的结构特征,其中CO分子内σ键和π键个数之比为_______ 。
②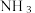 分子的空间结构为
分子的空间结构为_______ ,NH3中N原子的杂化方式为_______ 。
③配离子[Ni(CN)4]2-和[Ni(NH3)6]2+中,Ni2+的配位数分别为_______ 、_______ 。
(3)镍能形成多种氧化物,一种镍的氧化物的晶胞结构特征为氧离子形成面心立方结构,镍离子位于氧离子构成的八面体空隙中。如图中的_______ (填字母)是从该晶胞中分割出来的结构。
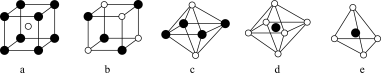
已知该晶体密度为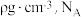 为阿伏加德罗常数的值,则晶胞中两个镍离子之间的最短距离为
为阿伏加德罗常数的值,则晶胞中两个镍离子之间的最短距离为_______ pm(用含ρ和NA的代数式表示)。
(1)基态 Co 原子的核外电子排布式为
(2)镍能形成多种配合物,如正四面体形的
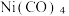 和正方形的
和正方形的 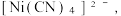 正八面体形的[Ni(NH3)6]2+等。
正八面体形的[Ni(NH3)6]2+等。①CO与CN⁻原子总数、价电子总数相同,具有相似的结构特征,其中CO分子内σ键和π键个数之比为
②
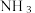 分子的空间结构为
分子的空间结构为③配离子[Ni(CN)4]2-和[Ni(NH3)6]2+中,Ni2+的配位数分别为
(3)镍能形成多种氧化物,一种镍的氧化物的晶胞结构特征为氧离子形成面心立方结构,镍离子位于氧离子构成的八面体空隙中。如图中的

已知该晶体密度为
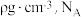 为阿伏加德罗常数的值,则晶胞中两个镍离子之间的最短距离为
为阿伏加德罗常数的值,则晶胞中两个镍离子之间的最短距离为
您最近一年使用:0次
名校
解题方法
9 . 室温下,向亚硫酸溶液中滴加 溶液,各含硫微粒分布系数(平衡时某微粒的物质的量占各微粒物质的量之和的分数)与溶液
溶液,各含硫微粒分布系数(平衡时某微粒的物质的量占各微粒物质的量之和的分数)与溶液 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
 溶液,各含硫微粒分布系数(平衡时某微粒的物质的量占各微粒物质的量之和的分数)与溶液
溶液,各含硫微粒分布系数(平衡时某微粒的物质的量占各微粒物质的量之和的分数)与溶液 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是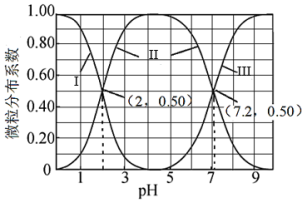
A.曲线Ⅱ表示 的分布系数随 的分布系数随 的变化 的变化 |
B. 的二级电离平衡常数( 的二级电离平衡常数(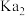 )的数量级为 )的数量级为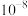 |
C. 时, 时,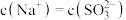 |
D. 溶液中水电离出的 溶液中水电离出的 |
您最近一年使用:0次
2024-01-17更新
|
403次组卷
|
5卷引用:宁夏回族自治区银川一中2024届高三下学期三模理综试题-高中化学
宁夏回族自治区银川一中2024届高三下学期三模理综试题-高中化学福建省厦门市松柏中学2023-2024学年高三上学期第三次月考化学试卷(已下线)化学(九省联考考后提升卷,江西卷)-2024年1月“九省联考”真题完全解读与考后提升湖南省宁乡市第一高级中学2021届高三第三次模拟考试化学试卷广东省惠州市第一中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
10 . I.我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是______(填字母)。
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有____ 种。
(3)采用空气和Na为原料可直接制备 ,
, 的电子式为
的电子式为________ ,空气与熔融金属Na制备 反应前需依次通过
反应前需依次通过_____ 、_____ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(4)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供______ ,在BH3·NH3中B原子的杂化方式为_____ 。
Ⅱ.钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。回答下列问题:
(5)钛元素在元素周期表中的位置______ 。
(6)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的Ti原子有_____ 个;若该晶胞的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞中Ti原子与N原子的最近距离为
,则晶胞中Ti原子与N原子的最近距离为______ pm。(用含ρ、 的代数式表示)
的代数式表示)

(1)下列N原子的电子排布图表示的状态中,能量最高的是______(填字母)。
A.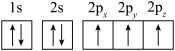 | B.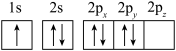 |
C. | D. |
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有
(3)采用空气和Na为原料可直接制备
 ,
, 的电子式为
的电子式为 反应前需依次通过
反应前需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(4)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供
Ⅱ.钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。回答下列问题:
(5)钛元素在元素周期表中的位置
(6)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的Ti原子有
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞中Ti原子与N原子的最近距离为
,则晶胞中Ti原子与N原子的最近距离为 的代数式表示)
的代数式表示)
您最近一年使用:0次