1 . 人类利用二氧化碳合成淀粉对社会的发展起着重要作用,合成过程首先是利用二氧化碳制备甲醇,合成甲醇的反应为
 。回答下列问题:
。回答下列问题:
(1)已知:
①
 ;
;
②
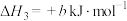 ;
;
③a、b均为大于零的数,且a>b。

_______ (用含a、b的式子表示) 。某研究小组设计合成
。某研究小组设计合成 的路线及
的路线及 的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为
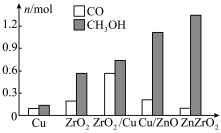
的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为__________________ 。________________ 。 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。___________________ 。
②结合图3及学过的知识推测,有水参与的历程,反应速率加快的原因是_____________________ 。
(4)在T℃时,将6mol (g)和12mol
(g)和12mol  (g)充入容积为10L的恒容容器中,只发生
(g)充入容积为10L的恒容容器中,只发生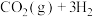
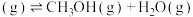 ,初始压强为
,初始压强为 kPa,测得体系中剩余
kPa,测得体系中剩余 (g)的物质的量随时间变化如图中状态Ⅰ所示。
(g)的物质的量随时间变化如图中状态Ⅰ所示。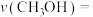
__________  ,该反应的平衡常数
,该反应的平衡常数
_________  。(用平衡分压代替平衡浓度计算,列出计算式)
。(用平衡分压代替平衡浓度计算,列出计算式)
②保持投料量不变,仅改变某一个条件后,测得 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是___________________ 。

 。回答下列问题:
。回答下列问题:(1)已知:
①

 ;
;②

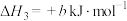 ;
;③a、b均为大于零的数,且a>b。

 。某研究小组设计合成
。某研究小组设计合成 的路线及
的路线及 的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为
的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为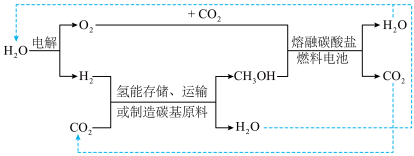
 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。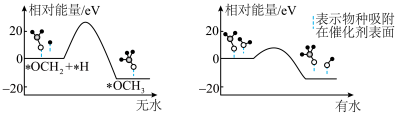
②结合图3及学过的知识推测,有水参与的历程,反应速率加快的原因是
(4)在T℃时,将6mol
 (g)和12mol
(g)和12mol  (g)充入容积为10L的恒容容器中,只发生
(g)充入容积为10L的恒容容器中,只发生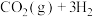
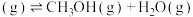 ,初始压强为
,初始压强为 kPa,测得体系中剩余
kPa,测得体系中剩余 (g)的物质的量随时间变化如图中状态Ⅰ所示。
(g)的物质的量随时间变化如图中状态Ⅰ所示。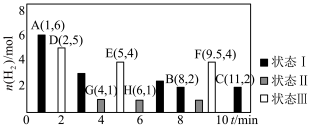
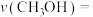
 ,该反应的平衡常数
,该反应的平衡常数
 。(用平衡分压代替平衡浓度计算,列出计算式)
。(用平衡分压代替平衡浓度计算,列出计算式)②保持投料量不变,仅改变某一个条件后,测得
 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
您最近一年使用:0次
2024-03-22更新
|
756次组卷
|
6卷引用:化学(全国卷旧教材)-2024年高考押题预测卷
(已下线)化学(全国卷旧教材)-2024年高考押题预测卷2024届宁夏回族自治区石嘴山市平罗县平罗中学高三下学期模拟预测理综试题-高中化学河南省新乡市2024届高三第二次模拟考试理综-化学试题2024届青海省百所名校高三下学期二模理科综合试题-高中化学2024届四川省绵阳市东辰中学高三下学期模拟考试(一)理科综合试题-高中化学(已下线)T29-原理综合题
名校
2 . 有机化合物X与HCOOC2H5在HCl的催化作用下可反应生成Y,其反应如图:

下列说法正确的是
| A.X分子中所有的碳原子可能共平面 |
| B.与HCOOC2H5同类别的同分异构体还有2种 |
| C.该反应的副产物为CH3CH2OH和H2O |
| D.1mol分子X、Y均最多可与5mol H2发生加成反应 |
您最近一年使用:0次
3 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。
(1)以生物材质(以 计)与水蒸气反应制取
计)与水蒸气反应制取 是一种低耗能,高效率的制
是一种低耗能,高效率的制 方法。该方法由气化炉制造
方法。该方法由气化炉制造 和燃烧炉再生
和燃烧炉再生 两步构成,气化炉中涉及到的反应如下:
两步构成,气化炉中涉及到的反应如下:
I.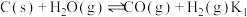
Ⅱ.
Ⅲ.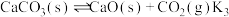
Ⅳ.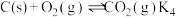
①该工艺制 总反应可表示为
总反应可表示为 ,该反应的平衡常数
,该反应的平衡常数
___________ (用 等的代数式表示)。
等的代数式表示)。
②绝热条件下,将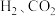 以体积比
以体积比 充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是
充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是___________ 。
A. 与
与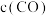 比值不变 B.容器内气体密度不变
比值不变 B.容器内气体密度不变
C.容器内气体压强不变 D.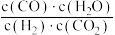 不变
不变
(2) 的速率方程为
的速率方程为 ,
,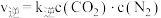 (
( 、
、 为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
净反应速率 等于正、逆反应速率之差,平衡时,
等于正、逆反应速率之差,平衡时,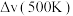
___________ (填“>”、“<”或“=”) 。
。
(3)一定条件下, 与
与 反应可合成
反应可合成 ,
, ,该反应分两步进行:
,该反应分两步进行:
ⅰ.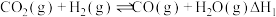
ⅱ.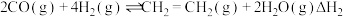
 ,压强恒定为
,压强恒定为 时,将
时,将 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
 的平衡转化率为
的平衡转化率为___________ ,反应ⅰ的平衡常数
___________ ( 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。
(4)利用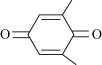 (Q)与
(Q)与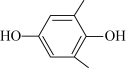 (QH2)电解转化法从烟气中分离
(QH2)电解转化法从烟气中分离 的原理如图,已知气体可选择性通过膜电极,溶液不能通过
的原理如图,已知气体可选择性通过膜电极,溶液不能通过
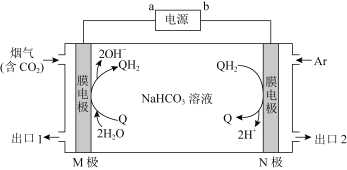
①(填“a”或“b”)___________ 为电源负极。
② 从出口
从出口___________ (填“1”或“2”)排出, 在
在 极上发生的反应为
极上发生的反应为___________ 。
(1)以生物材质(以
 计)与水蒸气反应制取
计)与水蒸气反应制取 是一种低耗能,高效率的制
是一种低耗能,高效率的制 方法。该方法由气化炉制造
方法。该方法由气化炉制造 和燃烧炉再生
和燃烧炉再生 两步构成,气化炉中涉及到的反应如下:
两步构成,气化炉中涉及到的反应如下:I.
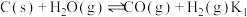
Ⅱ.

Ⅲ.
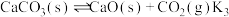
Ⅳ.
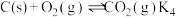
①该工艺制
 总反应可表示为
总反应可表示为 ,该反应的平衡常数
,该反应的平衡常数
 等的代数式表示)。
等的代数式表示)。②绝热条件下,将
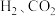 以体积比
以体积比 充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是
充入恒容密闭容器中,若只发生反应Ⅱ,下列可作为反应Ⅱ达到平衡的判据是A.
 与
与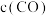 比值不变 B.容器内气体密度不变
比值不变 B.容器内气体密度不变C.容器内气体压强不变 D.
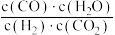 不变
不变(2)
 的速率方程为
的速率方程为 ,
,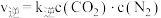 (
( 、
、 为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。净反应速率
 等于正、逆反应速率之差,平衡时,
等于正、逆反应速率之差,平衡时,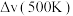
 。
。(3)一定条件下,
 与
与 反应可合成
反应可合成 ,
, ,该反应分两步进行:
,该反应分两步进行:ⅰ.
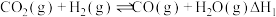
ⅱ.
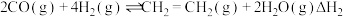
 ,压强恒定为
,压强恒定为 时,将
时,将 的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:| 组分 |  |  |  |
| 物质的量分数(%) | 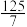 | 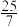 | 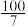 |
 的平衡转化率为
的平衡转化率为
 是以分压表示的平衡常数,分压
是以分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。(4)利用
 (Q)与
(Q)与 (QH2)电解转化法从烟气中分离
(QH2)电解转化法从烟气中分离 的原理如图,已知气体可选择性通过膜电极,溶液不能通过
的原理如图,已知气体可选择性通过膜电极,溶液不能通过
①(填“a”或“b”)
②
 从出口
从出口 在
在 极上发生的反应为
极上发生的反应为
您最近一年使用:0次
名校
解题方法
4 . 标况下, 的溶解度约为
的溶解度约为 ,
, ;室温下
;室温下 溶液中各含碳粒子的物质的量分数与
溶液中各含碳粒子的物质的量分数与 的关系如图1所示,向碳酸钠和碳酸氢钠混合溶液中滴加氯化钡溶液,溶液中
的关系如图1所示,向碳酸钠和碳酸氢钠混合溶液中滴加氯化钡溶液,溶液中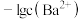 与
与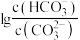 的关系如图2所示,下列说法正确的是
的关系如图2所示,下列说法正确的是
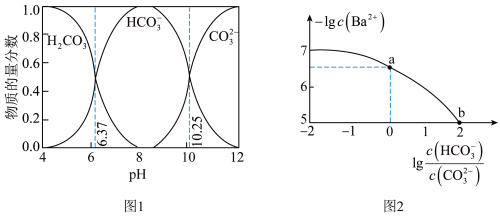
 的溶解度约为
的溶解度约为 ,
, ;室温下
;室温下 溶液中各含碳粒子的物质的量分数与
溶液中各含碳粒子的物质的量分数与 的关系如图1所示,向碳酸钠和碳酸氢钠混合溶液中滴加氯化钡溶液,溶液中
的关系如图1所示,向碳酸钠和碳酸氢钠混合溶液中滴加氯化钡溶液,溶液中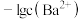 与
与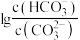 的关系如图2所示,下列说法正确的是
的关系如图2所示,下列说法正确的是
A.饱和碳酸的浓度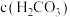 约为 约为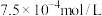 |
B. 对应的溶液中存在: 对应的溶液中存在: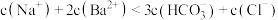 |
C.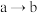 的过程中,溶液中 的过程中,溶液中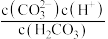 逐渐减小 逐渐减小 |
D. 点对应溶液的 点对应溶液的 为9.25 为9.25 |
您最近一年使用:0次
5 . 我国主要以 型锂辉石(主要成分
型锂辉石(主要成分 、
、 、
、 ,含有
,含有 、
、 等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂
等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂 并制备锂离子电池的正极材料
并制备锂离子电池的正极材料 。流程如下:
。流程如下: 不溶于水,能溶于强酸。
不溶于水,能溶于强酸。
②部分金属氢氧化物的 如下表。
如下表。
③ 和
和 的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。
的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。
(1)“球磨”操作的目的是_______ 。
(2)加入石灰石中和残酸,调节pH使铁、铝等杂质完全沉淀,则pH至少为_______ 。(保留一位小数。通常认为溶液中离子浓度小于 为沉淀完全)
为沉淀完全)
(3)滤渣2的成分是_______ 。
(4)获得 时,通常“冷冻至0℃”,原因是
时,通常“冷冻至0℃”,原因是_______ 。
(5) 溶液与
溶液与 和
和 混合溶液制备
混合溶液制备 的化学方程式为
的化学方程式为_______ ;两种溶液相互滴加的方式不同会影响产率和纯度,有同学认为应该将 和
和 混合液滴加到
混合液滴加到 溶液中,你认为是否合理
溶液中,你认为是否合理_______ (填“是”或“否”),说明理由:_______ 。
(6) 需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是
需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是_______ (任写一点)。
 型锂辉石(主要成分
型锂辉石(主要成分 、
、 、
、 ,含有
,含有 、
、 等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂
等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂 并制备锂离子电池的正极材料
并制备锂离子电池的正极材料 。流程如下:
。流程如下: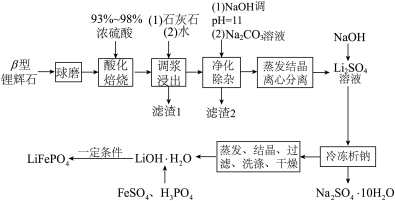
 不溶于水,能溶于强酸。
不溶于水,能溶于强酸。②部分金属氢氧化物的
 如下表。
如下表。| 物质 |  |  |  |
 | 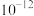 | 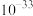 | 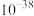 |
 和
和 的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。
的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。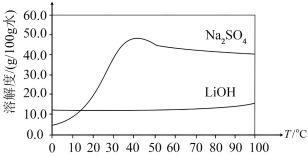
(1)“球磨”操作的目的是
(2)加入石灰石中和残酸,调节pH使铁、铝等杂质完全沉淀,则pH至少为
 为沉淀完全)
为沉淀完全)(3)滤渣2的成分是
(4)获得
 时,通常“冷冻至0℃”,原因是
时,通常“冷冻至0℃”,原因是(5)
 溶液与
溶液与 和
和 混合溶液制备
混合溶液制备 的化学方程式为
的化学方程式为 和
和 混合液滴加到
混合液滴加到 溶液中,你认为是否合理
溶液中,你认为是否合理(6)
 需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是
需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是
您最近一年使用:0次
2024-02-25更新
|
1237次组卷
|
6卷引用:化学(全国卷旧教材)-2024年高考押题预测卷
(已下线)化学(全国卷旧教材)-2024年高考押题预测卷广西柳州高中、南宁三中名校联盟2023-2024学年高三一轮复习诊断联考化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届陕西省西安市第一中学高三下学期第十六次模拟考试理综试题-高中化学广西来宾市忻城县高级中2023-2024学年高二下学期期中考试化学试卷
名校
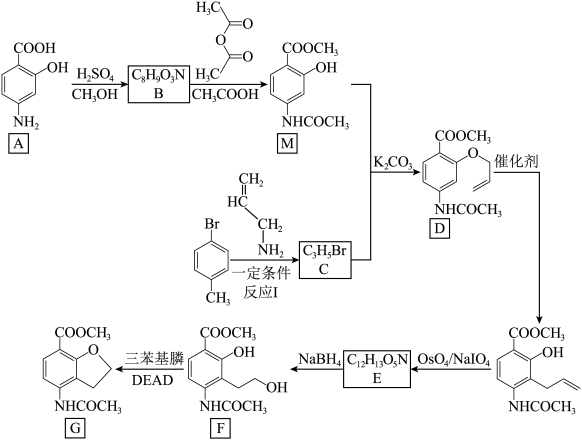
6 . 化合物G是用于治疗慢性便秘药品普卡必利的中间体,其合成路线如下:
已知:
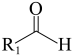 +
+
回答下列问题。
(1)有机物A中的官能团为羟基、羧基和_______ 。
(2)反应A→B的化学方程式为_______ 。
(3)M+C→D为可逆反应,推测 的作用:
的作用:_______ 。
(4)E的结构简式为_______ 。
(5)写出符合下列条件的B的一种同分异构体的结构简式_______ 。
①属于 -氨基酸(氨基连接在与羧基相连的碳原子上)
-氨基酸(氨基连接在与羧基相连的碳原子上)
②遇 溶液显紫色
溶液显紫色
(6)请根据流程中的信息,设计以苯酚和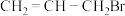 为原料合成
为原料合成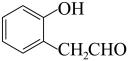 的合成路线
的合成路线_______ 。

已知:

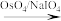
 +
+
回答下列问题。
(1)有机物A中的官能团为羟基、羧基和
(2)反应A→B的化学方程式为
(3)M+C→D为可逆反应,推测
 的作用:
的作用:(4)E的结构简式为
(5)写出符合下列条件的B的一种同分异构体的结构简式
①属于
 -氨基酸(氨基连接在与羧基相连的碳原子上)
-氨基酸(氨基连接在与羧基相连的碳原子上)②遇
 溶液显紫色
溶液显紫色(6)请根据流程中的信息,设计以苯酚和
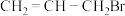 为原料合成
为原料合成 的合成路线
的合成路线
您最近一年使用:0次
名校
解题方法
7 . 下列表格中各项分类都正确 的一组是
类别 选项 | 离子化合物 | 电解质 | 酸性氧化物 | 碱性氧化物 | 强酸 |
| A | AlCl3 | 熔融态KNO3 | NO2 | Na2O2 | H2SO3 |
| B | NH3·H2O | 铁 | ClO2 | Fe3O4 | NaHSO4 |
| C | K2S | 胆矾 | SO3 | MgO | HClO4 |
| D | CH3COONH4 | 盐酸 | CO2 | Al2O3 | HI |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 酸浸法回收废炉渣中(主要为铜、钴、镍、铁等金属元素的氧化物)的铜、钴、镍的流程如下: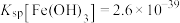 ,
, 。
。
(1)“磨细”过程的目的是_______ 。
(2)酸浸液中大量铁元素以 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为_______ 。
(3)“滤渣2”主要成分为_______ (填化学式)。
(4)“镍钴分离”过程 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(5)“酸溶1”过程用 替换
替换 ,从绿色化学角度分析其可行性
,从绿色化学角度分析其可行性_______ 。
(6)“焙烧”过程发生反应的化学方程式为_______ 。
(7)已知当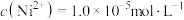 时,认为其沉淀完全。“沉镍”过程的目的是为了将“
时,认为其沉淀完全。“沉镍”过程的目的是为了将“ ”,此时应调节溶液的pH为
”,此时应调节溶液的pH为_______ 。
(8)“操作X”为_______ 。
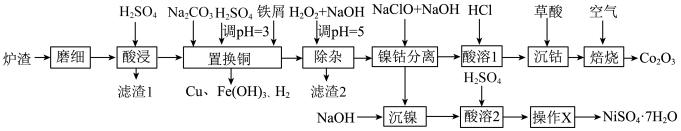
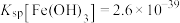 ,
, 。
。(1)“磨细”过程的目的是
(2)酸浸液中大量铁元素以
 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为(3)“滤渣2”主要成分为
(4)“镍钴分离”过程
 发生反应的离子方程式为
发生反应的离子方程式为(5)“酸溶1”过程用
 替换
替换 ,从绿色化学角度分析其可行性
,从绿色化学角度分析其可行性(6)“焙烧”过程发生反应的化学方程式为
(7)已知当
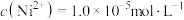 时,认为其沉淀完全。“沉镍”过程的目的是为了将“
时,认为其沉淀完全。“沉镍”过程的目的是为了将“ ”,此时应调节溶液的pH为
”,此时应调节溶液的pH为(8)“操作X”为
您最近一年使用:0次
2024-02-20更新
|
487次组卷
|
2卷引用:宁夏石嘴山市第三中学2024届高三第一次模拟考试理综-化学试题
名校
解题方法
9 . 中医药作为中国优秀传统文化的典范,凝聚着祖先的智慧和经验的结晶。矿物药的成分主要为金属﹑金属氧化物﹑盐等。
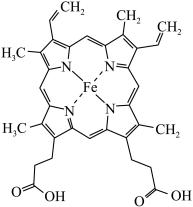
(1)铁华粉常用来治疗血虚萎黄,其成分为醋酸亚铁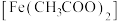 ,其形成的血红素分子结构如图所示。铁位于周期表的
,其形成的血红素分子结构如图所示。铁位于周期表的___________ 区,铁华粉中基态亚铁离子的未成对电子数与其电子总数之比为___________ ,铁华粉中组成元素的电负性由大到小的顺序为___________ (填元素符号),血红素分子中铁(Ⅱ)的配位数为___________ 。
(2)生石灰可用于止血,轻质氧化镁可用于治疗便秘。请比较CaO、MgO的熔点大小,并请解释原因:___________ 。
(3)多原子分子中各原子若在同一平面,且有相互平行的 轨道,则
轨道,则 电子可在多个原子间运动,形成“离域
电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”,可表示成
键”,可表示成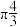 ,则
,则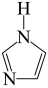 (咪唑)中的“离域
(咪唑)中的“离域 键”可表示为
键”可表示为___________ 。
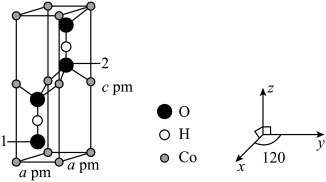
(4)Co可以形成六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标。已知晶胞含对称中心,其中1号 原子的坐标为
原子的坐标为 ,则2号
,则2号 原子的坐标为
原子的坐标为___________ 。设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为___________  (用代数式表示)。
(用代数式表示)。
(1)铁华粉常用来治疗血虚萎黄,其成分为醋酸亚铁
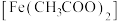 ,其形成的血红素分子结构如图所示。铁位于周期表的
,其形成的血红素分子结构如图所示。铁位于周期表的
(2)生石灰可用于止血,轻质氧化镁可用于治疗便秘。请比较CaO、MgO的熔点大小,并请解释原因:
(3)多原子分子中各原子若在同一平面,且有相互平行的
 轨道,则
轨道,则 电子可在多个原子间运动,形成“离域
电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”,可表示成
键”,可表示成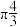 ,则
,则 (咪唑)中的“离域
(咪唑)中的“离域 键”可表示为
键”可表示为(4)Co可以形成六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标。已知晶胞含对称中心,其中1号
 原子的坐标为
原子的坐标为 ,则2号
,则2号 原子的坐标为
原子的坐标为 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
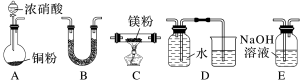
10 . I.金属镁性质活泼,能与许多物质反应,某校课外活动小组根据镁能在二氧化碳中燃烧,推测Mg也能在NO2中燃烧,可能产物为MgO、N2和Mg3N2.通过如图所示实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。已知:NO2气体能被NaOH溶液吸收,Mg3N2极易与水反应。___________ (填字母);装置B的作用是___________ 。
(2)用来检验N2的实验装置为___________ (填字母)。
(3)设计实验证明产物中存在Mg3N2:___________ 。
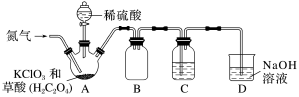
Ⅱ.二氧化氯(ClO2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。ClO2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照如图实验装置制备ClO2并验证其某些性质。回答下列问题:___________ 。
(5)通入氮气的主要作用有两个,一是可以起到搅拌作用,二是___________ 。
(6)B装置的作用是________ 。C装置用来吸收ClO2,则C中液体宜选用_________ (填序号)。
①热水②冰水③饱和食盐水
(7)D装置中ClO2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,D装置中生成这两种钠盐的化学方程式为___________ ;饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2·3H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.___________ ;b.___________ ;c.洗涤;d.干燥。
(8)设计一个简易实验证明二氧化氯具有永久的漂白性:___________ 。
(2)用来检验N2的实验装置为
(3)设计实验证明产物中存在Mg3N2:
Ⅱ.二氧化氯(ClO2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。ClO2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照如图实验装置制备ClO2并验证其某些性质。回答下列问题:
(5)通入氮气的主要作用有两个,一是可以起到搅拌作用,二是
(6)B装置的作用是
①热水②冰水③饱和食盐水
(7)D装置中ClO2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,D装置中生成这两种钠盐的化学方程式为
(8)设计一个简易实验证明二氧化氯具有永久的漂白性:
您最近一年使用:0次
2024-02-14更新
|
89次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期第二次月考 化学试题



