名校
1 . 立方晶系Sb2O3对光稳定,是制备聚对苯二甲酸乙二醇酯的优良催化剂。制备的实验步骤如下:
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器a中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。
①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水。
回答下列问题:
(1)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式___________ 。
(2)仪器a的名称为___________ ,装置B的作用为___________ 。
(3)洗涤时Sb2O3晶体洗净的判断标准是___________ 。
(4)烘干时,晶体装在___________ (填仪器名称)。
(5)如果将乙二醇改为乙醇用上述同样方法制备,往往得到Sb2O3混晶,解释原因___________ 。
(6)用___________ 法可以测定Sb2O3是混晶还是单晶。
(7)取mg产品于锥形瓶中,用盐酸等试剂预处理后,用amol·L-1碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为 。
。
①滴定终点现象是___________ 。
②产品中Sb元素的质量分数是___________ 。
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器a中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。

①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水。
回答下列问题:
(1)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式
(2)仪器a的名称为
(3)洗涤时Sb2O3晶体洗净的判断标准是
(4)烘干时,晶体装在
(5)如果将乙二醇改为乙醇用上述同样方法制备,往往得到Sb2O3混晶,解释原因
(6)用
(7)取mg产品于锥形瓶中,用盐酸等试剂预处理后,用amol·L-1碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为
 。
。①滴定终点现象是
②产品中Sb元素的质量分数是
您最近一年使用:0次
2024-05-01更新
|
263次组卷
|
3卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期三模理综试题-高中化学
名校
解题方法
2 . 根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:___________ 。
(2)反应开始至4 min时,A的平均反应速率为___________ 。
(3)4 min时,反应是否达平衡状态?___________ (填“是”或“否”),8 min时,v正___________ v逆。(填“>”“<”或“=”)
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。___________ 。
(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________ 。
②反应达到平衡时,放出的热量___________ (填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为___________ 。
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)__________
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,AB物质的量随时间变化的曲线如图所示:
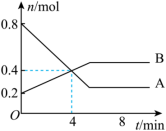
(2)反应开始至4 min时,A的平均反应速率为
(3)4 min时,反应是否达平衡状态?
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g) ⇌2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

(5)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和
8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为
②反应达到平衡时,放出的热量
A.小于92.4 kJ B.等于92.4 kJ
C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(6)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为
A.混合气体的平均相对分子质量
B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2
D.混合气体的密度不变
E.断开3 mol H-H键的同时断开2 mol N-H键
(7)反应达到平衡后,保持其他条件不变,t0时刻升高温度,请在图中画出 改变条件后至达到新平衡时v正、v逆的变化曲线并注明v正、v逆(在答题卡做答)

您最近一年使用:0次
2024-04-30更新
|
366次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高一下学期4月期中考试化学试题
解题方法
3 . 过氧乙酸( )是无色透明液体,常用于速效漂白和消毒,氧化性比
)是无色透明液体,常用于速效漂白和消毒,氧化性比 强,与酸性
强,与酸性 相近。某课外实验小组同学用
相近。某课外实验小组同学用 溶液与乙酸酐制备高浓度过氧乙酸并对其含量测定,实验过程如下。
溶液与乙酸酐制备高浓度过氧乙酸并对其含量测定,实验过程如下。
 。
。Ⅰ.过氧化氢的浓缩:
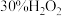 溶液浓缩至75%(
溶液浓缩至75%( 沸点150.2℃):浓缩装置如下图所示(连接用橡胶管和支持仪器以及抽气泵已省略):
沸点150.2℃):浓缩装置如下图所示(连接用橡胶管和支持仪器以及抽气泵已省略):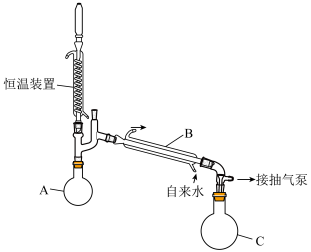
 溶液主要在
溶液主要在(2)该实验过程操作的正确顺序是
_______→_______→_______→_______→③→④
①水浴加热;②连接装置;③抽真空后向冷凝管中通水;
④自滴液漏斗往烧瓶中缓慢滴加
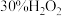 溶液;
溶液;⑤在滴液漏斗中装入
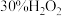 溶液;
溶液;⑥检查装置气密性。
Ⅱ.过氧乙酸的制备:如下图所示,搅拌器不断搅拌下,向三颈烧瓶中加入45mL乙酸酐,逐步滴加
 溶液25mL(过量),再加1mL浓硫酸,搅拌4小时,室温静置15小时即得47%的过氧乙酸溶液。
溶液25mL(过量),再加1mL浓硫酸,搅拌4小时,室温静置15小时即得47%的过氧乙酸溶液。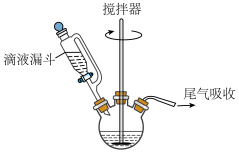
(4)实验中,利用搅拌器充分搅拌的作用是
(5)乙酸酐与
 反应的尾气可以用
反应的尾气可以用Ⅲ.过氧乙酸(含杂质)的含量测定:取适量样品按下图所示步骤依次进行实验,测定过氧乙酸的含量。

 溶液恰好除尽
溶液恰好除尽 的实验现象是
的实验现象是②第3步中过氧乙酸可被
 还原为乙酸,其离子方程式为
还原为乙酸,其离子方程式为③若实验中所取样品体积为
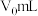 ,第3步中加入
,第3步中加入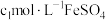 溶液
溶液 ,第4步滴定中消耗
,第4步滴定中消耗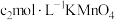 溶液
溶液 ,则过氧乙酸含量为
,则过氧乙酸含量为 。
。
您最近一年使用:0次
名校
解题方法
4 . 克里唑替尼(化合物N)是一种可用于治疗小细胞性肺癌,灭杀肺部肿瘤的药物。N的一种合成路线如下(部分试剂和条件略去)。
(1)A的化学名称是___________ 。
(2)N中含氧官能团的名称是___________ 。
(3)B生成C的反应类型为___________ 。
(4)由C生成E的化学方程式为___________ 。
(5)已知:J+K L+CH3OI,则K的结构简式为
L+CH3OI,则K的结构简式为___________ 。
(6)F分子中手性碳的数目为___________ 。
(7)P是G的同系物,相对分子质量比G小14。P的同分异构体中,满足下列条件的有___________ 种,其中任意一种的结构简式为___________ 。
③核磁共振氢谱显示有3组峰,且峰面积之比为2∶1∶1

(1)A的化学名称是
(2)N中含氧官能团的名称是
(3)B生成C的反应类型为
(4)由C生成E的化学方程式为
(5)已知:J+K
 L+CH3OI,则K的结构简式为
L+CH3OI,则K的结构简式为(6)F分子中手性碳的数目为
(7)P是G的同系物,相对分子质量比G小14。P的同分异构体中,满足下列条件的有
①含有结构单元:
③核磁共振氢谱显示有3组峰,且峰面积之比为2∶1∶1
您最近一年使用:0次
名校
解题方法
5 . 钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(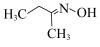 )。回答下列问题:
)。回答下列问题:
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因
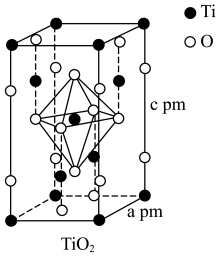
(4)TiO2晶胞如图所示,若其晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=
您最近一年使用:0次
名校
6 . 金属镍及其化合物在合成材料以及催化剂等方面应用广泛。请回答下列问题:
(1)基态Ni原子的核外电子排布图为___________
(2)NiO、FeO晶体类型及晶胞与NaCl相同,则NiO晶胞结构中Ni2+的配位数为___________ ;又知Ni2+、Fe2+的离子半径分别为69pm、78pm,则NiO熔点___________ FeO(填“>”“<”或“=”)。
(3)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图甲所示,则该沉淀中C原子的杂化类型为___________ ;元素H、C、N、O、Ni电负性由大到小的顺序为___________ 。___________ ;晶体密度为___________ g·cm-3(列出含a、b、NA的计算表达式,NA表示阿伏加德罗常数的值)。
(1)基态Ni原子的核外电子排布图为
(2)NiO、FeO晶体类型及晶胞与NaCl相同,则NiO晶胞结构中Ni2+的配位数为
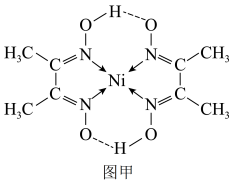
(3)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图甲所示,则该沉淀中C原子的杂化类型为
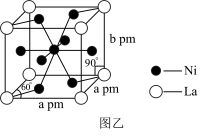
您最近一年使用:0次
名校
7 . 已知A、B、C、D都是短周期元素,它们的原子半径大小顺序为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。试回答下列问题(用元素符号或化学式表示):
(1)基态B原子中,核外存在___________ 个未成对电子,最高能级符号是___________ 。
(2)基态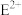 的核外电子排布式为
的核外电子排布式为___________ 。
(3)基态D原子的最高能层的电子排布图为___________ 。
(4)M分子中B原子轨道的杂化类型为___________ 。
(5)B、C、D三种元素的第一电离能由小到大的顺序为___________ 。
(6)硫元素能形成多种微粒如 、
、 、
、 、
、 、
、 等,杂化类型为
等,杂化类型为 的是
的是___________ (填写微粒符号,下同);杂化类型为 的是
的是___________ ;VSEPR模型为四面体(包括正四面体)的是___________ ;分子空间结构为V形的是___________ ;分子空间结构为三角锥型的是___________ 。
(7) 中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为
中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为___________ (填标号)。___________ 。
(1)基态B原子中,核外存在
(2)基态
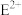 的核外电子排布式为
的核外电子排布式为(3)基态D原子的最高能层的电子排布图为
(4)M分子中B原子轨道的杂化类型为
(5)B、C、D三种元素的第一电离能由小到大的顺序为
(6)硫元素能形成多种微粒如
 、
、 、
、 、
、 、
、 等,杂化类型为
等,杂化类型为 的是
的是 的是
的是(7)
 中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为
中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为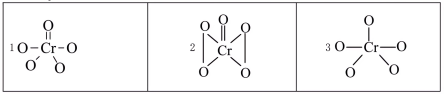
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题:
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气(COCl2);2CHCl3+O2→2HCl+2COCl2,光气(COCl2)分子的立体构型是___________ 形。
(2)某有机物的结构简式为 该有机物分子是
该有机物分子是___________ (填“极性”或“非极性”)分子
(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为___________ ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因___________ ;
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3;HN3的酸性和醋酸相近,可微弱电离出H+和N 。下列有关说法正确的是___________(填序号)。
。下列有关说法正确的是___________(填序号)。
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气(COCl2);2CHCl3+O2→2HCl+2COCl2,光气(COCl2)分子的立体构型是
(2)某有机物的结构简式为
 该有机物分子是
该有机物分子是(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3;HN3的酸性和醋酸相近,可微弱电离出H+和N
 。下列有关说法正确的是___________(填序号)。
。下列有关说法正确的是___________(填序号)。| A.HN3中含有5个σ键 |
| B.HN3中的三个氮原子均采用sp2杂化 |
| C.HN3、HNO2、H2O、N2H4都是极性分子 |
| D.肼(N2H4)的沸点高达113.5℃,说明肼分子间可形成氢键 |
您最近一年使用:0次
名校
9 . 气相离子催化剂(Fe+、Co+、Mn+等)具有优良的催化效果。其中在Fe+催化下乙烷氧化反应的机理如图所示(图中…为副反应),下列说法不正确的是

A.主反应的总反应方程式为:C2H6+2N2O CH3CHO+H2O+2N2 CH3CHO+H2O+2N2 |
| B.每生成1mol CH3CHO消耗N2O的物质的量等于2mol |
| C.CH3CHO中碳原子的杂化方式有sp3和sp2两种 |
| D.X与Y能互溶因为它们的分子结构具有相似性且X与Y能形成分子间氢键 |
您最近一年使用:0次
名校
10 . 将等物质的量浓度等体积的甘氨酸溶液与盐酸混合,发生反应: ,取上述溶液(含0.04mol
,取上述溶液(含0.04mol  ),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以
),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以 的形式存在)。
的形式存在)。
 ,取上述溶液(含0.04mol
,取上述溶液(含0.04mol  ),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以
),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以 的形式存在)。
的形式存在)。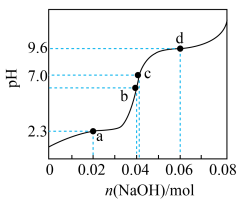
A. 中解离出 中解离出 的能力: 的能力: |
B.b点溶液pH<7,推测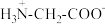 中 中 解离出 解离出 的程度大于-COO-水解的程度 的程度大于-COO-水解的程度 |
C.c点溶液中存在: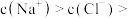 c( c(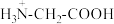 ) )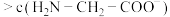 |
D.由d点可知: 的 的 |
您最近一年使用:0次
2024-04-10更新
|
663次组卷
|
5卷引用:2024届宁夏石嘴山市第三中学高三下学期四模理综试题-高中化学



