解题方法
1 . 过氧化钠可用于医药、印染、漂白等。某学习兴趣小组探究Na2O2与NO2、NO的反应,设计如图所示实验。

(1)盛放浓硝酸的仪器M名称为_________ ,A中发生反应的离子方程式为________ 。
(2)Na2O2与NO2反应,根据化合价升降原则有下列两种观点。
观点一:Na2O2氧化NO2,生成NaNO3;
观点二:NO2氧化Na2O2,生成O2。
为验证以上观点的正确性进行如下实验:
①关闭K2和弹簧夹,打开K1和A中仪器M的活塞,再将带火星的木条放在a处,观察到_______ 。甲同学认为观点二正确。
②乙同学认为该装置不能确认观点二正确,应在A、G之间增加一个装置,该装置的作用为______ 。改进后重复甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条没有复燃。判断观点一正确。
(3)丙同学根据NO易与O2反应,预测NO也易与Na2O2反应。
①丙同学关闭K1,打开K2,用上图的装置进行实验,为防止NO与空气中氧气反应,反应前的操作是___________ 。
②装置B的作用为___________ 。
③反应一段时间后,取D装置中产物少许,加入稀硫酸,产生无色气体遇到空气变为红棕色。完成反应的化学方程式:___________ 。
6___________ 4___________
4___________
④根据D装置中产物的判断结果,说明Na2O2与NO反应中Na2O2的作用是___________ 。(填标号)
A.氧化剂 B.还原剂 C.即是氧化剂也是还原剂

(1)盛放浓硝酸的仪器M名称为
(2)Na2O2与NO2反应,根据化合价升降原则有下列两种观点。
观点一:Na2O2氧化NO2,生成NaNO3;
观点二:NO2氧化Na2O2,生成O2。
为验证以上观点的正确性进行如下实验:
①关闭K2和弹簧夹,打开K1和A中仪器M的活塞,再将带火星的木条放在a处,观察到
②乙同学认为该装置不能确认观点二正确,应在A、G之间增加一个装置,该装置的作用为
(3)丙同学根据NO易与O2反应,预测NO也易与Na2O2反应。
①丙同学关闭K1,打开K2,用上图的装置进行实验,为防止NO与空气中氧气反应,反应前的操作是
②装置B的作用为
③反应一段时间后,取D装置中产物少许,加入稀硫酸,产生无色气体遇到空气变为红棕色。完成反应的化学方程式:
6___________
 4___________
4___________
④根据D装置中产物的判断结果,说明Na2O2与NO反应中Na2O2的作用是
A.氧化剂 B.还原剂 C.即是氧化剂也是还原剂
您最近一年使用:0次
解题方法
2 . 化学与生活、科技、环境密切相关。下列说法错误 的是
| A.热的纯碱溶液可去除油污 |
| B.“暖宝宝”主要是将化学能转化为热能 |
| C.食品包装袋中的生石灰可防止食物被氧化 |
D.福岛核废水中的放射性元素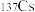 、 、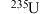 对人体有害 对人体有害 |
您最近一年使用:0次
解题方法
3 . 氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)氯碱工业的反应原理为 ,该反应中的氧化剂是
,该反应中的氧化剂是___________ 。
(2)为了防止食品变质而添加的抗氧化剂应具有___________ 性。(填“氧化”或“还原”)
(3)电子工业中常用 溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为
溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为___________ 。
(4) 可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应:
可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应: ,由此可知
,由此可知 的氧化性
的氧化性___________ (填“>”或“<”) 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为___________ 。
(1)氯碱工业的反应原理为
 ,该反应中的氧化剂是
,该反应中的氧化剂是(2)为了防止食品变质而添加的抗氧化剂应具有
(3)电子工业中常用
 溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为
溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为(4)
 可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应:
可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应: ,由此可知
,由此可知 的氧化性
的氧化性 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解题方法
4 . 某小组利用如图甲所示装置制备并收集 (夹持装置略去)。
(夹持装置略去)。

已知:Ⅰ.高温时能与 反应,极易水解,能溶于
反应,极易水解,能溶于 ;
;
Ⅱ.物质的熔沸点如表:
(1)加热管式炉前需先通入 的目的是
的目的是___________ ,管式炉加热至900℃时,瓷舟中会生成 、
、 和一种有毒的气态氧化物,并发生副反应生成少量
和一种有毒的气态氧化物,并发生副反应生成少量 ,写出主反应生成
,写出主反应生成 的化学方程式
的化学方程式___________ 。
(2)为除去 中的
中的 应调节控温箱的温度范围为
应调节控温箱的温度范围为___________ ℃。
(3)碱石灰的作用是___________ ,该装置的缺陷是___________ 。
(4)已知 在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原
在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原 制取
制取 :
: 。
。
①基态Ti原子的电子排布式为___________ 。
②反应中涉及的元素第一电离能最大的是___________ , 中化学键类型为
中化学键类型为___________ 。
③ 是一种优良的颜料,其晶胞结构如图。
是一种优良的颜料,其晶胞结构如图。

则黑球代表___________ (填“Ti”或“O”)。该晶体的密度为___________  (用含a、b、
(用含a、b、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 (夹持装置略去)。
(夹持装置略去)。
已知:Ⅰ.高温时能与
 反应,极易水解,能溶于
反应,极易水解,能溶于 ;
;Ⅱ.物质的熔沸点如表:
| 物质 |  |  |  |
| 熔点℃ | -23.2 | 306 | -23 |
| 沸点℃ | 136.4 | 315 | 76.8 |
(1)加热管式炉前需先通入
 的目的是
的目的是 、
、 和一种有毒的气态氧化物,并发生副反应生成少量
和一种有毒的气态氧化物,并发生副反应生成少量 ,写出主反应生成
,写出主反应生成 的化学方程式
的化学方程式(2)为除去
 中的
中的 应调节控温箱的温度范围为
应调节控温箱的温度范围为(3)碱石灰的作用是
(4)已知
 在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原
在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原 制取
制取 :
: 。
。①基态Ti原子的电子排布式为
②反应中涉及的元素第一电离能最大的是
 中化学键类型为
中化学键类型为③
 是一种优良的颜料,其晶胞结构如图。
是一种优良的颜料,其晶胞结构如图。
则黑球代表
 (用含a、b、
(用含a、b、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
5 . 钛白粉( )是重要的无机功能性颜料,工业上精制
)是重要的无机功能性颜料,工业上精制 可能涉及反应:
可能涉及反应: ,下列说法正确的是
,下列说法正确的是
 )是重要的无机功能性颜料,工业上精制
)是重要的无机功能性颜料,工业上精制 可能涉及反应:
可能涉及反应: ,下列说法正确的是
,下列说法正确的是A. 元素在该反应中被还原 元素在该反应中被还原 |
B.该反应中每生成 时转移 时转移 电子 电子 |
C. 在该反应中做氧化剂 在该反应中做氧化剂 |
| D.液氯汽化吸收能量用于破坏分子间作用力 |
您最近一年使用:0次
名校
6 . 铁及其化合物在生产生活中有极其重要的用途,请回答下列问题:
(1) 溶液可用于刻蚀铜制电路板,该反应的离子方程式为
溶液可用于刻蚀铜制电路板,该反应的离子方程式为________ 。
(2)要实现 转化为
转化为 ,可选用足量的
,可选用足量的________ (填字母)。
①亚硫酸钠溶液 ②稀盐酸 ③酸性 溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液
溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液
(3)某补铁口服液中含有 ,为检验其是否被氧化变质,可取少量该口服液,向其中滴加
,为检验其是否被氧化变质,可取少量该口服液,向其中滴加________ ,若溶液变为_____ 色,则说明其已变质。向该口服液中加入维生素C可防止其被氧化变质,利用了维生素C的_____ 性。
(4)激光打印机的墨粉中含有 。
。 溶于过量的稀盐酸,反应的离子方程式为
溶于过量的稀盐酸,反应的离子方程式为___________ 。往反应后的溶液中滴加少量酸性 溶液,酸性
溶液,酸性 溶液褪色,
溶液褪色,_____ (填“能或不能”)说明反应后的溶液中含 。若不能,请说明原因:
。若不能,请说明原因:___________ 。
(5)高铁酸盐可作为饮用水的消毒剂和净水剂,工业上以 、
、 、
、 为原料制备高铁酸钾。
为原料制备高铁酸钾。
①高铁酸钠 中Fe的化合价为
中Fe的化合价为_____ 。
②配平制备 的离子方程式:
的离子方程式:______
__ +__
+__ +__=__
+__=__ +__
+__ +__
+__
每生成39.6g ,转移电子的数目为
,转移电子的数目为_____ 。
③已知 ,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因
,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因___________ 。
(1)
 溶液可用于刻蚀铜制电路板,该反应的离子方程式为
溶液可用于刻蚀铜制电路板,该反应的离子方程式为(2)要实现
 转化为
转化为 ,可选用足量的
,可选用足量的①亚硫酸钠溶液 ②稀盐酸 ③酸性
 溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液
溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液(3)某补铁口服液中含有
 ,为检验其是否被氧化变质,可取少量该口服液,向其中滴加
,为检验其是否被氧化变质,可取少量该口服液,向其中滴加(4)激光打印机的墨粉中含有
 。
。 溶于过量的稀盐酸,反应的离子方程式为
溶于过量的稀盐酸,反应的离子方程式为 溶液,酸性
溶液,酸性 溶液褪色,
溶液褪色, 。若不能,请说明原因:
。若不能,请说明原因:(5)高铁酸盐可作为饮用水的消毒剂和净水剂,工业上以
 、
、 、
、 为原料制备高铁酸钾。
为原料制备高铁酸钾。①高铁酸钠
 中Fe的化合价为
中Fe的化合价为②配平制备
 的离子方程式:
的离子方程式:__
 +__
+__ +__=__
+__=__ +__
+__ +__
+__
每生成39.6g
 ,转移电子的数目为
,转移电子的数目为③已知
 ,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因
,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因
您最近一年使用:0次
解题方法
7 . 物质的类别和元素的化合价是研究物质性质的两个重要角度。下图是部分含氮和含氯物质的价类二维图,回答下列问题:
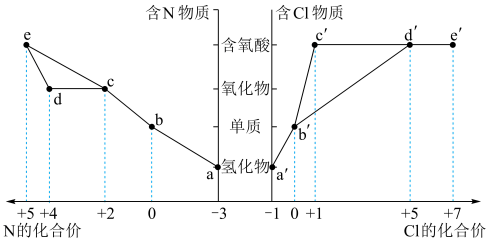
(1)b的化学式为___________ 。
(2)b′能溶于水还能与水反应,其水溶液显___________ 。(填“酸性、碱性或中性”)
(3)将a和a′两种气体混合产生的现象是___________ 。
(4)实验室制取b′气体用浓a′溶液滴入 中并加热,其反应的离子方程式为
中并加热,其反应的离子方程式为___________ 。
(5)工业上制备
___________ (填“能”或“不能”)通过a→b→c→e流程实现。
(6)由上述两种元素组成的液态化合物 ,遇水可生成化合物a和c′,该反应的化学方程式为
,遇水可生成化合物a和c′,该反应的化学方程式为___________ 。

(1)b的化学式为
(2)b′能溶于水还能与水反应,其水溶液显
(3)将a和a′两种气体混合产生的现象是
(4)实验室制取b′气体用浓a′溶液滴入
 中并加热,其反应的离子方程式为
中并加热,其反应的离子方程式为(5)工业上制备

(6)由上述两种元素组成的液态化合物
 ,遇水可生成化合物a和c′,该反应的化学方程式为
,遇水可生成化合物a和c′,该反应的化学方程式为
您最近一年使用:0次
解题方法
8 . 利用丙酮酸与废水中的 电催化耦合温和条件下去除
电催化耦合温和条件下去除 和生产高值化丙氨酸,其工作原理如图。25℃,丙氨酸主要以
和生产高值化丙氨酸,其工作原理如图。25℃,丙氨酸主要以 形式存在,其
形式存在,其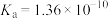 。下列说法错误的是
。下列说法错误的是

| A.丙氨酸酸性很弱是因为形成了内盐 |
B.阴极的电极反应式为 + + +10e-+11H+= +10e-+11H+= +4H2O +4H2O |
C.理论上阳极区每生成 ,阴极区 ,阴极区 减少4.4mol 减少4.4mol |
| D.该装置整合了电化学—化学—电化学串联反应 |
您最近一年使用:0次
2024-02-03更新
|
228次组卷
|
2卷引用:福建省龙岩市2023-2024学年高三上学期期末考试化学试题
9 . 氨氮废水造成湖泊富营养化,某研究团队设计处理流程如下: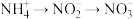 转化,在反硝化过程中实现
转化,在反硝化过程中实现 转化。下列说法正确的是
转化。下列说法正确的是

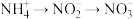 转化,在反硝化过程中实现
转化,在反硝化过程中实现 转化。下列说法正确的是
转化。下列说法正确的是| A.硝化过程中,含氮物质均发生还原反应 |
| B.反硝化过程属于氮的固定 |
| C.在一定条件下向废水中加入甲醇(CH3OH)可实现反硝化过程,甲醇中某元素的化合价会升高 |
| D.HNO3完全转化成1molN2时,转移的电子数为5NA |
您最近一年使用:0次
2024-02-03更新
|
511次组卷
|
7卷引用:福建省福州第一中学2023-2024学年高一下学期4月期中考试化学试题
解题方法
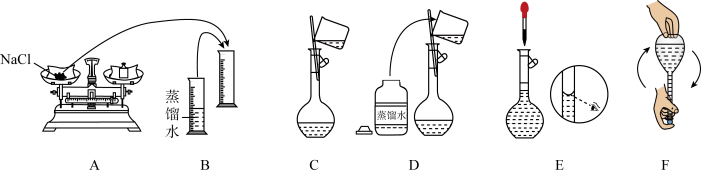
10 . 食盐是生活必需品,也是一种工业原料。粗盐含有 、
、 、
、 等杂质。
等杂质。
(1)“粗盐→精盐”过程:
①“除杂1”中反应的离子方程式为____ 。
②试剂X为____ (填化学式)。
③该过程中不涉及的实验操作是____ (填标号)。
A.溶解 B.过滤 C.蒸发 D.渗析
(2)用精盐配制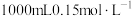 生理盐水的过程:
生理盐水的过程:
①用托盘天平称取 固体的质量为
固体的质量为____ g。
②下列关于配制溶液过程中操作不正确的是_______ (填标号)。 ”过程:
”过程:
①将电解过程发生反应的化学方程式补充完整:______ ,__ ___
___ __
__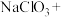 __
__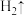 。
。
②在一定条件下 与盐酸反应生成消毒剂
与盐酸反应生成消毒剂 。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。则
的氧化能力。则 的有效氯含量为
的有效氯含量为______ g。
 、
、 、
、 等杂质。
等杂质。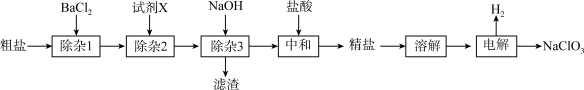
(1)“粗盐→精盐”过程:
①“除杂1”中反应的离子方程式为
②试剂X为
③该过程中不涉及的实验操作是
A.溶解 B.过滤 C.蒸发 D.渗析
(2)用精盐配制
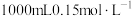 生理盐水的过程:
生理盐水的过程:①用托盘天平称取
 固体的质量为
固体的质量为②下列关于配制溶液过程中操作不正确的是
 ”过程:
”过程:①将电解过程发生反应的化学方程式补充完整:
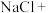 ___
___ __
__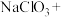 __
__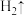 。
。②在一定条件下
 与盐酸反应生成消毒剂
与盐酸反应生成消毒剂 。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。则
的氧化能力。则 的有效氯含量为
的有效氯含量为
您最近一年使用:0次



