名校
1 . 氢氧化铬是一种两性氢氧化物,主要用于制备三价铬盐及三氧化二铬,也可用于油漆、颜料生产及羊毛处理等。利用铬渣(铬以低价态含氧酸盐的形式存在,主要杂质为铁、铝、硅、磷等的化合物)制备氢氧化铬的流程如图。已知:最高价铬酸根离子在酸性介质中以 形式存在,在碱性介质中以
形式存在,在碱性介质中以 形式存在,
形式存在, 在pH>12时开始溶解。下列说法错误的是
在pH>12时开始溶解。下列说法错误的是
 形式存在,在碱性介质中以
形式存在,在碱性介质中以 形式存在,
形式存在, 在pH>12时开始溶解。下列说法错误的是
在pH>12时开始溶解。下列说法错误的是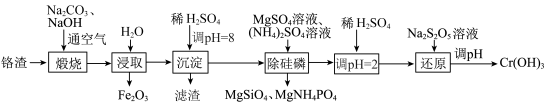
A. 常用作红色涂料 常用作红色涂料 |
B.滤渣中含有 |
C.“煅烧”后铬被氧化为 |
D.“还原”工序发生的反应为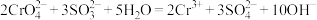 |
您最近一年使用:0次
2 . 铁及其化合物与生产、生活关系密切:
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
(2) 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式_______ 。向反应后的溶液加入_______ (填名称),可回收Cu,并得到 溶液。
溶液。
(3)用废铁皮制取( )的部分流程示意图如下:
)的部分流程示意图如下:_______ 。
(4) 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为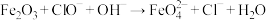 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为_______ 。
(5) 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是_______ 。当该反应转移1.2mol电子时,能产生_______ mol 。
。
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
A. | B. | C. | D. |
(2)
 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式 溶液。
溶液。(3)用废铁皮制取(
 )的部分流程示意图如下:
)的部分流程示意图如下: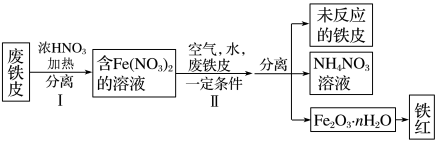
(4)
 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为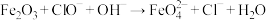 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为(5)
 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是 。
。
您最近一年使用:0次
2024-05-03更新
|
176次组卷
|
2卷引用:福建省晋江市养正中学2023-2024学年高一下学期3月第一次月考化学试题
名校
解题方法
3 . 已知还原性: ,则将
,则将 通入到
通入到 、
、 、
、 的混合溶液中,
的混合溶液中, 、
、 、
、 生成的先后顺序为
生成的先后顺序为
 ,则将
,则将 通入到
通入到 、
、 、
、 的混合溶液中,
的混合溶液中, 、
、 、
、 生成的先后顺序为
生成的先后顺序为A. , , , , | B. , , , , | C. , , , , | D. , , , , |
您最近一年使用:0次
名校
4 . 铬及其化合物在催化、金属防腐等方面具有重要应用。催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
(1)完成化学方程式:_____ 。
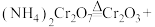 _____+_____。
_____+_____。
(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为_____ (列式表示)。_____ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为_____ 。
(1)完成化学方程式:
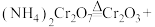 _____+_____。
_____+_____。(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为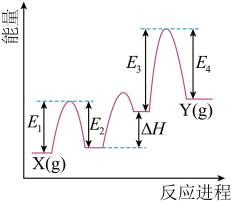
您最近一年使用:0次
名校
5 . 实验室以 溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体
溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体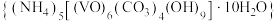 ,装置如图所示。已知:
,装置如图所示。已知: 能被
能被 氧化。下列说法不正确的是
氧化。下列说法不正确的是
 溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体
溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体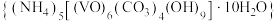 ,装置如图所示。已知:
,装置如图所示。已知: 能被
能被 氧化。下列说法不正确的是
氧化。下列说法不正确的是
A.Ⅱ中的试剂为饱和 溶液 溶液 |
B.实验开始时应先打开活塞 ,一段时间后,再打开活塞 ,一段时间后,再打开活塞 |
| C.Ⅲ中的反应为氧化还原反应 |
D.反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于 保护下的干燥器中,静置过夜,得到晶体 保护下的干燥器中,静置过夜,得到晶体 |
您最近一年使用:0次
2024-04-21更新
|
324次组卷
|
3卷引用:福建省福建师范大学附属中学2023-2024学年高三下学期4月末化学综合模拟测试
名校
6 . 目前汽车安全气囊的气体发生剂主要由叠氮化钠、三氧化二铁、硝酸铵等物质组成,下列说法正确的是
| A.安全气囊打开时,产生的气体只有氮气 |
| B.硝酸铵的作用只是吸收叠氮化钠分解产生的热量 |
| C.三氧化二铁的作用是与金属钠反应,防止钠造成二次伤害 |
| D.硝酸铵性质很稳定 |
您最近一年使用:0次
名校
解题方法
7 . 连二亚硫酸钠( )俗称保险粉,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。
)俗称保险粉,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。
查阅资料:连二亚硫酸钠是一种白色粉末,易溶于水,难溶于乙醇;加热到80℃以上分解并出二氧化硫气体;在空气中能被氧化,是一种强还原剂。
Ⅰ. 的制备
的制备 时选用上图所示装置中的
时选用上图所示装置中的________ (填标号)。选用以下试剂中的________ (填标号)。
A.铜粉 B. 固体 C.98%浓硫酸 D.70%浓硫酸 E.10%稀硫酸
固体 C.98%浓硫酸 D.70%浓硫酸 E.10%稀硫酸
Ⅱ. 的制备
的制备
制用如图所示实验装置(加热、搅拌及夹持装置省略)制备 ,实验步骤如下:
,实验步骤如下: 一段时间;
一段时间;
ii.然后持续通入 ,保持水浴温度75℃左右,反应20min;
,保持水浴温度75℃左右,反应20min;
iii.停止加热,冷却至50℃;
iv.拆卸装置,将d中的混合物进行过滤、洗涤,得到粗产品。
(2)步骤Ⅰ中先通入 的目的是
的目的是________ (答出两点)。
(3)装置d中发生的主要反应的化学方程式为________ 。
(4)步骤iv中“洗涤”时,洗涤剂为________ (填“水”或“乙醇”),进一步提纯 的方法为
的方法为________ 。
Ⅲ.产品纯度的测定
称取纯化后的产品mg溶于水,加入足量 溶液后配成250mL待测液,量取25.00mL待测液于锥形瓶中,滴入2~3滴指示剂亚甲基蓝溶液,用
溶液后配成250mL待测液,量取25.00mL待测液于锥形瓶中,滴入2~3滴指示剂亚甲基蓝溶液,用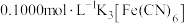 标准溶液进行滴定{已知滴定过程中
标准溶液进行滴定{已知滴定过程中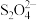 转化为
转化为 ,
, 转化为
转化为 ,杂质不参与反应},达到滴定终点时消耗标准溶液VmL。
,杂质不参与反应},达到滴定终点时消耗标准溶液VmL。
(5)滴定过程中发生反应的离子方程式为________ 。
(6)产品中 的质量分数为
的质量分数为________ 。
(7)下列情况会造成测定结果偏小的是________ (填标号)。
A.盛放待测液的锥形瓶内残留少量蒸馏水
B.未用 标准液润洗酸式滴定管
标准液润洗酸式滴定管
C.滴定终点时俯视读数
 )俗称保险粉,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。
)俗称保险粉,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。查阅资料:连二亚硫酸钠是一种白色粉末,易溶于水,难溶于乙醇;加热到80℃以上分解并出二氧化硫气体;在空气中能被氧化,是一种强还原剂。
Ⅰ.
 的制备
的制备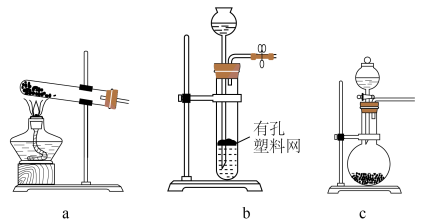
 时选用上图所示装置中的
时选用上图所示装置中的A.铜粉 B.
 固体 C.98%浓硫酸 D.70%浓硫酸 E.10%稀硫酸
固体 C.98%浓硫酸 D.70%浓硫酸 E.10%稀硫酸Ⅱ.
 的制备
的制备制用如图所示实验装置(加热、搅拌及夹持装置省略)制备
 ,实验步骤如下:
,实验步骤如下: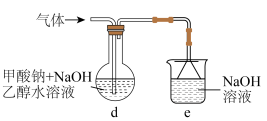
 一段时间;
一段时间;ii.然后持续通入
 ,保持水浴温度75℃左右,反应20min;
,保持水浴温度75℃左右,反应20min;iii.停止加热,冷却至50℃;
iv.拆卸装置,将d中的混合物进行过滤、洗涤,得到粗产品。
(2)步骤Ⅰ中先通入
 的目的是
的目的是(3)装置d中发生的主要反应的化学方程式为
(4)步骤iv中“洗涤”时,洗涤剂为
 的方法为
的方法为Ⅲ.产品纯度的测定
称取纯化后的产品mg溶于水,加入足量
 溶液后配成250mL待测液,量取25.00mL待测液于锥形瓶中,滴入2~3滴指示剂亚甲基蓝溶液,用
溶液后配成250mL待测液,量取25.00mL待测液于锥形瓶中,滴入2~3滴指示剂亚甲基蓝溶液,用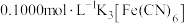 标准溶液进行滴定{已知滴定过程中
标准溶液进行滴定{已知滴定过程中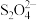 转化为
转化为 ,
, 转化为
转化为 ,杂质不参与反应},达到滴定终点时消耗标准溶液VmL。
,杂质不参与反应},达到滴定终点时消耗标准溶液VmL。(5)滴定过程中发生反应的离子方程式为
(6)产品中
 的质量分数为
的质量分数为(7)下列情况会造成测定结果偏小的是
A.盛放待测液的锥形瓶内残留少量蒸馏水
B.未用
 标准液润洗酸式滴定管
标准液润洗酸式滴定管C.滴定终点时俯视读数
您最近一年使用:0次
2024-04-16更新
|
337次组卷
|
2卷引用:福建省南平市2024届高三联考(一模)化学试题
解题方法
8 . 工业上用软锰矿(主要含 、
、 及铁的氧化物)和铅闪(主要含PbS、
及铁的氧化物)和铅闪(主要含PbS、 、ZnS)为原料联合制取
、ZnS)为原料联合制取 和
和 的流程如下图所示。
的流程如下图所示。_______ 个未成对电子,Mn元素位于元素周期表的______ 区。
(2)提高“酸浸”浸出率可采取的措施有______ (写两条),“冰水沉积”的目的是____________ 。
(3)PbS、MnS、ZnS三种物质在相同条件下,溶度积最大的是______ (填化学式)。
(4)“酸浸”时,PbS与 反应生成
反应生成 和
和 ,写出其反应的离子方程式
,写出其反应的离子方程式____________ 。
(5)“酸浸”时,要尽量防止硫元素转化为单质S,其主要原因是____________ 。
(6)“氧化”时,发生的主要反应的离子方程式为____________ 。
(7)通过 在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式
在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式______________ 。
 、
、 及铁的氧化物)和铅闪(主要含PbS、
及铁的氧化物)和铅闪(主要含PbS、 、ZnS)为原料联合制取
、ZnS)为原料联合制取 和
和 的流程如下图所示。
的流程如下图所示。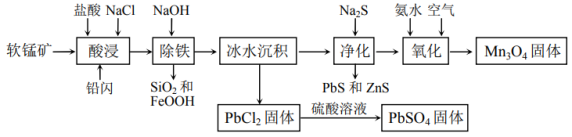
(2)提高“酸浸”浸出率可采取的措施有
(3)PbS、MnS、ZnS三种物质在相同条件下,溶度积最大的是
(4)“酸浸”时,PbS与
 反应生成
反应生成 和
和 ,写出其反应的离子方程式
,写出其反应的离子方程式(5)“酸浸”时,要尽量防止硫元素转化为单质S,其主要原因是
(6)“氧化”时,发生的主要反应的离子方程式为
(7)通过
 在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式
在MnO晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为MnO活化过程,请写出过程Ⅱ的电极反应式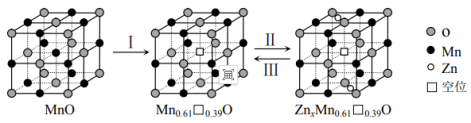
您最近一年使用:0次
2024-04-15更新
|
225次组卷
|
2卷引用:福建省厦门市国祺中学2023-2024学年高三下学期第二次模拟化学试题
9 .  是一种储氢材料,它易与水发生氧化还原反应。缓慢升温至
是一种储氢材料,它易与水发生氧化还原反应。缓慢升温至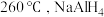 发生如下反应:
发生如下反应:
①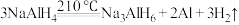
②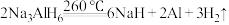
下列说法错误的是
 是一种储氢材料,它易与水发生氧化还原反应。缓慢升温至
是一种储氢材料,它易与水发生氧化还原反应。缓慢升温至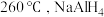 发生如下反应:
发生如下反应:①
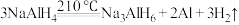
②
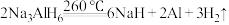
下列说法错误的是
A.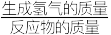 :反应①>反应② :反应①>反应② |
B. 存在离子键、共价键和配位键 存在离子键、共价键和配位键 |
C.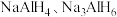 和 和 均易与水反应生成氢气 均易与水反应生成氢气 |
D.反应①生成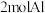 ,有 ,有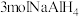 被氧化 被氧化 |
您最近一年使用:0次
2024-04-13更新
|
195次组卷
|
2卷引用:福建省莆田市2024届高三下学期毕业班二模考试化学试题
名校
10 . 在Pt-BaO催化下,NO的“储存-还原”过程如图1所示。其中“还原”过程依次发生反应Ⅰ和反应Ⅱ,各气体的物质的量变化如图2所示。
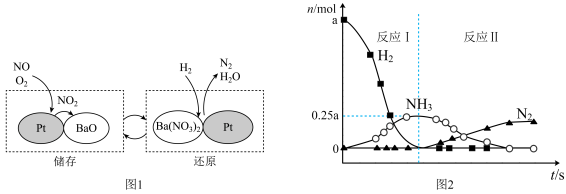
A. 与BaO的反应中, 与BaO的反应中, 既是氧化剂,又是还原剂 既是氧化剂,又是还原剂 |
B.反应Ⅰ为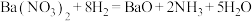 |
C.反应Ⅱ中,最终生成 的物质的量为0.2a mol 的物质的量为0.2a mol |
D.反应Ⅰ和Ⅱ中消耗的 的质量比是3∶5 的质量比是3∶5 |
您最近一年使用:0次
2024-04-10更新
|
597次组卷
|
5卷引用:福建省福州延安中学2024届高三下学期高考第一次模拟化学试题
福建省福州延安中学2024届高三下学期高考第一次模拟化学试题北京市东城区2024届高三一模化学试题北京市第三十五中学2023-2024学年高一下学期(选考)期中测试化学试题(已下线)压轴题02 氧化还原反应的概念及规律(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)北京市第五中学2023-2024学年高一下学期期中考试化学试题



