1 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
_____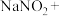 _____
_____ _____
_____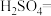 _____
_____ _____
_____ _____
_____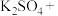 _____
_____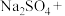 _____
_____
(1)请配平上述化学方程式。____________________
(2)从物质分类角度来看, 属于
属于________ (填字母)。
a.酸 b.酸式盐 c.正盐 d.碱
(3)上述反应的还原剂为________ (填化学式),氧化剂与还原剂的物质的量之比为________ 。
(4)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学方程式,并用单线桥表示其电子转移的方向和数目:_____________________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于
)是一种用途广泛的工业盐,因其外观和食盐相似,有成味,容易误食中毒。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:_____
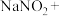 _____
_____ _____
_____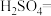 _____
_____ _____
_____ _____
_____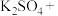 _____
_____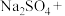 _____
_____
(1)请配平上述化学方程式。
(2)从物质分类角度来看,
 属于
属于a.酸 b.酸式盐 c.正盐 d.碱
(3)上述反应的还原剂为
(4)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列________(填字母)反应中
表现出的性质与下列________(填字母)反应中 表现出的性质完全相同。
表现出的性质完全相同。A. |
B. |
C. |
D. |
您最近一年使用:0次
名校
解题方法
2 .  具有还原性,加碘食盐中的碘元素主要以
具有还原性,加碘食盐中的碘元素主要以 的形式存在,
的形式存在, 、
、 、
、 在一定条件下可发生如图转化关系。下列说法不正确的是
在一定条件下可发生如图转化关系。下列说法不正确的是
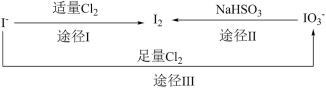
 具有还原性,加碘食盐中的碘元素主要以
具有还原性,加碘食盐中的碘元素主要以 的形式存在,
的形式存在, 、
、 、
、 在一定条件下可发生如图转化关系。下列说法不正确的是
在一定条件下可发生如图转化关系。下列说法不正确的是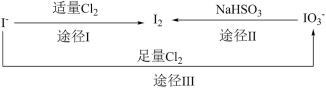
| A.生成等质量的碘,途径I和途径II转移电子数目之比为2∶5 |
B.由图可知氧化性的强弱顺序为 |
C.用淀粉-KI试纸和食醋可检验食盐是否加碘( 遇淀粉呈蓝色) 遇淀粉呈蓝色) |
D.途径Ⅲ反应的离子方程式: |
您最近一年使用:0次
2022-10-12更新
|
611次组卷
|
24卷引用:陕西省咸阳市实验中学2023-2024学年高一上学期段性检测(一)化学试题
陕西省咸阳市实验中学2023-2024学年高一上学期段性检测(一)化学试题山东省德州市2019-2020学年高三上学期期末考试化学试题北京市海淀区2020届高三下学期4月联考化学试题(已下线)考点16 非金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编山东省淄博市部分学校2020届高三6月阶段性诊断考试(二模)化学试题山东省德州市夏津第一中学2019-2020学年高一下学期7月月考化学试题(已下线)1.3.4 氧化还原反应方程式的配平-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)【浙江新东方】HZOMO化学002(已下线)练习2 氧化还原反应-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅰ卷)(已下线)微专题07 氧化性和还原性强弱的实验探究及应用-备战2022年高考化学考点微专题(已下线)第10讲 氯及其化合物(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)章末培优 第1章 物质及其变化-2021-2022学年高一化学课后培优练(人教版2019必修第一册)黑龙江省大庆铁人中学2021-2022学年高一上学期第一次月考化学试题(已下线)必考点05 氧化还原反应的规律及综合判断-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)吉林省吉林实验中学2021-2022学年高三上学期第二次诊断测试化学试题(已下线)微专题08 氧化性和还原性强弱的实验探究及应用-备战2023年高考化学一轮复习考点微专题辽宁省实验中学2022-2023学年高一上学期10月月考化学试题辽宁省实验中学2022-2023学年高一上学期10月份阶段测试化学试题湖南省邵阳市第二中学2022-2023学年高二上学期期中考试化学试题江西省丰城市第九中学2021-2022学年高三上学期第一次月考化学试题【精品卷】1.3.2 氧化剂和还原剂课堂例题-人教版2023-2024学年必修第一册
名校
解题方法
3 . 一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- =Cu2+,还原反应式:2Fe3++2e- =2Fe2+。据此,回答下列问题:
(1)将反应3NO2+H2O=2H++2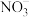 +NO拆写为两个“半反应式”:
+NO拆写为两个“半反应式”:
氧化反应式:_______ 。还原反应式:_______ 。
(2)某化学反应的反应物和产物如下:Al+NaNO3+H2O Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2
①该反应的氧化剂是_______ 。
②该反应的氧化产物是_______ 。
③配平该反应的化学方程式_______ 。
④反应过程中转移300个e-,生成_______ 个N2。
(1)将反应3NO2+H2O=2H++2
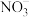 +NO拆写为两个“半反应式”:
+NO拆写为两个“半反应式”:氧化反应式:
(2)某化学反应的反应物和产物如下:Al+NaNO3+H2O
 Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2①该反应的氧化剂是
②该反应的氧化产物是
③配平该反应的化学方程式
Al+ NaNO3+ H2O Al(OH)3+ N2+ NaAlO2
Al(OH)3+ N2+ NaAlO2
④反应过程中转移300个e-,生成
您最近一年使用:0次
名校
4 . 化学与人类生活密切相关。请按要求,回答下列问题:
(1)现有以下生产、生活中常见的物质:
A.铜丝 B.漂白粉[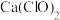 和
和 的固体混合物] C.
的固体混合物] C. 晶体 D.醋酸溶液 E.
晶体 D.醋酸溶液 E. 粉末 F.液氨。
粉末 F.液氨。
①属于电解质是_______ (填写序号,下同)。
②在上述所给状态下能导电的是_______ 。
③E在熔融状态下的电离方程式为_______ 。
(2)生活中消毒剂有多种,如高铁酸钾 等。例如
等。例如 的一种制备过程如下:先在碱性条件下,用
的一种制备过程如下:先在碱性条件下,用 氧化
氧化 来制备
来制备 ,请将该反应的离子方程式配平
,请将该反应的离子方程式配平_______ 。

然后再向制得的 溶液中加入适量的饱和
溶液中加入适量的饱和 溶液会析出
溶液会析出 晶体,写出该反应的离子方程式:
晶体,写出该反应的离子方程式:_______ 。
(1)现有以下生产、生活中常见的物质:
A.铜丝 B.漂白粉[
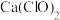 和
和 的固体混合物] C.
的固体混合物] C. 晶体 D.醋酸溶液 E.
晶体 D.醋酸溶液 E. 粉末 F.液氨。
粉末 F.液氨。①属于电解质是
②在上述所给状态下能导电的是
③E在熔融状态下的电离方程式为
(2)生活中消毒剂有多种,如高铁酸钾
 等。例如
等。例如 的一种制备过程如下:先在碱性条件下,用
的一种制备过程如下:先在碱性条件下,用 氧化
氧化 来制备
来制备 ,请将该反应的离子方程式配平
,请将该反应的离子方程式配平
然后再向制得的
 溶液中加入适量的饱和
溶液中加入适量的饱和 溶液会析出
溶液会析出 晶体,写出该反应的离子方程式:
晶体,写出该反应的离子方程式:
您最近一年使用:0次
解题方法
5 . 从砷盐净化渣(主要成分为Cu、As、Zn、ZnO、Co和SiO2)中回收有利用价值的金属,解决了长期以来影响砷盐净化工艺推广的技术难题,具有较强的实践指导意义,其工艺流程如图所示。
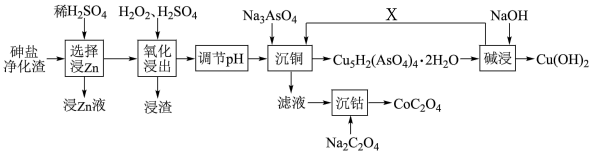
回答下列问题:
(1)在“选择浸Zn”之前,将砷盐净化渣进行粉碎的目的是_______ 。
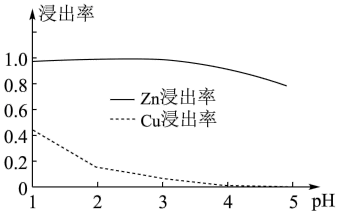
(2)其他条件不变时,Zn和Co的浸出率随pH变化如图所示,则“选择浸Zn”过程中,最好控制溶液的pH=_______ 。
(3)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为_______ 。“浸渣”的主要成分为_______ (填化学式)。
(4)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为_______ 。
(5)为测定草酸钴(CoC2O4)产品的纯度,现称取m g样品,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol·L-1高锰酸钾标准液滴定,达到滴定终点时共消耗V mL高锰酸钾标准液,则该草酸钴产品的纯度为_______ (用含c、V、m的代数式表示)。若酸化时用盐酸代替硫酸,则测得的纯度将_______ (填“偏大”、“偏小”或“无影响”)。

回答下列问题:
(1)在“选择浸Zn”之前,将砷盐净化渣进行粉碎的目的是
(2)其他条件不变时,Zn和Co的浸出率随pH变化如图所示,则“选择浸Zn”过程中,最好控制溶液的pH=

(3)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为
(4)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为
(5)为测定草酸钴(CoC2O4)产品的纯度,现称取m g样品,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol·L-1高锰酸钾标准液滴定,达到滴定终点时共消耗V mL高锰酸钾标准液,则该草酸钴产品的纯度为
您最近一年使用:0次
解题方法
6 . 研究氮的循环和转化对生产、生活有重要的价值。
I.利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如图:

(1)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是____ ;“滤渣”可循环使用,“滤渣”的主要成分是____ (填化学式)。
(2)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,据此信息,小明同学所写的离子反应方程式为2NO +2H+=NO2+NO↑+H2O,有同学认为上述离子方程式不正确,原因是
+2H+=NO2+NO↑+H2O,有同学认为上述离子方程式不正确,原因是____ (用化学方程式表示)。
II.氨氮废水的排放会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对氨氮废水进行处理的流程如图:

已知:HNO2为弱酸,在书写离子方程式时不能拆。
(3)实验室制取NH3的化学方程式为_____ 。
(4)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH →NO
→NO →NO
→NO 的转化,该过程称为硝化反应。过程②在空气中进行,在亚硝酸菌的作用下,NH
的转化,该过程称为硝化反应。过程②在空气中进行,在亚硝酸菌的作用下,NH 转化为HNO2的离子方程式为
转化为HNO2的离子方程式为_____ 。1molNH 可被
可被_____ L(标准状况下)O2最终氧化成NO 。
。
(5)利用微生物处理氨氮废水的优点是_____ 。
I.利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如图:

(1)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是
(2)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,据此信息,小明同学所写的离子反应方程式为2NO
 +2H+=NO2+NO↑+H2O,有同学认为上述离子方程式不正确,原因是
+2H+=NO2+NO↑+H2O,有同学认为上述离子方程式不正确,原因是II.氨氮废水的排放会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对氨氮废水进行处理的流程如图:

已知:HNO2为弱酸,在书写离子方程式时不能拆。
(3)实验室制取NH3的化学方程式为
(4)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH
 →NO
→NO →NO
→NO 的转化,该过程称为硝化反应。过程②在空气中进行,在亚硝酸菌的作用下,NH
的转化,该过程称为硝化反应。过程②在空气中进行,在亚硝酸菌的作用下,NH 转化为HNO2的离子方程式为
转化为HNO2的离子方程式为 可被
可被 。
。(5)利用微生物处理氨氮废水的优点是
您最近一年使用:0次
7 . 绿矾是一种重要的硫酸盐,其化学式为FeSO4•7H2O。某化学兴趣小组对绿矾进行如图探究:
I.验证硫酸亚铁的分解产物。将一定量的绿矾固体脱水处理后置于仪器A中,打开K1和K2,缓缓通入N2,加热至恒重,实验后A中残留物为红色粉末。
[查阅资料]硫酸亚铁的分解产物是一种碱性氧化物、一种酸性氧化物和SO3。
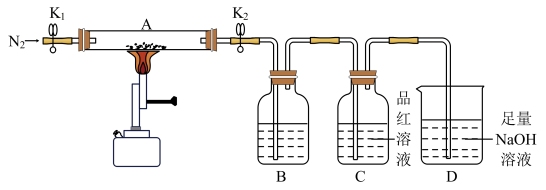
(1)取少量A中红色粉末于试管中,加入稀硫酸使其溶解,向溶液中滴加____ (填化学式)溶液,根据现象判断该红色粉末为Fe2O3。
(2)B、C中有气泡冒出,则B中的溶液为____ (填字母),C中可观察到的现象是____ 。
A.Ba(NO3)2溶液 B.Ba(OH)2溶液 C.BaCl2溶液
(3)若将装置B和装置C的位置互换,是否可行?并说明理由____ 。
II.测定某绿矾样品中FeSO4•7H2O的含量。步骤如下:
①称取上述样品9.0g,溶于适量的稀硫酸中,配成250mL溶液;
②准确量取25.00mL该溶液于锥形瓶中,用0.02000mol•L-1的KMnO4溶液与之完全反应,消耗KMnO4溶液30.00mL(杂质不与KMnO4溶液反应)。
(4)实验室配制FeSO4溶液时,需加入少量Fe粉,目的是_____ (用离子方程式表示)。
(5)步骤②中KMnO4被还原成MnSO4,该反应的离子方程式为_____ 。
(6)该样品中FeSO4•7H2O的质量分数为_____ (结果精确到0.1%)。
I.验证硫酸亚铁的分解产物。将一定量的绿矾固体脱水处理后置于仪器A中,打开K1和K2,缓缓通入N2,加热至恒重,实验后A中残留物为红色粉末。
[查阅资料]硫酸亚铁的分解产物是一种碱性氧化物、一种酸性氧化物和SO3。

(1)取少量A中红色粉末于试管中,加入稀硫酸使其溶解,向溶液中滴加
(2)B、C中有气泡冒出,则B中的溶液为
A.Ba(NO3)2溶液 B.Ba(OH)2溶液 C.BaCl2溶液
(3)若将装置B和装置C的位置互换,是否可行?并说明理由
II.测定某绿矾样品中FeSO4•7H2O的含量。步骤如下:
①称取上述样品9.0g,溶于适量的稀硫酸中,配成250mL溶液;
②准确量取25.00mL该溶液于锥形瓶中,用0.02000mol•L-1的KMnO4溶液与之完全反应,消耗KMnO4溶液30.00mL(杂质不与KMnO4溶液反应)。
(4)实验室配制FeSO4溶液时,需加入少量Fe粉,目的是
(5)步骤②中KMnO4被还原成MnSO4,该反应的离子方程式为
(6)该样品中FeSO4•7H2O的质量分数为
您最近一年使用:0次
名校
8 . 某学习小组探究铜与稀硝酸反应速率变化时,将3.2g铜丝装入注射器(无氧环境)中,再抽取25mL1.35mol·L-1稀硝酸。实验现象:反应开始阶段无明显现象,90min左右才有很少气泡产生,150min左右体系溶液为浅蓝色(反应较慢阶段A),之后逐渐变为绿色(反应较快阶段B),最终溶液呈深蓝色(阶段C)。
(1)铜与稀硝酸反应的离子方程式为____ 。
(2)室温26.6℃,反应过程中最高温度27.8℃;在45℃水浴中重复实验,反应现象变化不大,说明____ 。
(3)为探究铜与1.35mol·L-1稀硝酸在无氧条件下显绿色的原因,分别取A、B、C阶段溶液进行实验。实验操作和现象如表:
查阅资料表明,硝酸在反应过程中首先生成HNO2,已知HNO2是弱酸(电离方程式HNO2 H++NO
H++NO ),遇微热即分解成NO和NO2,NO
),遇微热即分解成NO和NO2,NO 可与Cu2+生成绿色络合离子Cu(NO2)
可与Cu2+生成绿色络合离子Cu(NO2) 。
。
①分析可知溶液中颜色浅蓝→绿→深蓝的原因:反应开始时溶液中c(H+)较大,c(Cu2+)较小,溶液呈浅蓝色;
②反应进行过程中,____ ,且c(Cu2+)增大,与NO 结合生成Cu(NO2)
结合生成Cu(NO2) ,溶液呈绿色;(用平衡移动原理解释)
,溶液呈绿色;(用平衡移动原理解释)
③最后由于____ ,c(NO )减小,c[Cu(NO2)
)减小,c[Cu(NO2) ]减小,而c(Cu2+)较大,溶液呈深蓝色。
]减小,而c(Cu2+)较大,溶液呈深蓝色。
(4)在反应体系温度几乎不变的情况下,反应速率先慢后快,推测反应过程中有催化剂生成,并推测HNO2或NO 是催化剂,请设计实验验证推测:
是催化剂,请设计实验验证推测:____ 。(可供选择的试剂:铜丝、2mol·L-1硝酸、1.35mol·L-1硝酸、NaNO2固体)
(5)可推测反应分为三步进行:Cu+3HNO3=Cu(NO3)2+HNO2+H2O、2HNO2=NO+NO2+H2O和____ 。
(1)铜与稀硝酸反应的离子方程式为
(2)室温26.6℃,反应过程中最高温度27.8℃;在45℃水浴中重复实验,反应现象变化不大,说明
(3)为探究铜与1.35mol·L-1稀硝酸在无氧条件下显绿色的原因,分别取A、B、C阶段溶液进行实验。实验操作和现象如表:
| 序号 | 实验内容 | A溶液(浅蓝色) | B溶液(绿色) | C溶液(深蓝色) |
| 1 | 滴加0.001mol·L-1KMnO4溶液 | 褪色,滴入5~6滴后不再褪色 | 褪色,但滴入20滴后仍褪色 | 褪色,滴入10滴后不再褪色 |
| 2 | 加热较长时间后再滴加0.001mol·L-1KMnO4溶液 | 不褪色 | 不褪色 | 不褪色 |
| 3 | 逐滴滴加稀硫酸 | 无明显现象 | 变蓝色 | 无明显现象 |
| 4 | 逐滴滴加NaOH溶液 | 变浅绿色 | 无明显现象 | 变浅绿色 |
 H++NO
H++NO ),遇微热即分解成NO和NO2,NO
),遇微热即分解成NO和NO2,NO 可与Cu2+生成绿色络合离子Cu(NO2)
可与Cu2+生成绿色络合离子Cu(NO2) 。
。①分析可知溶液中颜色浅蓝→绿→深蓝的原因:反应开始时溶液中c(H+)较大,c(Cu2+)较小,溶液呈浅蓝色;
②反应进行过程中,
 结合生成Cu(NO2)
结合生成Cu(NO2) ,溶液呈绿色;(用平衡移动原理解释)
,溶液呈绿色;(用平衡移动原理解释)③最后由于
 )减小,c[Cu(NO2)
)减小,c[Cu(NO2) ]减小,而c(Cu2+)较大,溶液呈深蓝色。
]减小,而c(Cu2+)较大,溶液呈深蓝色。(4)在反应体系温度几乎不变的情况下,反应速率先慢后快,推测反应过程中有催化剂生成,并推测HNO2或NO
 是催化剂,请设计实验验证推测:
是催化剂,请设计实验验证推测:(5)可推测反应分为三步进行:Cu+3HNO3=Cu(NO3)2+HNO2+H2O、2HNO2=NO+NO2+H2O和
您最近一年使用:0次
2022-09-04更新
|
228次组卷
|
2卷引用:陕西省咸阳市礼泉县第二中学2022-2023学年高三上学期第二次月考化学试题
名校
解题方法
9 . 新冠肺炎期间,化学消毒剂大显身手。高铁酸钾( ,
,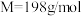 )是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。
)是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。
Ⅰ. 实验室模拟湿法制备高铁酸钾的流程如下:

已知:转化过程发生复分解反应。
回答下列问题:
(1)配制上述 溶液,下列操作可能导致溶液浓度偏大的有
溶液,下列操作可能导致溶液浓度偏大的有_______ (填序号)。
A.将 放在滤纸上称量
放在滤纸上称量
B. 在烧杯中溶解后,未经冷却就立即转移
在烧杯中溶解后,未经冷却就立即转移
C.容量瓶洗净之后未干燥
D.定容时俯视刻度线
E.摇匀后发现液面低于刻度线,再加水至刻度线
(2) 溶液应置于冰水浴中,否则温度升高将发生如下副反应:
溶液应置于冰水浴中,否则温度升高将发生如下副反应: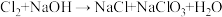 (未配平)
(未配平)
①若有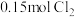 发生该副反应,该过程中转移电子数目为
发生该副反应,该过程中转移电子数目为_______ ;
②若反应后溶液中 和
和 的物质的量之比为
的物质的量之比为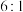 ,则生成
,则生成 和
和 的物质的量之比为
的物质的量之比为_______ 。
(3)氧化过程中溶液保持碱性,写出反应的离子方程式:_______ 。
(4)产品经干燥后得到纯品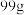 ,则
,则 的产率为
的产率为_______ (用百分数表示)。
 ,
,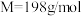 )是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。
)是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。Ⅰ. 实验室模拟湿法制备高铁酸钾的流程如下:

已知:转化过程发生复分解反应。
回答下列问题:
(1)配制上述
 溶液,下列操作可能导致溶液浓度偏大的有
溶液,下列操作可能导致溶液浓度偏大的有A.将
 放在滤纸上称量
放在滤纸上称量B.
 在烧杯中溶解后,未经冷却就立即转移
在烧杯中溶解后,未经冷却就立即转移C.容量瓶洗净之后未干燥
D.定容时俯视刻度线
E.摇匀后发现液面低于刻度线,再加水至刻度线
(2)
 溶液应置于冰水浴中,否则温度升高将发生如下副反应:
溶液应置于冰水浴中,否则温度升高将发生如下副反应: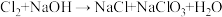 (未配平)
(未配平)①若有
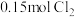 发生该副反应,该过程中转移电子数目为
发生该副反应,该过程中转移电子数目为②若反应后溶液中
 和
和 的物质的量之比为
的物质的量之比为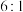 ,则生成
,则生成 和
和 的物质的量之比为
的物质的量之比为(3)氧化过程中溶液保持碱性,写出反应的离子方程式:
(4)产品经干燥后得到纯品
 ,则
,则 的产率为
的产率为
您最近一年使用:0次
10 . 二氧化氯 是一种优良的消毒剂,可用氯酸钠和双氧水在酸性条件下反应制备:
是一种优良的消毒剂,可用氯酸钠和双氧水在酸性条件下反应制备: (未配平)。下列说法正确的是
(未配平)。下列说法正确的是
 是一种优良的消毒剂,可用氯酸钠和双氧水在酸性条件下反应制备:
是一种优良的消毒剂,可用氯酸钠和双氧水在酸性条件下反应制备: (未配平)。下列说法正确的是
(未配平)。下列说法正确的是A.每转移1mol电子,生成标准状况下11.2L |
B. 是氧化剂,发生氧化反应 是氧化剂,发生氧化反应 |
C. 是还原产物 是还原产物 |
D.产物中 与 与 的物质的量之比为1∶2 的物质的量之比为1∶2 |
您最近一年使用:0次
2022-07-07更新
|
1751次组卷
|
12卷引用:陕西省咸阳市2021-2022学年高一下学期期末考试化学试题
陕西省咸阳市2021-2022学年高一下学期期末考试化学试题江西省赣州市于都县第二中学等六校2021-2022学年高二下学期期中考试化学试题河南省洛阳创新发展联盟2023届高三摸底考试化学试题云南省楚雄州2021-2022学年高二下学期期末考试化学试题河南省豫南名校2021-2022学年高二下学期期末联考化学试题(已下线)第二章《海水中的重要元素----钠和氯》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)福建省莆田第一中学2022-2023学年高一上学期12月月考化学试题(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题突破卷01 化学计量?-2024年高考化学一轮复习考点通关卷(新教材新高考)河北省张家口市宣化第一中学2022-2023学年高一上学期12月月考化学试题陕西省商洛市洛南中学2023-2024学年高一上学期第二次月考化学试题贵州省毕节市金沙县实验高级中学2023-2024学年高一上学期第三次月考化学试卷



