1 . 某工业废气中的 经如图中的两个循环可分别得到S和
经如图中的两个循环可分别得到S和 。下列说法正确的是
。下列说法正确的是
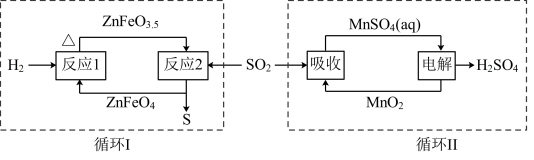
 经如图中的两个循环可分别得到S和
经如图中的两个循环可分别得到S和 。下列说法正确的是
。下列说法正确的是
A.循环I中,反应1中的氧化产物为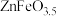 |
B.循环I中,反应2中的还原产物为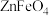 |
C. 可作为循环II中吸收 可作为循环II中吸收 的还原剂 的还原剂 |
D.循环I和循环II中消耗同质量的 ,理论上得到S和 ,理论上得到S和 的质量之比为16∶49 的质量之比为16∶49 |
您最近一年使用:0次
2022-05-31更新
|
188次组卷
|
3卷引用:陕西省咸阳市实验中学2022-2023学年高一上学期第一次月考化学试题
解题方法
2 . 空间站中的物质循环利用是重要研究课题。关于如下“转化图”,说法正确的是


| A.Sabatier反应器中反应的氧化剂与还原剂物质的量之比为1∶4 |
| B.水电解系统的阳极产物应该输送进入Sabatier反应器 |
| C.采用高压和合适催化剂均有利于提高Sabatier反应器中的反应 |
| D.由图可知,该系统中H2O的循环利用率为100% |
您最近一年使用:0次
2022-05-27更新
|
284次组卷
|
4卷引用:陕西省咸阳市2021-2022学年高二下学期期末考试化学试题
陕西省咸阳市2021-2022学年高二下学期期末考试化学试题山东省名校联盟2022届高三下学期5月模拟考试化学试题(已下线)第09练 以隔膜在电化学中的功能突破电解原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)1.3.1 氧化还原反应的基本概念(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)
3 . 某同学为探究元素周期表中元素性质的递变规律,进行了如下系列实验。回答问题:
探究1:验证氯元素的非金属性比硫元素的非金属性强。设计实验如图:

(1)装置A中盛放的试剂是____ (填字母),A中发生反应的化学方程式为____ 。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据是____ (填字母)。
探究2:验证同主族元素原子得电子能力强弱,进行如下实验:
I.向NaBr溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
II.向KI溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
III.在淀粉碘化钾试纸上滴加几滴溴水。
(3)实验I中的现象是____ 。
(4)根据I、II、III的实验现象可得Cl、Br、I的得电子能力强弱顺序为____ 。
(5)实验I、II得到的CCl4层中含有卤素单质,可用NaOH浓溶液反萃取分离回收。以下是反萃取回收I2的操作过程:
①向装有I2的CCl4溶液的分液漏斗中加入少量浓NaOH溶液;
②振荡至溶液的紫红色消失,静置、分层;
③先将CCl4层从仪器的下口放出,再将含I-、IO 的碱溶液从仪器的
的碱溶液从仪器的____ (填“上”或“下”)口倒入烧杯中;
④边搅拌边加入几滴45%的H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体,写出该反应的离子方程式____ 。
探究1:验证氯元素的非金属性比硫元素的非金属性强。设计实验如图:

(1)装置A中盛放的试剂是
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据是
| A.HCl比H2S稳定 | B.铁与Cl2反应生成FeCl3,而铁与硫反应生成FeS |
| C.HClO4的酸性比H2SO4的强 | D.HClO的氧化性比H2SO3的强 |
探究2:验证同主族元素原子得电子能力强弱,进行如下实验:
I.向NaBr溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
II.向KI溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
III.在淀粉碘化钾试纸上滴加几滴溴水。
(3)实验I中的现象是
(4)根据I、II、III的实验现象可得Cl、Br、I的得电子能力强弱顺序为
(5)实验I、II得到的CCl4层中含有卤素单质,可用NaOH浓溶液反萃取分离回收。以下是反萃取回收I2的操作过程:
①向装有I2的CCl4溶液的分液漏斗中加入少量浓NaOH溶液;
②振荡至溶液的紫红色消失,静置、分层;
③先将CCl4层从仪器的下口放出,再将含I-、IO
 的碱溶液从仪器的
的碱溶液从仪器的④边搅拌边加入几滴45%的H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体,写出该反应的离子方程式
您最近一年使用:0次
名校
4 . 国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
实验步骤如图1:

I.向B中加入300.00mL葡萄酒和适量稀硫酸,加热,使SO2全部逸出并与C中的H2O2完全反应,加热除去H2O2,得到待测液并稀释至500mL。
II.取25.00mL待测液于锥形瓶中,加入指示剂,用0.0100mol·L-1NaOH标准溶液进行滴定。
III.数据处理。
回答下列问题:
(1)仪器A的名称为____ 。
(2)写出C中发生的离子反应方程式_____ 。
(3)NaOH标准溶液盛装在图2____ (填“甲”或“乙”)滴定管中。若滴定终点溶液pH为8.8,则选择的指示剂为____ ;滴定过程中,眼睛应注视____ ;滴定终点的判断依据为____ 。

(4)根据下列表格中的数据计算该葡萄酒中SO2含量为___ g•L-1。
(5)下列操作会导致实验结果偏低的是____ (填字母)。
a.滴定管在装液前未用标准溶液润洗
b.滴定过程中,锥形瓶振荡得太剧烈,锥形瓶内有液滴溅出
c.达到滴定终点时,仰视读数
d.装标准溶液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
实验步骤如图1:

I.向B中加入300.00mL葡萄酒和适量稀硫酸,加热,使SO2全部逸出并与C中的H2O2完全反应,加热除去H2O2,得到待测液并稀释至500mL。
II.取25.00mL待测液于锥形瓶中,加入指示剂,用0.0100mol·L-1NaOH标准溶液进行滴定。
III.数据处理。
回答下列问题:
(1)仪器A的名称为
(2)写出C中发生的离子反应方程式
(3)NaOH标准溶液盛装在图2

(4)根据下列表格中的数据计算该葡萄酒中SO2含量为
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.10 | 7.60 |
| 2 | 25.00 | 7.60 | 15.00 |
| 3 | 25.00 | 0.20 | 7.80 |
a.滴定管在装液前未用标准溶液润洗
b.滴定过程中,锥形瓶振荡得太剧烈,锥形瓶内有液滴溅出
c.达到滴定终点时,仰视读数
d.装标准溶液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
您最近一年使用:0次
2022-05-01更新
|
23次组卷
|
2卷引用:陕西省咸阳市实验中学2021-2022学年高二上学期第三次月考化学试题
名校
解题方法
5 . 某校化学兴趣小组探究 与
与 溶液的反应,装置如图所示。
溶液的反应,装置如图所示。
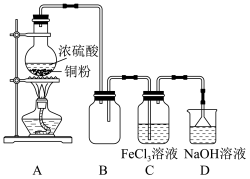
(1)①A装置中制备 的化学方程式为
的化学方程式为_______ ;②装置B的作用_______ 。
(2)该小组同学预测 与
与 溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:
溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:_______ (用离子方程式表示)。
(3)该小组探究实验的具体步骤如下:
根据步骤Ⅰ、Ⅱ、Ⅲ的现象,该小组学查阅资料获知:
ⅰ.生成红棕色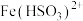 离子的反应为:
离子的反应为:
ⅱ.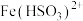 离子可以将
离子可以将 还原为
还原为
③溶液中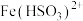 与
与 反应的离子方程式为
反应的离子方程式为_______
④由上述实验可知 与
与 溶液反应生成
溶液反应生成 所需时间较长,缩短该反应所用时间可以采取的措施
所需时间较长,缩短该反应所用时间可以采取的措施_______ (任写两条)
 与
与 溶液的反应,装置如图所示。
溶液的反应,装置如图所示。
(1)①A装置中制备
 的化学方程式为
的化学方程式为(2)该小组同学预测
 与
与 溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:
溶液反应的现象为溶液由棕黄色变成浅绿色。该小组同学预测的理论依据为:(3)该小组探究实验的具体步骤如下:
| 步骤 | 现象 | 结论 |
Ⅰ。取   溶液于装置C中,并连接好装置,通入 溶液于装置C中,并连接好装置,通入 至饱和。 至饱和。 | 溶液很快由黄色变为红棕色。 | |
| Ⅱ.用激光笔照射步骤Ⅰ中的红棕色溶液。 | 溶液中无明显光路。 | ①红棕色溶液不是 |
| Ⅲ.将步骤Ⅰ中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色。 | ②溶液中有 |
ⅰ.生成红棕色
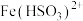 离子的反应为:
离子的反应为:
ⅱ.
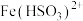 离子可以将
离子可以将 还原为
还原为
③溶液中
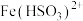 与
与 反应的离子方程式为
反应的离子方程式为④由上述实验可知
 与
与 溶液反应生成
溶液反应生成 所需时间较长,缩短该反应所用时间可以采取的措施
所需时间较长,缩短该反应所用时间可以采取的措施
您最近一年使用:0次
2022-04-04更新
|
584次组卷
|
4卷引用:陕西省咸阳市武功县普集高级中学2021-2022学年高三上学期期末考试化学试题
陕西省咸阳市武功县普集高级中学2021-2022学年高三上学期期末考试化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)辽宁省渤海大学附属高级中学2021-2022学年高一下学期第二次阶段性考试化学试题
6 . 氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应: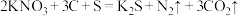 。其中被氧化的元素是
。其中被氧化的元素是___________ ,还原产物是___________ 。
(2)汽车尾气中存在CO、 、NO、
、NO、 四种气体,据此写出一个完整的化学方程式:2
四种气体,据此写出一个完整的化学方程式:2___________ 
___________ 。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:
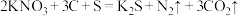 。其中被氧化的元素是
。其中被氧化的元素是(2)汽车尾气中存在CO、
 、NO、
、NO、 四种气体,据此写出一个完整的化学方程式:2
四种气体,据此写出一个完整的化学方程式:2
您最近一年使用:0次
名校
解题方法
7 . 钛是一种银白色的过渡金属,其密度小、强度高、具有金属光泽,亦有良好的抗腐蚀能力(包括海水、王水及氯气等)。由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱,以及高强度、低密度的特点,被美誉为“太空金属”。工业上可用钛磁铁矿(主要成分是 ,含有少量的
,含有少量的 、
、 、
、 、
、 、MgO)制备高纯度的金属钛,其工艺流程如下:
、MgO)制备高纯度的金属钛,其工艺流程如下:

资料:
①浸出液中含钛阳离子主要是 ,
, 的水解产物是
的水解产物是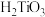 。
。
②常见氯化物的物理性质如下表所示:
(1)利用___________ 的磁性,可通过磁选将其从钛磁铁矿分离。在磁选之前需对钛磁铁矿进行粉碎、磨粉等预处理,其作用是___________ 。
(2)水解过程发生主要反应的化学方程式是___________ ,通过对浸出液浓度的调控,可以获得不同粒子直径的产品。一般情况下,粒子直径越小,煅烧得到的钛白粉品质越高,但钛液的利用率降低。工业上通常用170g/L的浸出液(钛液)进行水解,其原因是___________ 。

(3)氯化可以得到较高纯度的 ,同时生成一种可燃性气体,其反应化学方程式为
,同时生成一种可燃性气体,其反应化学方程式为___________ ,蒸馏精制过程中应该控制温度高于___________ ℃,低于___________ ℃。
(4)过去几年,电解还原 制备Ti有了新的突破,
制备Ti有了新的突破, 的电解效率取决于其阳极组成(C/O比),在
的电解效率取决于其阳极组成(C/O比),在 时,它几乎可以100%地溶解。该电解过程如下图所示,阳极反应式为
时,它几乎可以100%地溶解。该电解过程如下图所示,阳极反应式为___________ 。

 ,含有少量的
,含有少量的 、
、 、
、 、
、 、MgO)制备高纯度的金属钛,其工艺流程如下:
、MgO)制备高纯度的金属钛,其工艺流程如下:
资料:
①浸出液中含钛阳离子主要是
 ,
, 的水解产物是
的水解产物是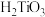 。
。②常见氯化物的物理性质如下表所示:
| 化合物 |  |  |  |  |
| 熔点/℃ | -25 | 193 | 304 | 714 |
| 沸点/℃ | 136 | 181(升华) | 316 | 1412 |
(2)水解过程发生主要反应的化学方程式是

(3)氯化可以得到较高纯度的
 ,同时生成一种可燃性气体,其反应化学方程式为
,同时生成一种可燃性气体,其反应化学方程式为(4)过去几年,电解还原
 制备Ti有了新的突破,
制备Ti有了新的突破, 的电解效率取决于其阳极组成(C/O比),在
的电解效率取决于其阳极组成(C/O比),在 时,它几乎可以100%地溶解。该电解过程如下图所示,阳极反应式为
时,它几乎可以100%地溶解。该电解过程如下图所示,阳极反应式为
您最近一年使用:0次
2021-12-30更新
|
524次组卷
|
4卷引用:陕西省咸阳市2023届高三下学期高考模拟检测(三)理综化学试题
8 . 疫情期间,某项目化学学习小组开展了对84消毒液使用安全性的研究。查找资料可知:
①84消毒液有效成分为NaClO。含氯消毒剂中HClO的消毒效果远高于ClO-,而ClO-的稳定性要高于HClO。
②HClO的K=2.0×10-8;H2CO3的K1=4.3×10-7,K2=5.6×10-11。
请回答下列问题:
(1)在84消毒液中滴加几滴酚酞试液,可观察到的现象是_______ 。
(2)通常购买的84消毒液pH在12左右,目的是增强消毒液的稳定性,试从平衡的角度分析原因_______ 。
(3)84消毒液必须避光密封保存,目的是防止与空气中的二氧化碳反应而变质,试写出该反应的离子方程式:_______ 。
(4)为了研究消毒效果,同学们测定了84消毒液中Cl2、HClO和ClO-三种微粒的物质的量分数随pH变化的关系,如图所示。
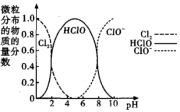
根据图示同学们认为在使用84消毒液时应调节pH在4~6范围内,试说明原因_______ 。
(5)84消毒液还可作为水处理剂除去水中的杂质离子。例如过量次氯酸钠可使酸性废水中 完全转化为N2,请写出相应的离子反应方程式:
完全转化为N2,请写出相应的离子反应方程式:_______ 。若处理废水产生了0.448LN2(标准状况),则需消耗有效氯为5%的84消毒液的质量为_______ g。(“有效氯”指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,常以百分数表示)
①84消毒液有效成分为NaClO。含氯消毒剂中HClO的消毒效果远高于ClO-,而ClO-的稳定性要高于HClO。
②HClO的K=2.0×10-8;H2CO3的K1=4.3×10-7,K2=5.6×10-11。
请回答下列问题:
(1)在84消毒液中滴加几滴酚酞试液,可观察到的现象是
(2)通常购买的84消毒液pH在12左右,目的是增强消毒液的稳定性,试从平衡的角度分析原因
(3)84消毒液必须避光密封保存,目的是防止与空气中的二氧化碳反应而变质,试写出该反应的离子方程式:
(4)为了研究消毒效果,同学们测定了84消毒液中Cl2、HClO和ClO-三种微粒的物质的量分数随pH变化的关系,如图所示。

根据图示同学们认为在使用84消毒液时应调节pH在4~6范围内,试说明原因
(5)84消毒液还可作为水处理剂除去水中的杂质离子。例如过量次氯酸钠可使酸性废水中
 完全转化为N2,请写出相应的离子反应方程式:
完全转化为N2,请写出相应的离子反应方程式:
您最近一年使用:0次
名校
解题方法
9 . 市政污泥含大量金属(Cu、Zn、Ni、Fe、Ag等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并完全可以作为资源再次为我们所利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾(ZnSO4·7H2O )的工艺流程如下:
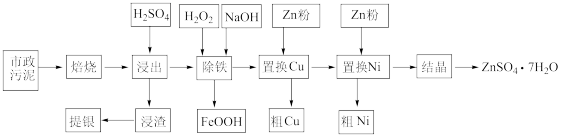
已知:除铁时若PH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀,回答下列问题:
(1)为提高“浸出”效率,可采取的措施有___________ 、___________ (写两条)。
(2)根据流程图可知 Cu 、Zn、Ni的金属性强弱顺序为___________ 。
(3)置换镍时,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为___________ 。
(4)“浸出”的浸渣中含有Ag2S,经一系列处理得Ag(NH3)2Cl,用肼(N2H4)还原Ag(NH3)2Cl得到单质银,N2H4的氧化产物为N2,则还原过程中氧化剂与还原剂的物质的量之比为___________ 。
(5)浸出液中含有Fe2+,“除铁”步骤中发生反应的离子方程式为___________ 。调节PH对不同金属沉出率的影响如下图所示,则沉铁时最合理的PH约为___________ 。在PH<6时,Zn2+、Cu2+、Ni2+在溶液中以离子形式存在,但是有铁离子存在时,PH升高,Zn、Cu、Ni损失率均升高,原因可能是___________ 。
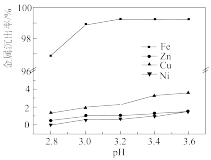

已知:除铁时若PH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀,回答下列问题:
(1)为提高“浸出”效率,可采取的措施有
(2)根据流程图可知 Cu 、Zn、Ni的金属性强弱顺序为
(3)置换镍时,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为
(4)“浸出”的浸渣中含有Ag2S,经一系列处理得Ag(NH3)2Cl,用肼(N2H4)还原Ag(NH3)2Cl得到单质银,N2H4的氧化产物为N2,则还原过程中氧化剂与还原剂的物质的量之比为
(5)浸出液中含有Fe2+,“除铁”步骤中发生反应的离子方程式为

您最近一年使用:0次
2021-11-29更新
|
963次组卷
|
5卷引用:陕西省武功县普集高中2021-2022学年高三上学期第四次月考化学试题
陕西省武功县普集高中2021-2022学年高三上学期第四次月考化学试题四川省遂宁市2021-2022学年高三上学期零诊考试化学试题(已下线)一轮巩固卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)(已下线)一轮巩固卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)(已下线)2022年全国甲卷高考真题变式题(非选择题)
10 . 氧化还原反应在物质制备、能量转化方面有重要的应用。
(1)用单线桥法表示下列反应的电子转移方向和数目。___________

(2)反应 常用于测定溶液中I2的含量。反应的还原剂是
常用于测定溶液中I2的含量。反应的还原剂是___________ ,每生成1moLNaI,反应转移电子___________ mol。
(3)反应 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中氧化剂与还原剂的物质的量之比为___________ 。
(4)高铁酸钾(K2FeO4)可作为高效、多功能水处理剂。用FeCl3与KClO在强碱条件下反应可制取高铁酸钾,完成反应的离子方程式。___________
2Fe3++______ClO-+______OH-=______FeO +3Cl-+______
+3Cl-+______
(1)用单线桥法表示下列反应的电子转移方向和数目。

(2)反应
 常用于测定溶液中I2的含量。反应的还原剂是
常用于测定溶液中I2的含量。反应的还原剂是(3)反应 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中氧化剂与还原剂的物质的量之比为
(4)高铁酸钾(K2FeO4)可作为高效、多功能水处理剂。用FeCl3与KClO在强碱条件下反应可制取高铁酸钾,完成反应的离子方程式。
2Fe3++______ClO-+______OH-=______FeO
 +3Cl-+______
+3Cl-+______
您最近一年使用:0次
2021-11-23更新
|
144次组卷
|
2卷引用:陕西省武功县2021-2022学年高一上学期期中考试化学试题



