名校
1 . 铬及其化合物在催化、金属防腐等方面具有重要应用。催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
(1)完成化学方程式:_____ 。
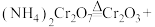 _____+_____。
_____+_____。
(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为_____ (列式表示)。_____ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为_____ 。
(1)完成化学方程式:
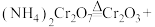 _____+_____。
_____+_____。(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为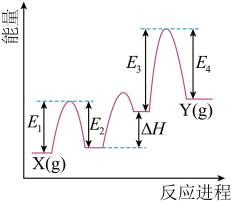
您最近半年使用:0次
名校
2 . “氨的催化氧化”是工业生产硝酸的重要步骤,某化学课外活动小组设计模拟该实验过程,用水吸收制取硝酸,并用硝酸制取 晶体:
晶体:  制取
制取 和
和 的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为
的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为 ________ (写化学式)。
(2)装置A制得的混合气体需要干燥,请选择合适的干燥剂_____ 。 填字母代号
填字母代号
a.浓硫酸 b.无水氯化钙 c.碱石灰
(3)氨气在装置 中发生催化氧化,若条件控制不当,
中发生催化氧化,若条件控制不当, 中可能发生副反应,
中可能发生副反应, 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 ,该副反应的化学方程式为
,该副反应的化学方程式为_____ 。
(4)若产生的氮氧化物尾气 含
含 、
、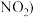 用氨气为还原剂进行催化还原,主要反应如下:
用氨气为还原剂进行催化还原,主要反应如下:
①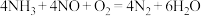 ②
②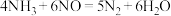
当反应温度过高时, 会发生以下反应:
会发生以下反应:
③ ④
④
随着反应温度升高,脱硝效率降低的原因可能是______ 。
(5)可用 将氮氧化物转化成
将氮氧化物转化成 。向含
。向含 的溶液中加入
的溶液中加入 溶液调节至碱性,
溶液调节至碱性, 转化为去除氮氧化物效果更好的
转化为去除氮氧化物效果更好的 ,再通入
,再通入 气体进行反应。碱性条件下
气体进行反应。碱性条件下 去除
去除 反应的离子方程式为
反应的离子方程式为 ______ 。
(6)设计以某工业废水(含 、
、 、
、 )为原料,制取
)为原料,制取 晶体的实验方案:
晶体的实验方案:_____  的溶解度曲线如图
的溶解度曲线如图 所示;实验中须使用的试剂:稀
所示;实验中须使用的试剂:稀 、
、 溶液
溶液 。
。
 晶体:
晶体: 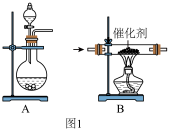
 制取
制取 和
和 的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为
的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为 (2)装置A制得的混合气体需要干燥,请选择合适的干燥剂
 填字母代号
填字母代号
a.浓硫酸 b.无水氯化钙 c.碱石灰
(3)氨气在装置
 中发生催化氧化,若条件控制不当,
中发生催化氧化,若条件控制不当, 中可能发生副反应,
中可能发生副反应, 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 ,该副反应的化学方程式为
,该副反应的化学方程式为(4)若产生的氮氧化物尾气
 含
含 、
、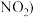 用氨气为还原剂进行催化还原,主要反应如下:
用氨气为还原剂进行催化还原,主要反应如下: ①
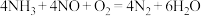 ②
②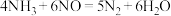
当反应温度过高时,
 会发生以下反应:
会发生以下反应: ③
 ④
④
随着反应温度升高,脱硝效率降低的原因可能是
(5)可用
 将氮氧化物转化成
将氮氧化物转化成 。向含
。向含 的溶液中加入
的溶液中加入 溶液调节至碱性,
溶液调节至碱性, 转化为去除氮氧化物效果更好的
转化为去除氮氧化物效果更好的 ,再通入
,再通入 气体进行反应。碱性条件下
气体进行反应。碱性条件下 去除
去除 反应的离子方程式为
反应的离子方程式为 (6)设计以某工业废水(含
 、
、 、
、 )为原料,制取
)为原料,制取 晶体的实验方案:
晶体的实验方案: 的溶解度曲线如图
的溶解度曲线如图 所示;实验中须使用的试剂:稀
所示;实验中须使用的试剂:稀 、
、 溶液
溶液 。
。
您最近半年使用:0次
名校
解题方法
3 . 工业上常以天青石(主要成分为SrSO4,含少量BaSO4)为原料制取SrCl2·6H2O,生产流程如下:
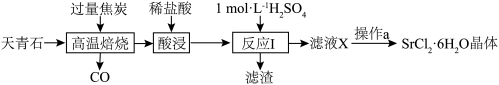
A.高温焙烧时,若0.2molSrSO4完全反应转移了1.6mol电子,该反应化学方程式为SrSO4+4C SrS+4CO↑ SrS+4CO↑ |
| B.反应Ⅰ中,应使用过量的H2SO4来提高锶元素的利用率 |
| C.为除去SrCl2·6H2O晶体表面杂质,可使用无水乙醇洗涤 |
| D.为得到无水SrCl2,可直接加热SrCl2·6H2O脱去结晶水制得 |
您最近半年使用:0次
名校
解题方法
4 . 工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: 难溶于水;
难溶于水;
②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1) 中Cu的化合价为
中Cu的化合价为___________ ,酸浸过程中, 反应的离子方程式
反应的离子方程式___________ 。
(2)检验“酸浸”液中是否含 ,可选择
,可选择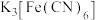 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是___________ 。
(3)氧化后,从反应体系中分离出 粗产品的操作名称是
粗产品的操作名称是___________ 。
(4)上述流程中,基态原子未成对电子数最多的金属元素名称是___________ 。
(5)向 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式___________ 。
(6)已知常温下, ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: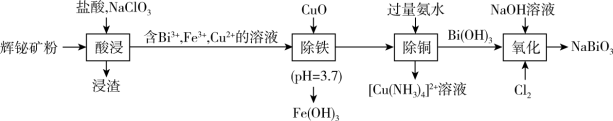
 难溶于水;
难溶于水;②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1)
 中Cu的化合价为
中Cu的化合价为 反应的离子方程式
反应的离子方程式(2)检验“酸浸”液中是否含
 ,可选择
,可选择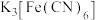 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是(3)氧化后,从反应体系中分离出
 粗产品的操作名称是
粗产品的操作名称是(4)上述流程中,基态原子未成对电子数最多的金属元素名称是
(5)向
 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式(6)已知常温下,
 ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=
您最近半年使用:0次
5 . 二氧化氯 常温常压下为气体,是一种高效的消毒剂,也可用于某些污染物的处理。
常温常压下为气体,是一种高效的消毒剂,也可用于某些污染物的处理。
Ⅰ. 的制备:
的制备:
(1)工业上采用亚氯酸钠 溶液和盐酸混合制取
溶液和盐酸混合制取 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
(2)用题图1所示装置进行电解(电极不反应),也可制得 。
。
_______ (填“减小”“增大”或“不变”)。
②阴极上产生 的机理如题图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为
的机理如题图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为_______ 。
Ⅱ. 的用途:
的用途:
(3) 可用于果蔬保鲜。
可用于果蔬保鲜。 使用时常用稳定剂来吸收、转化。不同稳定剂释放出
使用时常用稳定剂来吸收、转化。不同稳定剂释放出 浓度随时间变化趋势如题图3所示,其中效果较好的稳定剂是
浓度随时间变化趋势如题图3所示,其中效果较好的稳定剂是_______ (填“稳定剂Ⅰ”或“稳定剂Ⅱ”),原因是_______ 。 可用于去除水体中
可用于去除水体中 。某实验小组用弱碱性溶液模拟实际水体消毒过程中
。某实验小组用弱碱性溶液模拟实际水体消毒过程中 和
和 的反应,实验结果发现溶液中有黑色浑浊产生,溶液中微粒浓度变化如题图4所示。
的反应,实验结果发现溶液中有黑色浑浊产生,溶液中微粒浓度变化如题图4所示。 内,发生的主要反应的离子方程式为
内,发生的主要反应的离子方程式为_______ 。
②在 时,耗氯量增幅较大的可能原因是
时,耗氯量增幅较大的可能原因是_______ 。
 常温常压下为气体,是一种高效的消毒剂,也可用于某些污染物的处理。
常温常压下为气体,是一种高效的消毒剂,也可用于某些污染物的处理。Ⅰ.
 的制备:
的制备:(1)工业上采用亚氯酸钠
 溶液和盐酸混合制取
溶液和盐酸混合制取 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(2)用题图1所示装置进行电解(电极不反应),也可制得
 。
。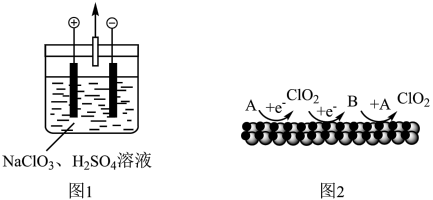

②阴极上产生
 的机理如题图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为
的机理如题图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为Ⅱ.
 的用途:
的用途:(3)
 可用于果蔬保鲜。
可用于果蔬保鲜。 使用时常用稳定剂来吸收、转化。不同稳定剂释放出
使用时常用稳定剂来吸收、转化。不同稳定剂释放出 浓度随时间变化趋势如题图3所示,其中效果较好的稳定剂是
浓度随时间变化趋势如题图3所示,其中效果较好的稳定剂是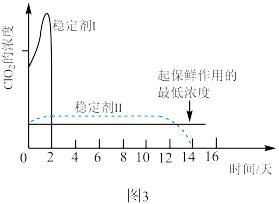
 可用于去除水体中
可用于去除水体中 。某实验小组用弱碱性溶液模拟实际水体消毒过程中
。某实验小组用弱碱性溶液模拟实际水体消毒过程中 和
和 的反应,实验结果发现溶液中有黑色浑浊产生,溶液中微粒浓度变化如题图4所示。
的反应,实验结果发现溶液中有黑色浑浊产生,溶液中微粒浓度变化如题图4所示。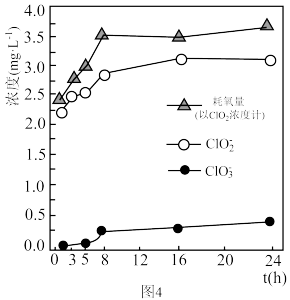
 内,发生的主要反应的离子方程式为
内,发生的主要反应的离子方程式为②在
 时,耗氯量增幅较大的可能原因是
时,耗氯量增幅较大的可能原因是
您最近半年使用:0次
名校
解题方法
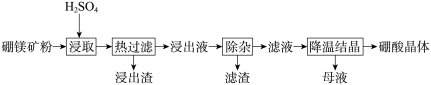
6 . 硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO•B2O3•H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:
②298K下,常见金属氢氧化物的溶度积常数如下表:
(1)“浸取”时2MgO•B2O3•H2O发生的反应的化学方程式为___________ 。
(2)“浸取”后,采用“热过滤”的目的是___________ ,“浸出渣”的成分为___________ (填化学式)。
(3)“浸出液”显酸性, “除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是___________ 。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的措施是将“母液”蒸发浓缩后,最佳结晶条件是___________。
| 温度 |  |  |  |  |
| 溶解度 | 5.0g | 8.7g | 14.8g | 40.2g |
| Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
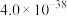 | 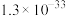 | 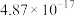 | 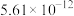 |
(1)“浸取”时2MgO•B2O3•H2O发生的反应的化学方程式为
(2)“浸取”后,采用“热过滤”的目的是
(3)“浸出液”显酸性, “除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的措施是将“母液”蒸发浓缩后,最佳结晶条件是___________。
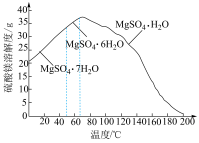
| A.升温结晶 | B.降温结晶 | C.加压升温结晶 | D.降压降温结晶 |
您最近半年使用:0次
名校
解题方法
7 . 2020年10月,洛阳师范学院先进功能材料团队,在过渡金属硫族化合物(TMD)材料领域研究取得新进展, 是一种典型的TMD材料,
是一种典型的TMD材料, 与石墨相似具有层状结构。其工艺制备流程如下图所示:
与石墨相似具有层状结构。其工艺制备流程如下图所示: 结构类似于
结构类似于 ,与酸反应时先生成
,与酸反应时先生成 类似于
类似于 ,易分解。
,易分解。
② 不溶于盐酸和氢氟酸。
不溶于盐酸和氢氟酸。
③辉钼矿(主要成分为 ,还含有
,还含有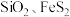 及不溶于酸碱且难以氧化的杂质)。
及不溶于酸碱且难以氧化的杂质)。
(1) 可用于制纳米颗粒润滑油,是由于
可用于制纳米颗粒润滑油,是由于___________ 。
(2)由题目已知条件分析 属于
属于___________ 晶体(填“分子”“离子”“共价”或“混合型”),该晶体内含有___________ 作用力。
A.范德华力 B.氢键 C.极性共价键 D.离子键 E.非极性共价键
(3)“酸浸”时,辉钼矿中的___________ (写化学式)溶解,该溶解过程是否发生了氧化还原反应: ___________ (填“是”或“否”)。
(4)不溶于酸碱且难以氧化的杂质在___________ 步骤中被除去。
(5)“沉淀”操作中,先加入 ,将
,将 转化为
转化为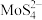 ,再加入盐酸,生成
,再加入盐酸,生成 沉淀和
沉淀和 气体,写出加入盐酸后所发生反应的离子方程式为
气体,写出加入盐酸后所发生反应的离子方程式为___________ 。
 是一种典型的TMD材料,
是一种典型的TMD材料, 与石墨相似具有层状结构。其工艺制备流程如下图所示:
与石墨相似具有层状结构。其工艺制备流程如下图所示: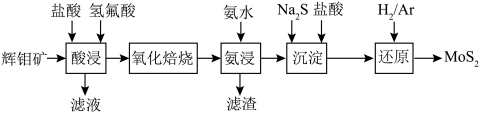
 结构类似于
结构类似于 ,与酸反应时先生成
,与酸反应时先生成 类似于
类似于 ,易分解。
,易分解。②
 不溶于盐酸和氢氟酸。
不溶于盐酸和氢氟酸。③辉钼矿(主要成分为
 ,还含有
,还含有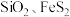 及不溶于酸碱且难以氧化的杂质)。
及不溶于酸碱且难以氧化的杂质)。(1)
 可用于制纳米颗粒润滑油,是由于
可用于制纳米颗粒润滑油,是由于(2)由题目已知条件分析
 属于
属于A.范德华力 B.氢键 C.极性共价键 D.离子键 E.非极性共价键
(3)“酸浸”时,辉钼矿中的
(4)不溶于酸碱且难以氧化的杂质在
(5)“沉淀”操作中,先加入
 ,将
,将 转化为
转化为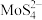 ,再加入盐酸,生成
,再加入盐酸,生成 沉淀和
沉淀和 气体,写出加入盐酸后所发生反应的离子方程式为
气体,写出加入盐酸后所发生反应的离子方程式为
您最近半年使用:0次
名校
解题方法
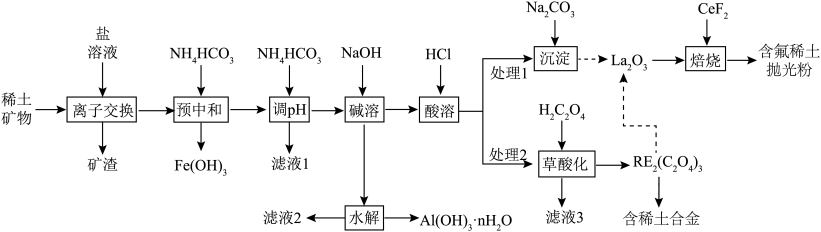
8 . 稀土(RE)包括镧(La)、铈(Ce)等元素,是重要的战略资源,从离子型稀土矿(含Fe、Al等元素)中提取稀土元素并获得高附加值产品的一种工艺流程如图所示。
回答下列问题:
(1)“预中和”工序中:
①该工序适宜的pH范围是________ 。
②胶状 的X射线衍射图谱中,
的X射线衍射图谱中,________ (填“能”或“不能”)观察到明锐的衍射峰。
(2)“调pH”工序中, 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(3)滤液3可返回“________ ”工序循环使用。
(4)“沉淀”工序产物为________ [填“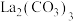 ”或“
”或“ ”],理由是
”],理由是________ {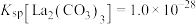 }。(当反应的
}。(当反应的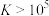 时可认为反应完全)
时可认为反应完全)
(5)含氟稀土抛光粉的主要成分为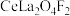 ,“焙烧”时发生反应的化学方程式为
,“焙烧”时发生反应的化学方程式为________ 。
(6)利用离子交换法浸出稀土的过程如图所示。已知离子半径越小、电荷数越大,离子交换能力越强。下列离子对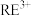 交换能力最强的是________。
交换能力最强的是________。
离子 |
|
|
|
开始沉淀时的pH | 1.5 | 4.3 | 5.6( |
沉淀完全时的pH | 3.2 | 5.5 | /( |
(1)“预中和”工序中:
①该工序适宜的pH范围是
②胶状
 的X射线衍射图谱中,
的X射线衍射图谱中,(2)“调pH”工序中,
 发生反应的离子方程式为
发生反应的离子方程式为(3)滤液3可返回“
(4)“沉淀”工序产物为
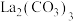 ”或“
”或“ ”],理由是
”],理由是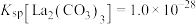 }。(当反应的
}。(当反应的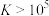 时可认为反应完全)
时可认为反应完全)(5)含氟稀土抛光粉的主要成分为
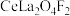 ,“焙烧”时发生反应的化学方程式为
,“焙烧”时发生反应的化学方程式为(6)利用离子交换法浸出稀土的过程如图所示。已知离子半径越小、电荷数越大,离子交换能力越强。下列离子对
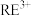 交换能力最强的是________。
交换能力最强的是________。
A. | B. | C. | D. |
您最近半年使用:0次
2024-04-16更新
|
214次组卷
|
2卷引用:湖南省长沙市湖南师范大学附属中学2023-2024学年高二下学期第一次大练习化学试题
名校
解题方法
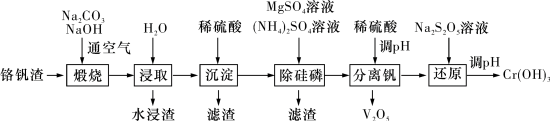
9 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等氧化物,从铬钒渣中分离提取铬和钒的一种流程如图所示: 存在,在碱性介质中以
存在,在碱性介质中以 存在;
存在;
ii) 时,硅元素以
时,硅元素以 形式存在;
形式存在;
iii) 在
在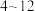 之间,铝元素以
之间,铝元素以 形式存在。
形式存在。
回答下列问题:
(1) 的基态价层电子轨道表示式为
的基态价层电子轨道表示式为_______ 。
(2)向浸取液中滴加稀硫酸过程中含铬离子转化反应的离子方程式为_______ 。
(3)水浸渣中主要物质为_______ (填化学式)。
(4)“沉淀”步骤调 到弱碱性,主要除去的杂质为
到弱碱性,主要除去的杂质为_______ (填化学式)。
(5)“除硅磷”步骤中,使硅、磷分别以 和
和 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的 以达到最好的除杂效果,下列说法正确的是
以达到最好的除杂效果,下列说法正确的是_______ (填标号)。
a.若 过小,磷酸根离子会与
过小,磷酸根离子会与 反应使其浓度降低导致
反应使其浓度降低导致 无法完全沉淀
无法完全沉淀
b.若 过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若 过大,会导致镁离子生成氢氧化镁沉淀,不能形成
过大,会导致镁离子生成氢氧化镁沉淀,不能形成 沉淀,导致产品中混有杂质
沉淀,导致产品中混有杂质
d.若 过大,溶液中铵根离子浓度增大,导致
过大,溶液中铵根离子浓度增大,导致 无法完全沉淀
无法完全沉淀
(6)“分离钒”步骤中,将溶液 调到1.8左右得到
调到1.8左右得到 沉淀,
沉淀, 在
在 时,溶解为
时,溶解为 或
或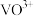 ,在碱性条件下,溶解为
,在碱性条件下,溶解为 或
或 ,上述性质说明
,上述性质说明 具有
具有_______ (填标号)。
A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ 。
 存在,在碱性介质中以
存在,在碱性介质中以 存在;
存在;ii)
 时,硅元素以
时,硅元素以 形式存在;
形式存在;iii)
 在
在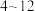 之间,铝元素以
之间,铝元素以 形式存在。
形式存在。回答下列问题:
(1)
 的基态价层电子轨道表示式为
的基态价层电子轨道表示式为(2)向浸取液中滴加稀硫酸过程中含铬离子转化反应的离子方程式为
(3)水浸渣中主要物质为
(4)“沉淀”步骤调
 到弱碱性,主要除去的杂质为
到弱碱性,主要除去的杂质为(5)“除硅磷”步骤中,使硅、磷分别以
 和
和 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的 以达到最好的除杂效果,下列说法正确的是
以达到最好的除杂效果,下列说法正确的是a.若
 过小,磷酸根离子会与
过小,磷酸根离子会与 反应使其浓度降低导致
反应使其浓度降低导致 无法完全沉淀
无法完全沉淀b.若
 过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀c.若
 过大,会导致镁离子生成氢氧化镁沉淀,不能形成
过大,会导致镁离子生成氢氧化镁沉淀,不能形成 沉淀,导致产品中混有杂质
沉淀,导致产品中混有杂质d.若
 过大,溶液中铵根离子浓度增大,导致
过大,溶液中铵根离子浓度增大,导致 无法完全沉淀
无法完全沉淀(6)“分离钒”步骤中,将溶液
 调到1.8左右得到
调到1.8左右得到 沉淀,
沉淀, 在
在 时,溶解为
时,溶解为 或
或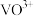 ,在碱性条件下,溶解为
,在碱性条件下,溶解为 或
或 ,上述性质说明
,上述性质说明 具有
具有A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠
 溶液,反应的离子方程式为
溶液,反应的离子方程式为
您最近半年使用:0次
名校
10 . 将CO2转化为CO是利用CO2的重要途径,由CO可以制备多种液体燃料。
(1)我国在CO2催化加氢制取汽油方面取得突破性进展,转化过程如下所示。___________ ,b中碳原子的杂化轨道类型为___________ 。
(2)Cu、Cu2O可应用于CO2转化CO的研究。以CuSO4·5H2O、Na2SO3、Na2CO3为原料能制备Cu2O。将生成Cu2O的反应补充完整___________ 。
___________Cu2+ + ___________CO +___________SO
+___________SO =___________Cu2O+___________↑+___________
=___________Cu2O+___________↑+___________
(3)在Cu催化剂作用下,反应CO2+H2 =CO+H2O的可能机理如下。
i.CO2+2Cu=CO+Cu2O;
ii.___________ (写出反应方程式)。
(1)我国在CO2催化加氢制取汽油方面取得突破性进展,转化过程如下所示。

(2)Cu、Cu2O可应用于CO2转化CO的研究。以CuSO4·5H2O、Na2SO3、Na2CO3为原料能制备Cu2O。将生成Cu2O的反应补充完整
___________Cu2+ + ___________CO
 +___________SO
+___________SO =___________Cu2O+___________↑+___________
=___________Cu2O+___________↑+___________(3)在Cu催化剂作用下,反应CO2+H2 =CO+H2O的可能机理如下。
i.CO2+2Cu=CO+Cu2O;
ii.
您最近半年使用:0次


 为6.2)
为6.2)

