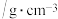名校
解题方法
1 . 科学家开发的光催化剂BiVO4实现了高选择性制备氢气。某小组以辉铋矿粉(主要成分是Bi2S3,含少量Bi2O3、Bi、FeS2和SiO2等杂质)为原料制备钒酸铋(BiVO4)的流程如图所示。
已知部分信息如下:
①滤液1中的主要阳离子有Bi3+、Fe3+、Fe2+和H+。
②常温下,几种离子生成氢氧化物沉淀的pH如表所示。
回答下列问题:
(1)浸取时可以适当加热,但温度不宜过高,其原因是___________ 。写出Bi2S3转化的离子方程式:___________ 。
(2)加H2O2氧化的目的是___________ 。调pH的最低值为___________ 。
(3)稀释水解时通入水蒸气的目的是___________ 。
(4)将气体X通入酸性KMnO4溶液中,实验现象可能是___________ 。
(5)将滤液5经蒸发浓缩、降温结晶、过滤,得到NH4Cl晶体,其晶胞结构如图所示。

①与氯离子最近且等距离的氯离子有___________ 个。
②晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。其中A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),则 的坐标参数为
的坐标参数为___________ 。

已知部分信息如下:
①滤液1中的主要阳离子有Bi3+、Fe3+、Fe2+和H+。
②常温下,几种离子生成氢氧化物沉淀的pH如表所示。
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Bi(OH)3 |
| 开始沉淀的pH | 7.6 | 1.6 | 4.0 |
| 完全沉淀的pH | 9.6 | 3.1 | 5.5 |
(1)浸取时可以适当加热,但温度不宜过高,其原因是
(2)加H2O2氧化的目的是
(3)稀释水解时通入水蒸气的目的是
(4)将气体X通入酸性KMnO4溶液中,实验现象可能是
(5)将滤液5经蒸发浓缩、降温结晶、过滤,得到NH4Cl晶体,其晶胞结构如图所示。

①与氯离子最近且等距离的氯离子有
②晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。其中A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),则
 的坐标参数为
的坐标参数为
您最近一年使用:0次
名校
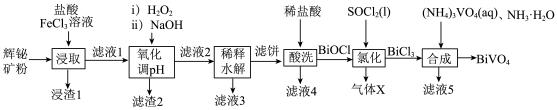
2 . 阅读下列材料,完成6~8题:氯气及含氯物质在生产生活中具有广泛的应用。Deacon催化氧化法将HCl转化为 的反应为:
的反应为: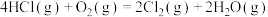

研究发现 催化反应的过程如下:
催化反应的过程如下:
反应ⅰ: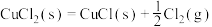

反应ⅱ:

反应ⅲ:……
在指定条件下,下列选项所示的物质间转化能实现的是
 的反应为:
的反应为: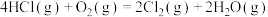

研究发现
 催化反应的过程如下:
催化反应的过程如下:反应ⅰ:
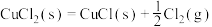

反应ⅱ:


反应ⅲ:……
在指定条件下,下列选项所示的物质间转化能实现的是
A. |
B.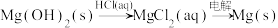 |
C.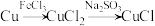 |
D.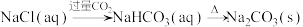 |
您最近一年使用:0次
2024-04-07更新
|
57次组卷
|
2卷引用:江苏省盐城中学2023-2024学年高二下学期3月月考化学试题
3 . 碘化亚铜(CuI)是重要的有机催化剂。某学习小组用如图装置制备CuI,并设计实验探究其性质。已知:碘化亚铜(CuI)是白色固体,难溶于水,易与KI形成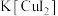 ,实验装置如图所示。
,实验装置如图所示。
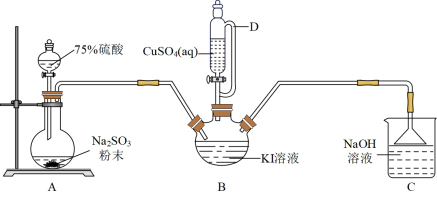
(1)仪器D的名称是___________ 。
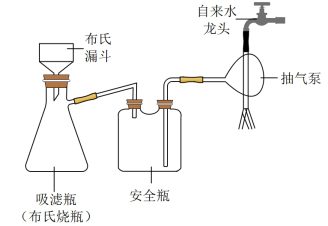
(2)实验完毕后,用如图所示装置分离CuI的突出优点是___________ 。
(3)装置B中发生反应的离子方程式是___________ 。
(4)小组同学设计下表方案对CuI的性质进行探究:
①在实验I中“加水,又生成白色沉淀”的原理是___________ 。
②根据实验Ⅱ,CuI与NaOH溶液反应的化学方程式是___________ 。
(5)测定CuI样品纯度:取agCuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用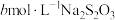 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液体积为VmL[已知:滴定反应为
溶液体积为VmL[已知:滴定反应为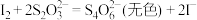 ]。该样品纯度为
]。该样品纯度为___________ (用含a、b、V的代数式表示)。如果其他操作均正确,仅滴定前盛标准液的滴定管用蒸馏水洗净后没有用标准液润洗,测得结果___________ (填“偏高”“偏低”或“无影响”)。
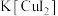 ,实验装置如图所示。
,实验装置如图所示。
(1)仪器D的名称是
(2)实验完毕后,用如图所示装置分离CuI的突出优点是

(3)装置B中发生反应的离子方程式是
(4)小组同学设计下表方案对CuI的性质进行探究:
| 实验 | 实验操作及现象 |
| I | 取少量CuI放入试管中,加入KI溶液,白色固体溶解得到无色溶液;加水,又生成白色沉淀 |
| Ⅱ | 取少量CuI放入试管中,加入NaOH溶液,振荡,产生砖红色沉淀。过滤,向所得上层清液中滴加淀粉溶液,无明显变化;将砖红色沉淀溶于稀硫酸,产生红色固体和蓝色溶液 |
②根据实验Ⅱ,CuI与NaOH溶液反应的化学方程式是
(5)测定CuI样品纯度:取agCuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用
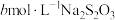 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液体积为VmL[已知:滴定反应为
溶液体积为VmL[已知:滴定反应为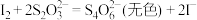 ]。该样品纯度为
]。该样品纯度为
您最近一年使用:0次
解题方法
4 . 一种从水钴矿(含 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
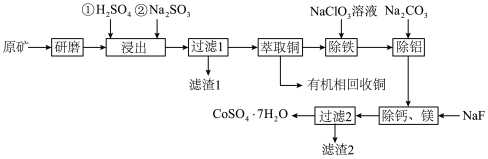
请回答下列问题:
(1)“研磨”的目的是___________ 。
(2)“浸出”时, 被浸出的化学方程式为
被浸出的化学方程式为___________ 。
(3)滤渣1的成分是___________ 。
(4)“除铁”时, 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为___________ ;“除铝”时加入 的目的是
的目的是___________ 。
(5)已知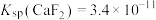 ,
,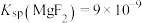 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中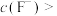
___________  。
。
(6)由“过滤2”后的母液得到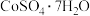 的操作是
的操作是___________ ,___________ 、过滤、洗涤、干燥。
 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
请回答下列问题:
(1)“研磨”的目的是
(2)“浸出”时,
 被浸出的化学方程式为
被浸出的化学方程式为(3)滤渣1的成分是
(4)“除铁”时,
 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为 的目的是
的目的是(5)已知
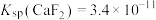 ,
,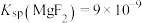 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中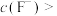
 。
。(6)由“过滤2”后的母液得到
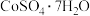 的操作是
的操作是
您最近一年使用:0次
名校
解题方法
5 . 水中溶解的氧气高温下对锅炉有很强的腐蚀性,可以用联氨(N2H4)处理锅炉水中的溶解氧。其中一种反应机理如图所示。下列说法错误的是

| A.联氨(N2H4)易溶于水,所得溶液中存在四种氢键 |
| B.稳定性:H2O2<N2H4,是因为H2O2分子中孤电子对较多 |
C.①中发生的反应为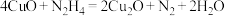 |
D.该过程中产生的氮气和消耗的氧气之比为: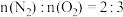 |
您最近一年使用:0次
2024-04-05更新
|
168次组卷
|
2卷引用:湖北省云学名校联盟2023-2024学年高二下学期3月联考化学试卷
名校
解题方法
6 . 环己酮(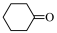 )是一种重要的化工原料,一种由
)是一种重要的化工原料,一种由 氧化环己醇(
氧化环己醇(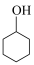 )制备环己酮的实验方法如下:
)制备环己酮的实验方法如下:
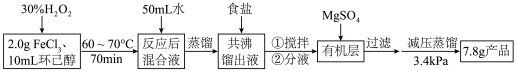
相关数据如下:
回答下列问题:
(1) 的作用是
的作用是________ ;加入食盐的目的是________ 。
(2)环己酮的产率受 用量的影响,当环己酮产率达最大值后,增加
用量的影响,当环己酮产率达最大值后,增加 的用量其产率反而下降,原因是
的用量其产率反而下降,原因是________ 。
(3)减压蒸馏的装置如下图所示,仪器A的名称为________ ,为了便于控制温度,加热方式最好选用________ (填“水浴”或“油浴”)。进行减压蒸馏时,使用磁力加热搅拌器加热,磁子的作用除搅拌使混合物均匀受热外,还有________ 。
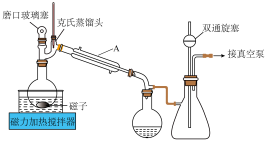
减压蒸馏的操作顺序为:打开双通旋塞,打开真空泵,缓慢关闭双通旋塞,接通冷凝水,开启磁力加热搅拌器,进行减压蒸馏。减压蒸馏完成后,需进行下列操作,正确的操作顺序是________ (填标号)。
a.关闭真空泵 b.关闭磁力加热搅拌器,冷却至室温
c.缓慢打开双通旋塞 d.停止通冷凝水
(4)本实验中环己酮的产率为________ (保留2位有效数字)。
(5)传统的制备环已酮实验用酸性 作氧化剂,更易把环己醇氧化生成己二酸(
作氧化剂,更易把环己醇氧化生成己二酸(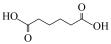 ),该反应的离子方程式为
),该反应的离子方程式为________ 。
 )是一种重要的化工原料,一种由
)是一种重要的化工原料,一种由 氧化环己醇(
氧化环己醇( )制备环己酮的实验方法如下:
)制备环己酮的实验方法如下:
相关数据如下:
物质 | 密度 | 沸点/℃(101kPa) | 与水形成共沸物的沸点/℃ | 部分性质 |
环己醇 | 0.96 | 161.0 | 97.8 | 能溶于水,具有还原性,易被氧化 |
环己酮 | 0.95 | 155.0 98.0/3.4kPa | 95.0 | 微溶于水,遇氧化剂易发生开环反应 |
(1)
 的作用是
的作用是(2)环己酮的产率受
 用量的影响,当环己酮产率达最大值后,增加
用量的影响,当环己酮产率达最大值后,增加 的用量其产率反而下降,原因是
的用量其产率反而下降,原因是(3)减压蒸馏的装置如下图所示,仪器A的名称为

减压蒸馏的操作顺序为:打开双通旋塞,打开真空泵,缓慢关闭双通旋塞,接通冷凝水,开启磁力加热搅拌器,进行减压蒸馏。减压蒸馏完成后,需进行下列操作,正确的操作顺序是
a.关闭真空泵 b.关闭磁力加热搅拌器,冷却至室温
c.缓慢打开双通旋塞 d.停止通冷凝水
(4)本实验中环己酮的产率为
(5)传统的制备环已酮实验用酸性
 作氧化剂,更易把环己醇氧化生成己二酸(
作氧化剂,更易把环己醇氧化生成己二酸( ),该反应的离子方程式为
),该反应的离子方程式为
您最近一年使用:0次
解题方法
7 . 苯甲酸可用于合成纤维、树脂涂料等,也可作为药物或防腐制,有抑制真菌、细菌生长的作用。实验室利用高锰酸钾溶液氧化甲苯制备苯甲酸,实验装置如图所示:
对反应混合物进行分离提纯的流程如下:

已知:甲苯的沸点是110.6℃,苯的沸点约为80℃;苯甲酸微溶于冷水,易溶于热水。
请回答下列问题:
(1)仪器a的名称为_______ ,冷凝水从_______ 口流出(填“甲”或“乙”)。
(2)在三颈烧瓶中加入一定量的甲苯、水和稍过量高锰酸钾固体,通入冷凝水,维持反应温度90℃,开启电磁搅拌器,加热回流至回流液不再出现油珠。
①“回流液不再出现油珠”说明_______ 。
②已知反应过程中甲苯被氧化为苯甲酸钾,该反应的化学方程式为_______ 。
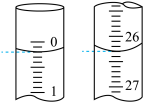
(3)为测定所得产品的纯度,称取1.220g粗产品,配成100mL溶液,取其中25.00mL溶液用0.080mol·L-1KOH溶液进行滴定。
第一次滴定开始和结束时,碱式滴定管中的液面如图所示。重复实验2次,测得所用KOH溶液的体积分别为26.08mL、26.12mL,则该粗产品中苯甲酸的质量分数为_______ %。

对反应混合物进行分离提纯的流程如下:

已知:甲苯的沸点是110.6℃,苯的沸点约为80℃;苯甲酸微溶于冷水,易溶于热水。
请回答下列问题:
(1)仪器a的名称为
(2)在三颈烧瓶中加入一定量的甲苯、水和稍过量高锰酸钾固体,通入冷凝水,维持反应温度90℃,开启电磁搅拌器,加热回流至回流液不再出现油珠。
①“回流液不再出现油珠”说明
②已知反应过程中甲苯被氧化为苯甲酸钾,该反应的化学方程式为
(3)为测定所得产品的纯度,称取1.220g粗产品,配成100mL溶液,取其中25.00mL溶液用0.080mol·L-1KOH溶液进行滴定。
第一次滴定开始和结束时,碱式滴定管中的液面如图所示。重复实验2次,测得所用KOH溶液的体积分别为26.08mL、26.12mL,则该粗产品中苯甲酸的质量分数为

您最近一年使用:0次
名校
解题方法
8 . 钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是V2O3、V2O4,含有的杂质有SiO2、FeS2及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
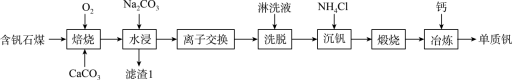
已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
②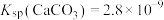 ,
,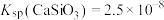 ,
,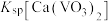 远大于
远大于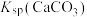 。
。
回答下列问题:
(1)基态Fe3+的价电子轨道表示式为______ 。
(2)“焙烧”时,V2O3、V2O4都转化为 ,写出
,写出 转化为
转化为 的化学方程式:
的化学方程式:____________ 。
(3)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有______ :“水浸”加入过量Na2CO3不能使CaSiO3完全转化为CaCO3,原因是______ 。(列式计算平衡常数分析该反应进行的趋势,一般认为,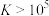 时反应进行较完全,
时反应进行较完全,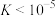 时反应难以进行)
时反应难以进行)
(4)“离子交换”与“洗脱”可表示为 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂, 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用______ 。
(5)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是____________ 。
(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是______(填字母)。

已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀时的pH | 3.2 | 9.0 | 4.7 | 10.1 |
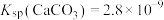 ,
,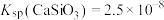 ,
,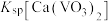 远大于
远大于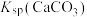 。
。回答下列问题:
(1)基态Fe3+的价电子轨道表示式为
(2)“焙烧”时,V2O3、V2O4都转化为
 ,写出
,写出 转化为
转化为 的化学方程式:
的化学方程式:(3)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有
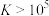 时反应进行较完全,
时反应进行较完全,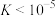 时反应难以进行)
时反应难以进行)(4)“离子交换”与“洗脱”可表示为
 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂, 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用(5)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是
(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是______(填字母)。
| A.高炉炼铁 | B.电解熔融氯化钠制钠 |
| C.铝热反应制锰 | D.氧化汞分解制汞 |
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题:
(1)常温常压下,已知 的燃烧热为
的燃烧热为 。写出表示
。写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式_____________ ;
(2)科技工作者运用DFT计算研究在甲醇钯基催化剂表面上制氢的反应历程如图所示。其中吸附在钯催化剂表面上的物种用*标注。
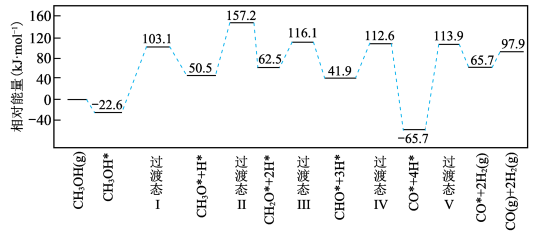
该历程中最大能垒活化能______  ,该步骤的化学方程式为
,该步骤的化学方程式为________ 。
(3)一定条件下,利用甲烷可将 还原为
还原为 。在一密闭容器中充入
。在一密闭容器中充入 、
、 气体各
气体各 ,发生反应
,发生反应
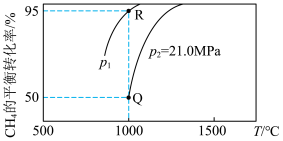
 。测得
。测得 的平衡转化率随温度、压强的变化曲线如图所示,
的平衡转化率随温度、压强的变化曲线如图所示,
______ 0(填“>”“<”或“=”),
_____  (填“>”“<”或“=”);
(填“>”“<”或“=”); 点的压强平衡常数
点的压强平衡常数
_______  (用平衡分压代替平衡浓度计算,气体的分压=气体总压强
(用平衡分压代替平衡浓度计算,气体的分压=气体总压强 该气体的物质的量分数)。
该气体的物质的量分数)。
(4)利用强氧化剂可以对烟气进行脱硫脱硝。在某工厂中,用 溶液作氧化剂,控制
溶液作氧化剂,控制 ,将烟气中
,将烟气中 和
和 转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:
转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:
请写出 脱除原理的离子方程式
脱除原理的离子方程式___________ ;温度高于50℃时,脱除率逐渐降低,原因是___________ 。
(1)常温常压下,已知
 的燃烧热为
的燃烧热为 。写出表示
。写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式(2)科技工作者运用DFT计算研究在甲醇钯基催化剂表面上制氢的反应历程如图所示。其中吸附在钯催化剂表面上的物种用*标注。

该历程中最大能垒活化能
 ,该步骤的化学方程式为
,该步骤的化学方程式为(3)一定条件下,利用甲烷可将
 还原为
还原为 。在一密闭容器中充入
。在一密闭容器中充入 、
、 气体各
气体各 ,发生反应
,发生反应
 。测得
。测得 的平衡转化率随温度、压强的变化曲线如图所示,
的平衡转化率随温度、压强的变化曲线如图所示,

 (填“>”“<”或“=”);
(填“>”“<”或“=”); 点的压强平衡常数
点的压强平衡常数
 (用平衡分压代替平衡浓度计算,气体的分压=气体总压强
(用平衡分压代替平衡浓度计算,气体的分压=气体总压强 该气体的物质的量分数)。
该气体的物质的量分数)。
(4)利用强氧化剂可以对烟气进行脱硫脱硝。在某工厂中,用
 溶液作氧化剂,控制
溶液作氧化剂,控制 ,将烟气中
,将烟气中 和
和 转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:
转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:| 温度/℃ | 10 | 20 | 40 | 50 | 60 | 80 | |
| 脱除率% |  | 91.6 | 97.5 | 98.9 | 99.9 | 99.1 | 97.2 |
| NO | 76.5 | 77.2 | 78.9 | 80.1 | 79.9 | 78.8 | |
 脱除原理的离子方程式
脱除原理的离子方程式
您最近一年使用:0次
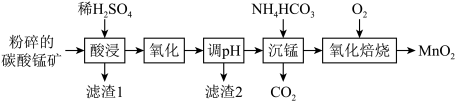
10 . 工业上以碳酸锰矿(主要含MnCO3,还含有SiO2、Al2O3、FeCO3等杂质)为原料制备MnO2的工艺流程如下图所示。
已知:常温下,溶液中金属离子开始沉淀和完全沉淀时的pH如表所示。
回答下列问题:
(1)“酸浸”前将碳酸锰矿粉碎的目的是___________ 。
(2)“氧化”时MnO2将Fe2+氧化成Fe3+的离子方程式为___________ 。
(3)滤渣2的主要成分为Al(OH)3和___________ ,应“调pH”时应控制pH范围为___________ 。
(4)“沉锰”得到MnCO3,该过程需控制在较低温度下的原因是___________ 。要使Mn2+沉淀完全(通常认为溶液中离子浓度小于1.0×10-5mol/L为沉淀完全),溶液中CO 的浓度应大于
的浓度应大于___________ 。[25℃时,Ksp(MnCO3)=2.0×10-11]。
(5)“氧化焙烧”的化学方程式为___________ 。
(6)若以125kg该碳酸锰矿为原料制备MnO2,得到产品质量为87kg,则该碳酸锰矿的纯度是___________ 。(忽略流程中锰元素的损失)。

已知:常温下,溶液中金属离子开始沉淀和完全沉淀时的pH如表所示。
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀pH | 1.5 | 6.5 | 3.3 | 8.3 |
完全沉淀pH | 3.7 | 9.7 | 5.2 | 9.8 |
(1)“酸浸”前将碳酸锰矿粉碎的目的是
(2)“氧化”时MnO2将Fe2+氧化成Fe3+的离子方程式为
(3)滤渣2的主要成分为Al(OH)3和
(4)“沉锰”得到MnCO3,该过程需控制在较低温度下的原因是
 的浓度应大于
的浓度应大于(5)“氧化焙烧”的化学方程式为
(6)若以125kg该碳酸锰矿为原料制备MnO2,得到产品质量为87kg,则该碳酸锰矿的纯度是
您最近一年使用:0次