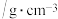名校
解题方法
1 . 一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如下:
(1)基态Zn2+核外电子排布式为___________ 。
(2)“滤渣2”的主要成分是MnO2、Fe(OH)3。“氧化”过程中KMnO4与Mn2+发生反应的离子方程式为___________ 。
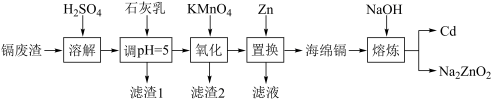
(3)“置换”过程中镉置换率与(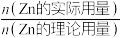 )的关系如图1所示,其中Zn的理论用量以溶液中
)的关系如图1所示,其中Zn的理论用量以溶液中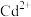 的物质的量为依据。实际生产中
的物质的量为依据。实际生产中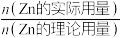 最佳比值为1.3,不宜超过该比值的原因是
最佳比值为1.3,不宜超过该比值的原因是___________ 。
(4)向“置换”所得滤液中加 溶液,经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[化学式为
溶液,经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[化学式为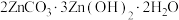 ,摩尔质量为583g/mol]
,摩尔质量为583g/mol]
①碱式碳酸锌高温下完全分解至质量不变的反应方程式为___________ 。
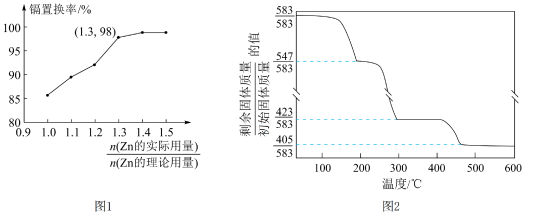
②碱式碳酸锌加热升温过程中固体的质量变化如图2所示。350℃时剩余固体中已不含碳元素,则350℃时剩余固体的成分为___________ 。(填化学式)

(1)基态Zn2+核外电子排布式为
(2)“滤渣2”的主要成分是MnO2、Fe(OH)3。“氧化”过程中KMnO4与Mn2+发生反应的离子方程式为
(3)“置换”过程中镉置换率与(
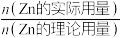 )的关系如图1所示,其中Zn的理论用量以溶液中
)的关系如图1所示,其中Zn的理论用量以溶液中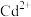 的物质的量为依据。实际生产中
的物质的量为依据。实际生产中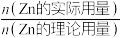 最佳比值为1.3,不宜超过该比值的原因是
最佳比值为1.3,不宜超过该比值的原因是
(4)向“置换”所得滤液中加
 溶液,经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[化学式为
溶液,经沉淀、过滤、洗涤等系列操作后,得到碱式碳酸锌[化学式为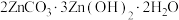 ,摩尔质量为583g/mol]
,摩尔质量为583g/mol]①碱式碳酸锌高温下完全分解至质量不变的反应方程式为
②碱式碳酸锌加热升温过程中固体的质量变化如图2所示。350℃时剩余固体中已不含碳元素,则350℃时剩余固体的成分为
您最近半年使用:0次
名校
2 . 阅读下列材料,完成6~8题:氯气及含氯物质在生产生活中具有广泛的应用。Deacon催化氧化法将HCl转化为 的反应为:
的反应为: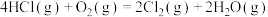

研究发现 催化反应的过程如下:
催化反应的过程如下:
反应ⅰ: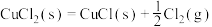

反应ⅱ:

反应ⅲ:……
在指定条件下,下列选项所示的物质间转化能实现的是
 的反应为:
的反应为: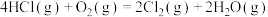

研究发现
 催化反应的过程如下:
催化反应的过程如下:反应ⅰ:
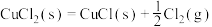

反应ⅱ:


反应ⅲ:……
在指定条件下,下列选项所示的物质间转化能实现的是
A. |
B.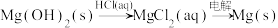 |
C.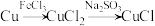 |
D.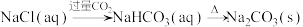 |
您最近半年使用:0次
名校
解题方法
3 . 某小组为探究含硫化合物(NH4)2S2O8的性质,设计如下实验探究(NH4)2S2O8的氧化性。实验操作:向小试管中加入2mL0.2mol/LKI溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量0.2mol/L(NH4)2S2O8溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在 。
。
(1)(NH4)2S2O8与KI反应的离子方程式为___________ 。
已知:I2可与S2O 发生反应:2S2O
发生反应:2S2O +I2=S4O
+I2=S4O +2I-。为了进一步探究S2O
+2I-。为了进一步探究S2O 与KI的反应速率,小组同学设计下表实验:
与KI的反应速率,小组同学设计下表实验:
(2)上述实验Ⅱ中的V1=___________ ;V2=___________ 。
加入Na2S2O3溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:(NH4)2S2O8与KI反应的速率远低于I2与Na2S2O3反应的速率;
猜想2:(NH4)2S2O8先与Na2S2O3反应,Na2S2O3消耗完后才与I-反应。
为验证上述猜想,小组同学补充下表实验:
(3)验证猜想1的实验设计为___________ (填“实验Ⅲ”或“实验Ⅳ”下同)。
(4)实验Ⅲ中下层溶液显浅紫色的原因为___________ 。
(5)由上述实验可知___________ (填“猜想1”或“猜想2”)成立。
 。
。(1)(NH4)2S2O8与KI反应的离子方程式为
已知:I2可与S2O
 发生反应:2S2O
发生反应:2S2O +I2=S4O
+I2=S4O +2I-。为了进一步探究S2O
+2I-。为了进一步探究S2O 与KI的反应速率,小组同学设计下表实验:
与KI的反应速率,小组同学设计下表实验:| 试验编号 | 0.2mol/LKI溶液/mL | 0.01mol/LNa2S2O3溶液/mL | 蒸馏水/mL | 0.4%的淀粉溶液/滴 | 0.2mol/L(NH4)2S2O8溶液/mL | 变色时间/s |
| Ⅰ | 4.0 | 0 | 4.0 | 2 | 2.0 | 立即 |
| Ⅱ | 4.0 | 1.0 | V1 | 2 | V2 | 30 |
加入Na2S2O3溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:(NH4)2S2O8与KI反应的速率远低于I2与Na2S2O3反应的速率;
猜想2:(NH4)2S2O8先与Na2S2O3反应,Na2S2O3消耗完后才与I-反应。
为验证上述猜想,小组同学补充下表实验:
| 试验编号 | 0.2mol/LKI溶液/mL | 0.001mol/L碘水/mL | 0.01mol/LNa2S2O3溶液/mL | CCl4/mL | 0.4%的淀粉溶液/滴 | 0.2mol/L(NH4)2S2O8溶液/mL | 实验现象 |
| Ⅲ | 2 | 0 | 20 | 10 | 0 | 0.2 | 下层溶液显浅紫色 |
| Ⅳ | 0 | 5 | 20 | 0 | 2 | 20 | 溶液先变蓝,后迅速褪色,一段时间后又变蓝 |
(4)实验Ⅲ中下层溶液显浅紫色的原因为
(5)由上述实验可知
您最近半年使用:0次
名校
4 . 亚硫酸盐是一类很早即在世界范围内广泛使用的食品添加剂,可作为食品漂白剂,防腐剂;可抑制非酶褐变和酶促褐变,防止食品褐变,使水果不至黑变,还能防止鲜虾生成黑斑;在酸性介质中,还是十分有效的抗菌剂。
(1)亚硫酸钠中,阴离子的空间结构为___________ 。
(2)常温下, 溶液呈碱性,原因是
溶液呈碱性,原因是___________ (用离子方程式表示)。
(3)常温下,已知 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为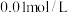 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
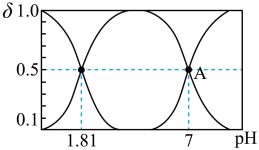
①A点溶液中离子浓度大小关系为___________ 。
②常温下, 溶液呈
溶液呈___________ 性。
(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是___________ (用离子方程式表示)。常温处理后,再调节 使
使 浓度不高于
浓度不高于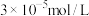 即可排放,调节
即可排放,调节 应不低于
应不低于___________ 。[已知Ksp[Cr(OH)3]=3×10-32]
(1)亚硫酸钠中,阴离子的空间结构为
(2)常温下,
 溶液呈碱性,原因是
溶液呈碱性,原因是(3)常温下,已知
 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为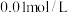 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
①A点溶液中离子浓度大小关系为
②常温下,
 溶液呈
溶液呈(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性
 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是 使
使 浓度不高于
浓度不高于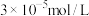 即可排放,调节
即可排放,调节 应不低于
应不低于
您最近半年使用:0次
名校
解题方法
5 . 科学家开发的光催化剂BiVO4实现了高选择性制备氢气。某小组以辉铋矿粉(主要成分是Bi2S3,含少量Bi2O3、Bi、FeS2和SiO2等杂质)为原料制备钒酸铋(BiVO4)的流程如图所示。
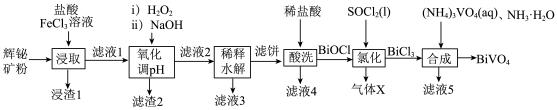
已知部分信息如下:
①滤液1中的主要阳离子有Bi3+、Fe3+、Fe2+和H+。
②常温下,几种离子生成氢氧化物沉淀的pH如表所示。
回答下列问题:
(1)浸取时可以适当加热,但温度不宜过高,其原因是___________ 。写出Bi2S3转化的离子方程式:___________ 。
(2)加H2O2氧化的目的是___________ 。调pH的最低值为___________ 。
(3)稀释水解时通入水蒸气的目的是___________ 。
(4)将气体X通入酸性KMnO4溶液中,实验现象可能是___________ 。
(5)将滤液5经蒸发浓缩、降温结晶、过滤,得到NH4Cl晶体,其晶胞结构如图所示。

①与氯离子最近且等距离的氯离子有___________ 个。
②晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。其中A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),则 的坐标参数为
的坐标参数为___________ 。

已知部分信息如下:
①滤液1中的主要阳离子有Bi3+、Fe3+、Fe2+和H+。
②常温下,几种离子生成氢氧化物沉淀的pH如表所示。
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Bi(OH)3 |
| 开始沉淀的pH | 7.6 | 1.6 | 4.0 |
| 完全沉淀的pH | 9.6 | 3.1 | 5.5 |
(1)浸取时可以适当加热,但温度不宜过高,其原因是
(2)加H2O2氧化的目的是
(3)稀释水解时通入水蒸气的目的是
(4)将气体X通入酸性KMnO4溶液中,实验现象可能是
(5)将滤液5经蒸发浓缩、降温结晶、过滤,得到NH4Cl晶体,其晶胞结构如图所示。

①与氯离子最近且等距离的氯离子有
②晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。其中A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),则
 的坐标参数为
的坐标参数为
您最近半年使用:0次
6 . 碘化亚铜(CuI)是重要的有机催化剂。某学习小组用如图装置制备CuI,并设计实验探究其性质。已知:碘化亚铜(CuI)是白色固体,难溶于水,易与KI形成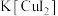 ,实验装置如图所示。
,实验装置如图所示。
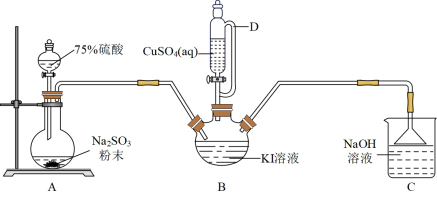
(1)仪器D的名称是___________ 。
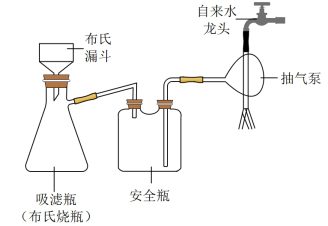
(2)实验完毕后,用如图所示装置分离CuI的突出优点是___________ 。
(3)装置B中发生反应的离子方程式是___________ 。
(4)小组同学设计下表方案对CuI的性质进行探究:
①在实验I中“加水,又生成白色沉淀”的原理是___________ 。
②根据实验Ⅱ,CuI与NaOH溶液反应的化学方程式是___________ 。
(5)测定CuI样品纯度:取agCuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用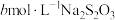 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液体积为VmL[已知:滴定反应为
溶液体积为VmL[已知:滴定反应为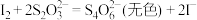 ]。该样品纯度为
]。该样品纯度为___________ (用含a、b、V的代数式表示)。如果其他操作均正确,仅滴定前盛标准液的滴定管用蒸馏水洗净后没有用标准液润洗,测得结果___________ (填“偏高”“偏低”或“无影响”)。
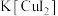 ,实验装置如图所示。
,实验装置如图所示。
(1)仪器D的名称是
(2)实验完毕后,用如图所示装置分离CuI的突出优点是

(3)装置B中发生反应的离子方程式是
(4)小组同学设计下表方案对CuI的性质进行探究:
| 实验 | 实验操作及现象 |
| I | 取少量CuI放入试管中,加入KI溶液,白色固体溶解得到无色溶液;加水,又生成白色沉淀 |
| Ⅱ | 取少量CuI放入试管中,加入NaOH溶液,振荡,产生砖红色沉淀。过滤,向所得上层清液中滴加淀粉溶液,无明显变化;将砖红色沉淀溶于稀硫酸,产生红色固体和蓝色溶液 |
②根据实验Ⅱ,CuI与NaOH溶液反应的化学方程式是
(5)测定CuI样品纯度:取agCuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用
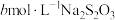 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液体积为VmL[已知:滴定反应为
溶液体积为VmL[已知:滴定反应为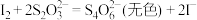 ]。该样品纯度为
]。该样品纯度为
您最近半年使用:0次
解题方法
7 . 一种从水钴矿(含 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
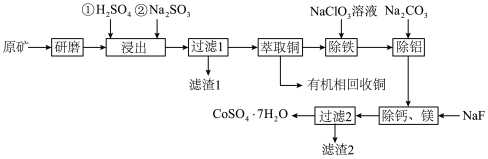
请回答下列问题:
(1)“研磨”的目的是___________ 。
(2)“浸出”时, 被浸出的化学方程式为
被浸出的化学方程式为___________ 。
(3)滤渣1的成分是___________ 。
(4)“除铁”时, 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为___________ ;“除铝”时加入 的目的是
的目的是___________ 。
(5)已知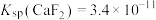 ,
,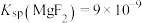 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中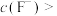
___________  。
。
(6)由“过滤2”后的母液得到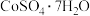 的操作是
的操作是___________ ,___________ 、过滤、洗涤、干燥。
 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
请回答下列问题:
(1)“研磨”的目的是
(2)“浸出”时,
 被浸出的化学方程式为
被浸出的化学方程式为(3)滤渣1的成分是
(4)“除铁”时,
 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为 的目的是
的目的是(5)已知
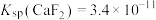 ,
,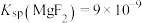 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中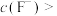
 。
。(6)由“过滤2”后的母液得到
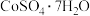 的操作是
的操作是
您最近半年使用:0次
名校
解题方法
8 . 水中溶解的氧气高温下对锅炉有很强的腐蚀性,可以用联氨(N2H4)处理锅炉水中的溶解氧。其中一种反应机理如图所示。下列说法错误的是

| A.联氨(N2H4)易溶于水,所得溶液中存在四种氢键 |
| B.稳定性:H2O2<N2H4,是因为H2O2分子中孤电子对较多 |
C.①中发生的反应为 |
D.该过程中产生的氮气和消耗的氧气之比为: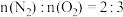 |
您最近半年使用:0次
2024-04-05更新
|
163次组卷
|
2卷引用:湖北省云学名校联盟2023-2024学年高二下学期3月联考化学试卷
名校
解题方法
9 . 环己酮(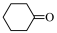 )是一种重要的化工原料,一种由
)是一种重要的化工原料,一种由 氧化环己醇(
氧化环己醇(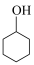 )制备环己酮的实验方法如下:
)制备环己酮的实验方法如下:
相关数据如下:
回答下列问题:
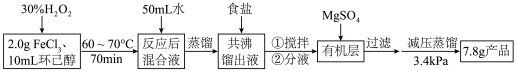
(1) 的作用是
的作用是________ ;加入食盐的目的是________ 。
(2)环己酮的产率受 用量的影响,当环己酮产率达最大值后,增加
用量的影响,当环己酮产率达最大值后,增加 的用量其产率反而下降,原因是
的用量其产率反而下降,原因是________ 。
(3)减压蒸馏的装置如下图所示,仪器A的名称为________ ,为了便于控制温度,加热方式最好选用________ (填“水浴”或“油浴”)。进行减压蒸馏时,使用磁力加热搅拌器加热,磁子的作用除搅拌使混合物均匀受热外,还有________ 。
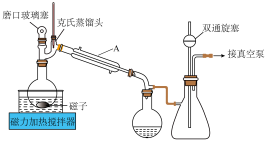
减压蒸馏的操作顺序为:打开双通旋塞,打开真空泵,缓慢关闭双通旋塞,接通冷凝水,开启磁力加热搅拌器,进行减压蒸馏。减压蒸馏完成后,需进行下列操作,正确的操作顺序是________ (填标号)。
a.关闭真空泵 b.关闭磁力加热搅拌器,冷却至室温
c.缓慢打开双通旋塞 d.停止通冷凝水
(4)本实验中环己酮的产率为________ (保留2位有效数字)。
(5)传统的制备环已酮实验用酸性 作氧化剂,更易把环己醇氧化生成己二酸(
作氧化剂,更易把环己醇氧化生成己二酸(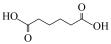 ),该反应的离子方程式为
),该反应的离子方程式为________ 。
 )是一种重要的化工原料,一种由
)是一种重要的化工原料,一种由 氧化环己醇(
氧化环己醇( )制备环己酮的实验方法如下:
)制备环己酮的实验方法如下:
相关数据如下:
物质 | 密度 | 沸点/℃(101kPa) | 与水形成共沸物的沸点/℃ | 部分性质 |
环己醇 | 0.96 | 161.0 | 97.8 | 能溶于水,具有还原性,易被氧化 |
环己酮 | 0.95 | 155.0 98.0/3.4kPa | 95.0 | 微溶于水,遇氧化剂易发生开环反应 |
(1)
 的作用是
的作用是(2)环己酮的产率受
 用量的影响,当环己酮产率达最大值后,增加
用量的影响,当环己酮产率达最大值后,增加 的用量其产率反而下降,原因是
的用量其产率反而下降,原因是(3)减压蒸馏的装置如下图所示,仪器A的名称为

减压蒸馏的操作顺序为:打开双通旋塞,打开真空泵,缓慢关闭双通旋塞,接通冷凝水,开启磁力加热搅拌器,进行减压蒸馏。减压蒸馏完成后,需进行下列操作,正确的操作顺序是
a.关闭真空泵 b.关闭磁力加热搅拌器,冷却至室温
c.缓慢打开双通旋塞 d.停止通冷凝水
(4)本实验中环己酮的产率为
(5)传统的制备环已酮实验用酸性
 作氧化剂,更易把环己醇氧化生成己二酸(
作氧化剂,更易把环己醇氧化生成己二酸( ),该反应的离子方程式为
),该反应的离子方程式为
您最近半年使用:0次
解题方法
10 . 苯甲酸可用于合成纤维、树脂涂料等,也可作为药物或防腐制,有抑制真菌、细菌生长的作用。实验室利用高锰酸钾溶液氧化甲苯制备苯甲酸,实验装置如图所示:
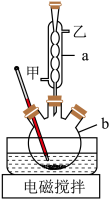
对反应混合物进行分离提纯的流程如下:

已知:甲苯的沸点是110.6℃,苯的沸点约为80℃;苯甲酸微溶于冷水,易溶于热水。
请回答下列问题:
(1)仪器a的名称为_______ ,冷凝水从_______ 口流出(填“甲”或“乙”)。
(2)在三颈烧瓶中加入一定量的甲苯、水和稍过量高锰酸钾固体,通入冷凝水,维持反应温度90℃,开启电磁搅拌器,加热回流至回流液不再出现油珠。
①“回流液不再出现油珠”说明_______ 。
②已知反应过程中甲苯被氧化为苯甲酸钾,该反应的化学方程式为_______ 。
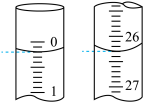
(3)为测定所得产品的纯度,称取1.220g粗产品,配成100mL溶液,取其中25.00mL溶液用0.080mol·L-1KOH溶液进行滴定。
第一次滴定开始和结束时,碱式滴定管中的液面如图所示。重复实验2次,测得所用KOH溶液的体积分别为26.08mL、26.12mL,则该粗产品中苯甲酸的质量分数为_______ %。

对反应混合物进行分离提纯的流程如下:

已知:甲苯的沸点是110.6℃,苯的沸点约为80℃;苯甲酸微溶于冷水,易溶于热水。
请回答下列问题:
(1)仪器a的名称为
(2)在三颈烧瓶中加入一定量的甲苯、水和稍过量高锰酸钾固体,通入冷凝水,维持反应温度90℃,开启电磁搅拌器,加热回流至回流液不再出现油珠。
①“回流液不再出现油珠”说明
②已知反应过程中甲苯被氧化为苯甲酸钾,该反应的化学方程式为
(3)为测定所得产品的纯度,称取1.220g粗产品,配成100mL溶液,取其中25.00mL溶液用0.080mol·L-1KOH溶液进行滴定。
第一次滴定开始和结束时,碱式滴定管中的液面如图所示。重复实验2次,测得所用KOH溶液的体积分别为26.08mL、26.12mL,则该粗产品中苯甲酸的质量分数为

您最近半年使用:0次