名校
1 . 氧烛可用于潜艇或密闭空间供氧,由下表中物质压制成形,其原理为受热时,利用d区元素形成的氧化物催化制氧剂分解产生 下列说法正确的是
下列说法正确的是
 下列说法正确的是
下列说法正确的是成分 | Al | Fe |
|
|
|
作用 | 燃烧物 | 产生催化剂 | 制氧剂 |
| 定型齐 |
A.氧烛供氧时,Al燃烧为 分解提供能最且自身电子跃迁发光 分解提供能最且自身电子跃迁发光 |
| B.氧烛成分中的Fe也可以用Cu来代替 |
C. 吸收氯气时发生反应 吸收氯气时发生反应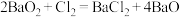 |
| D.氧烛燃尽后残留物可以全部溶解在足量氢氧化钠溶液中 |
您最近半年使用:0次
名校
解题方法
2 . 结晶水合物Fe(NO3)3·9H2O主要用作催化剂 某兴趣小组按如下流程进行实验:
某兴趣小组按如下流程进行实验:
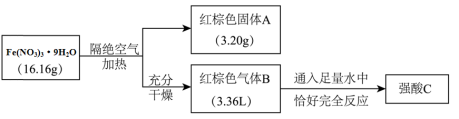
(1)混合气体B的成分为
(2)写出化合物Fe(NO3)3·9H2O隔绝空气加热分解生成A和B的化学反应方程式
(3)固体A溶于氢氰酸(弱酸,分子式为:HCN)溶液生成六配位阴离子,溶液显强酸性。写出该反应的离子方程式
(4)控制温度的条件下,加热FeCl3溶液所得固体成分为:Fe2O3或FeOCl或两者混合物(已知:FeOCl难溶于水,易溶于强酸),设计实验方案检验固体中有FeOCl:
您最近半年使用:0次
名校
3 . 图中展示的是乙烯催化氧化的过程(部分相关离子未画出),下列描述正确的是
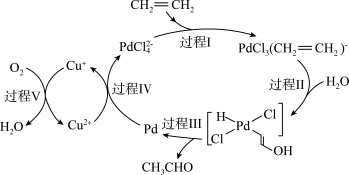
A.乙烯催化氧化反应的化学方程式为 |
B.反应中只有 作催化剂 作催化剂 |
| C.该转化过程中,没有极性键的断裂与形成 |
D.该转化过程中,涉及反应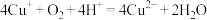 |
您最近半年使用:0次
2024-04-10更新
|
266次组卷
|
2卷引用:四川省巴中中学2023-2024学年高二下学期3月月考化学试题
解题方法
4 . 某废水中主要含有Mn2+、Fe3+、Fe2+、Co2+、Ni2+以及 。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
②Ksp[Fe(OH)3]=4.0×10-38,Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21。
回答下列问题:
(1)常温下,该废水的pH_____ (填“>”“=”或“<”)7。
(2)“氧化”时反应的离子方程式为_____ ,若用H2O2代替MnO2,则参加反应的n(H2O2)∶n(Fe2+)=_____ 。
(3)“调pH”时,若所得滤渣1为少量MnO2和另一种氢氧化物,应控制溶液pH的调节范围是_____ 。
(4)“除钴镍”时,发生的反应为 等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是
等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是_____ 。
(5)“电解”时,阳极电极反应式为_____ ;电解液可以返回“_____ ”(填工序名称)循环应用。
(6)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=_____ mol·L-1。
 。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 7.5 | 3.7 | 8.4 | 8.2 | 9.8 |
回答下列问题:
(1)常温下,该废水的pH
(2)“氧化”时反应的离子方程式为
(3)“调pH”时,若所得滤渣1为少量MnO2和另一种氢氧化物,应控制溶液pH的调节范围是
(4)“除钴镍”时,发生的反应为
 等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是
等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是(5)“电解”时,阳极电极反应式为
(6)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=
您最近半年使用:0次
名校
解题方法
5 . 卤素互化物、拟卤素与卤素单质的结构,性质相似。常见的卤素互化物有ICl、IBr等,拟卤素有(CN)2、(SCN)2等。
(1)卤族元素位于元素周期表的_______ 。
(2)79Br和81Br这两种核素的中子数之差的绝对值为_______ 。
(3)①Cl2;②ICl;③IBr三种物质熔点由高到低的顺序为_______ 。
(4)①已知CN-与N2结构相似,CN-的电子式为______ 。
②推算HCN分子中σ键与π键数目之比为_______ 。
③关于氨基氰(N≡C-NH2)分子的说法中正确的是_______ 。
A.C原子采用sp3杂化
B.N原子的杂化形式有sp与sp3杂化
C.C≡N键的键长大于C-N键
D.所有原子满足8电子稳定结构
开采的金矿可用氰化法提取,步骤如下:
i.将金矿砂溶于pH为10.5~11的KCN溶液,并鼓入空气,过滤除去矿渣,得含K[Au(CN)2]的滤液;
ii.向滤液中加入足量金属锌,得单质金。Zn+2K[Au(CN)2]=2Au+K2[Zn(CN)4]
(5)K[Au(CN)2]中Au+的配体为______ 。
(6)K2[Zn(CN)4]中Au+的配位数为______ 。
(7)i中反应的离子方程式为:_______ 。
 Au+
Au+ CN-+
CN-+ _______+
_______+ _______=
_______= [Au(CN)2]-+
[Au(CN)2]-+ _______
_______
(8)已知Ka(HCN)=4.0×10-10。i中,pH<10.5会导致相同时间内Au的浸取率下降,原因_______ 。
(1)卤族元素位于元素周期表的
| A.s区 | B.p区 | C.d区 | D.f区 |
(3)①Cl2;②ICl;③IBr三种物质熔点由高到低的顺序为
| A.①>②>③ | B.③>②>① | C.②>①>③ | D.③>①>② |
②推算HCN分子中σ键与π键数目之比为
③关于氨基氰(N≡C-NH2)分子的说法中正确的是
A.C原子采用sp3杂化
B.N原子的杂化形式有sp与sp3杂化
C.C≡N键的键长大于C-N键
D.所有原子满足8电子稳定结构
开采的金矿可用氰化法提取,步骤如下:
i.将金矿砂溶于pH为10.5~11的KCN溶液,并鼓入空气,过滤除去矿渣,得含K[Au(CN)2]的滤液;
ii.向滤液中加入足量金属锌,得单质金。Zn+2K[Au(CN)2]=2Au+K2[Zn(CN)4]
(5)K[Au(CN)2]中Au+的配体为
(6)K2[Zn(CN)4]中Au+的配位数为
(7)i中反应的离子方程式为:
 Au+
Au+ CN-+
CN-+ _______+
_______+ _______=
_______= [Au(CN)2]-+
[Au(CN)2]-+ _______
_______(8)已知Ka(HCN)=4.0×10-10。i中,pH<10.5会导致相同时间内Au的浸取率下降,原因
您最近半年使用:0次
名校
解题方法
6 . 以铁镍合金(含少量铜)为原料,生产电极材粗 的部分工艺流程如下:
的部分工艺流程如下:

已知:常温下,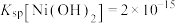 ,
,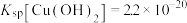 ,
,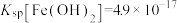 ,
,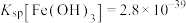 。
。
回答下列问题:
(1)基态Ni原子价层电子轨道表示式是_______ ;Cu原子位于周期表中_______ 区。
(2)“酸溶”时Ni转化为 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是_______ 。
(3)“氧化”时 的作用是(用离子方程式表示)
的作用是(用离子方程式表示)_______ 。
(4)“除铜”时若选用NaOH溶液,会导致部分 也产生沉淀,当常温时溶液中
也产生沉淀,当常温时溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中
_______ 。
(5)“沉镍”时得到碳酸镍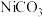 沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式是
,该反应的化学方程式是_______ 。
(6)金属镍的配合物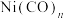 用途广泛,其中配体CO与
用途广泛,其中配体CO与 结构相似,CO分子内σ键与π键个数之比为
结构相似,CO分子内σ键与π键个数之比为_______ 。
 的部分工艺流程如下:
的部分工艺流程如下:
已知:常温下,
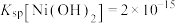 ,
,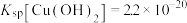 ,
,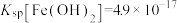 ,
,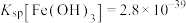 。
。回答下列问题:
(1)基态Ni原子价层电子轨道表示式是
(2)“酸溶”时Ni转化为
 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是(3)“氧化”时
 的作用是(用离子方程式表示)
的作用是(用离子方程式表示)(4)“除铜”时若选用NaOH溶液,会导致部分
 也产生沉淀,当常温时溶液中
也产生沉淀,当常温时溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中
(5)“沉镍”时得到碳酸镍
 沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式是
,该反应的化学方程式是(6)金属镍的配合物
 用途广泛,其中配体CO与
用途广泛,其中配体CO与 结构相似,CO分子内σ键与π键个数之比为
结构相似,CO分子内σ键与π键个数之比为
您最近半年使用:0次
7 . 某小组用硫铜矿煅烧废渣(主要含Fe2O3、CuO、FeO)为原料制取Cu2O,流程如图:
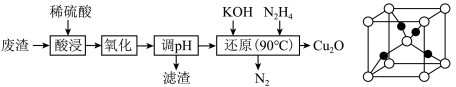
下列说法错误的是

下列说法错误的是
| A.“调节pH”时可以选择CuO或Cu(OH)2 |
| B.“还原”过程中消耗的CuSO4、N2H4的物质的量之比为4:1 |
| C.用N2H4还原制取Cu2O的优点是产生N2氛围,可防止产品被氧化 |
| D.Cu2O的晶胞结构如上图所示,1个Cu2O晶胞中含1个氧原子 |
您最近半年使用:0次
名校
8 . 下列反应的离子方程式表述正确的是
A.金属钠投入 溶液中: 溶液中: |
B.氯化铝溶液与过量浓氨水混合: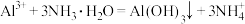 |
C.向NaHSO3溶液中滴 溶液: 溶液: |
D.向酸性高锰酸钾溶液中滴加过氧化氢: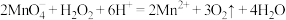 |
您最近半年使用:0次
名校
解题方法
9 . 水体污染物中氮元素以水溶性硝态氮(以 、
、 形式存在)和水溶性铵态氮(以
形式存在)和水溶性铵态氮(以 的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
(1)研究表明,在反硝化细菌作用下,可用乙酸(CH3COOH)处理酸性废水中的 ,产生两种对大气无污染的气体。该反应的离子方程式为
,产生两种对大气无污染的气体。该反应的离子方程式为___________ 。
(2)有人研究用纳米零价铁去除水体中 。
。
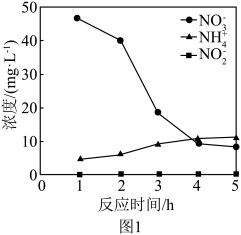
①控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其原因是
)浓度减少,其原因是___________ 。
②将一定量纳米零价铁和少量铜粉附着在生物炭上,可将 转化为
转化为 ,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是___________ ;
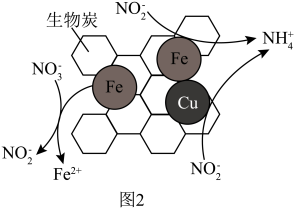
③如图2所示, 转化为
转化为 的反应机理可描述为:
的反应机理可描述为: 得到纳米零价铁失去的电子转化为
得到纳米零价铁失去的电子转化为 ,
,___________ 。
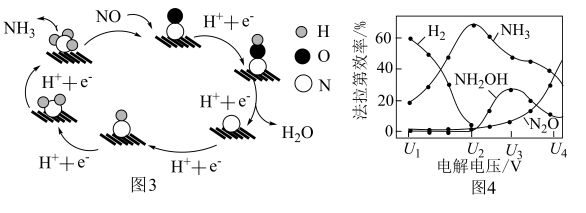
(3)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%)随电解电压的变化如图4所示。已知 ,
, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数; 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
①当电解电压为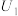 时,电解生成
时,电解生成 和
和 的物质的量之比为
的物质的量之比为___________ 。
②当电解电压为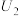 时,催化电解NO生成
时,催化电解NO生成 的电极反应式为
的电极反应式为___________ 。
 、
、 形式存在)和水溶性铵态氮(以
形式存在)和水溶性铵态氮(以 的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。
的主要形式存在),处理后可使水中氮含量达到国家规定的排放标准。(1)研究表明,在反硝化细菌作用下,可用乙酸(CH3COOH)处理酸性废水中的
 ,产生两种对大气无污染的气体。该反应的离子方程式为
,产生两种对大气无污染的气体。该反应的离子方程式为(2)有人研究用纳米零价铁去除水体中
 。
。①控制其他条件不变,用纳米零价铁还原水体中的
 ,测得溶液中
,测得溶液中 、
、 浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如图1所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其原因是
)浓度减少,其原因是
②将一定量纳米零价铁和少量铜粉附着在生物炭上,可将
 转化为
转化为 ,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图2所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是
③如图2所示,
 转化为
转化为 的反应机理可描述为:
的反应机理可描述为: 得到纳米零价铁失去的电子转化为
得到纳米零价铁失去的电子转化为 ,
,(3)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%)随电解电压的变化如图4所示。已知
 ,
, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;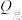 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
①当电解电压为
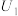 时,电解生成
时,电解生成 和
和 的物质的量之比为
的物质的量之比为②当电解电压为
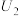 时,催化电解NO生成
时,催化电解NO生成 的电极反应式为
的电极反应式为
您最近半年使用:0次
解题方法
10 . 电池有铅蓄电池、燃料电池(如NO2NH3电池)、锂离子电池、Mg—次氯酸盐电池等,它们可以将化学能转化为电能。NH3、CH4、NaBH4都可用作燃料电池的燃料。CH4的燃烧热为890.3kJ•mol-1。电解则可以将电能转化为化学能,电解饱和NaCl溶液可以得到Cl2,用电解法可制备消毒剂高铁酸钠(Na2FeO4)。下列化学反应表示正确的是
A.铅蓄电池的正极反应:Pb-2e-+SO =PbSO4 =PbSO4 |
B.电解饱和NaCl溶液:2Na++2Cl- 2Na+Cl2↑ 2Na+Cl2↑ |
| C.CH4燃烧:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890.3kJ•mol-1 |
D.一定条件下NO2与NH3的反应:6NO2+8NH3 7N2+12H2O 7N2+12H2O |
您最近半年使用:0次

 、
、
 吸收剂
吸收剂

