名校
解题方法
1 . 碱式氧化镍是镍电池的正极活性材料。利用镍渣(主要含NiO,及少量 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下:
(2)浸渣的主要成分是_______ 。
(3)“沉铜”过程中生成单质S的离子方程式为______ 。
(4)“氧化”中的目的是将 氧化为
氧化为 ,试剂R可选用
,试剂R可选用_____ (填标号)。写出“氧化”时反应的离子方程式:_____ 。
A.氯水 B. 酸性溶液 C.
酸性溶液 C.
(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为
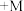 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为_______ 。
(6)若用2.0t废料(含NiO75%)制得NiOOH 0.92 t,则NiOOH的产率为_____ %。
 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下: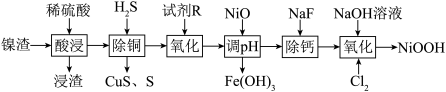
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(2)浸渣的主要成分是
(3)“沉铜”过程中生成单质S的离子方程式为
(4)“氧化”中的目的是将
 氧化为
氧化为 ,试剂R可选用
,试剂R可选用A.氯水 B.
 酸性溶液 C.
酸性溶液 C.
(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为

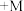 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为(6)若用2.0t废料(含NiO75%)制得NiOOH 0.92 t,则NiOOH的产率为
您最近半年使用:0次
2024-05-03更新
|
200次组卷
|
2卷引用:广东省茂名市高州中学2023-2024学年高二下学期期中考试化学试题
名校
2 . 高砷煤中含有砷硫铁(FeAsS)等物质。燃煤产生的烟气中含NO、SO2、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
(1)燃煤固硫
①燃用高砷煤时加入生石灰将大部分硫元素转化为___________ (填化学式)留在煤渣中。
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成As2O3释放到烟气中,该反应的化学方程式为___________ 。
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将NH3、NO、O2转化为N2.烟气中含有的As2O3会使钒氧化物催化剂中毒。
①在SCR脱硝的反应中还原剂为___________ (填化学式)。
②研究发现砷中毒机理主要是As2O3分子破坏了催化剂的Lewis酸位点,使V=O数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构。___________ 。
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(NH3或铵盐)会影响水泥的性能。
取50.00 g粉煤灰加入NaOH蒸出NH3,用20 mL 0.100 0 mol·L-1的H2SO4溶液吸收NH3,用0.200 0 mol·L-1 NaOH溶液滴定过量的H2SO4至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以NH3计的氨含量(用mg·g-1表示,写出计算过程)。___________
(1)燃煤固硫
①燃用高砷煤时加入生石灰将大部分硫元素转化为
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成As2O3释放到烟气中,该反应的化学方程式为
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将NH3、NO、O2转化为N2.烟气中含有的As2O3会使钒氧化物催化剂中毒。
①在SCR脱硝的反应中还原剂为
②研究发现砷中毒机理主要是As2O3分子破坏了催化剂的Lewis酸位点,使V=O数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构。
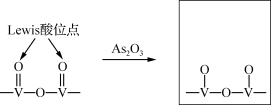
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(NH3或铵盐)会影响水泥的性能。
取50.00 g粉煤灰加入NaOH蒸出NH3,用20 mL 0.100 0 mol·L-1的H2SO4溶液吸收NH3,用0.200 0 mol·L-1 NaOH溶液滴定过量的H2SO4至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以NH3计的氨含量(用mg·g-1表示,写出计算过程)。
您最近半年使用:0次
名校
3 . 氮、磷及其化合物应用广泛。磷元素有白磷、红磷等单质,白磷(P4)分子结构及晶胞如下图所示,实验室常用CuSO4溶液吸收有毒气体PH3,生成H3PO4、H2SO4和Cu。P元素可形成多种含氧酸,其中次磷酸(H3PO2)为一元弱酸;磷酸可与铁反应,在金属表面生成致密且难溶于水的磷酸盐膜。

| A.用氨水和AlCl3溶液制备Al(OH)3:Al3++3OH-=Al(OH)3↓ |
| B.工业上用足量氨水吸收SO2:NH3·H2O+SO2=NH4HSO3 |
| C.用CuSO4溶液吸收PH3:PH3+4CuSO4+4H2O=4Cu↓+H3PO4+4H2SO4 |
| D.次磷酸与足量NaOH溶液反应:H3PO2+3NaOH=Na3PO2+3H2O |
您最近半年使用:0次
名校
4 . 化学社团的学生们查阅相关资料并设计了如下装置制备亚硝酰氯(NOCl)。 。
。
②亚硝酰氯熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应。
1.装置的连接顺序为a→b→c→___________ →h,实验时先打开分液漏斗活塞滴入稀硝酸,当观察到F中___________ 时,开始向装置中通入 。
。
2.写出A中发生的化学方程式___________ 。
3.装置B的作用是___________ ,装置D中长颈漏斗的作用是___________ 。
制得的亚硝酰氯(NOCl)中可能含有少量杂质,化学社团的同学们设计了如下实验测定NOCl的纯度。
①取5.000g,三颈烧瓶中所得产物溶于适量氢氧化钠溶液中,然后加入一定量稀硫酸和KI溶液,并通入足量 ,将NO全部赶出,最后将溶液稀释至500.00mL;
,将NO全部赶出,最后将溶液稀释至500.00mL;
②取25.00mL上述所得溶液,用淀粉作指示剂,用0.15
 标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。
已知:
①
②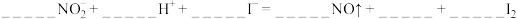
③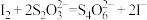
4.补充并配平反应②并标出电子转移的方向和数目___________ 。
5.滴定终点的现象___________ ,结合相关数据,计算实验测得产品中NOCl的纯度为___________ (保留三位小数)。
6.下列操作将导致NOCl纯度测量偏低的是___________。

 。
。②亚硝酰氯熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应。
1.装置的连接顺序为a→b→c→
 。
。2.写出A中发生的化学方程式
3.装置B的作用是
制得的亚硝酰氯(NOCl)中可能含有少量杂质,化学社团的同学们设计了如下实验测定NOCl的纯度。
①取5.000g,三颈烧瓶中所得产物溶于适量氢氧化钠溶液中,然后加入一定量稀硫酸和KI溶液,并通入足量
 ,将NO全部赶出,最后将溶液稀释至500.00mL;
,将NO全部赶出,最后将溶液稀释至500.00mL;②取25.00mL上述所得溶液,用淀粉作指示剂,用0.15

 标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。已知:
①

②
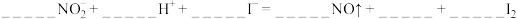
③
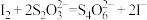
4.补充并配平反应②并标出电子转移的方向和数目
5.滴定终点的现象
6.下列操作将导致NOCl纯度测量偏低的是___________。
A.滴定过程中剧烈振荡导致 挥发 挥发 |
| B.滴定前滴定管有气泡,滴定后气泡消失 |
| C.锥形瓶用待测液润洗 |
D.滴定管用蒸馏水润洗后,直接加入 标准溶液进行滴定 标准溶液进行滴定 |
您最近半年使用:0次
解题方法
5 . 次氯酸作为消毒剂,被广泛应用于物体表面、织物等污染物品的消毒。某小组涉及如下装置(部分夹持装置略)制备 。
。 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;
ⅱ. 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;
ⅲ. 在
在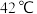 以上会分解。
以上会分解。
请回答下列问题:
(1)写出装置①中发生反应的化学方程式:_____ 。
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:_____ ;饱和食盐水也可替换为_____ 。
(3)制备 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_____ 。
(4)装置④的作用是_____ ;装置⑤中多孔球泡的作用是_____ 。
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b._____ 。
 。
。
 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;ⅱ.
 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;ⅲ.
 在
在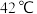 以上会分解。
以上会分解。请回答下列问题:
(1)写出装置①中发生反应的化学方程式:
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:
(3)制备
 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)装置④的作用是
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b.
您最近半年使用:0次
名校
6 . 丙烯腈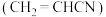 是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与
是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与 反应制得。原理如下HC≡CH+HCN
反应制得。原理如下HC≡CH+HCN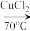 CH2=CHCN
CH2=CHCN
Ⅰ.制备催化剂
(1)通过查阅资料有两种方案可以制备
方案1:铜屑与 在浓盐酸中反应
在浓盐酸中反应
方案2:铜丝在氯气中燃烧
方案1的实验原理如图所示 的名称
的名称___________ 。
②请用离子方程式表达,写出方案1的反应原理___________ 。
(2)用恒压滴液漏斗分批多次滴加 ,且
,且 过量,原因是
过量,原因是___________ 。
(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体 ,为检测
,为检测 的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测
的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测 为
为___________ 。
Ⅱ.合成丙烯腈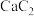 ,还含有少量硫化钙
,还含有少量硫化钙
②易挥发,有毒,具有较强的还原性
(4) 的电子式
的电子式___________ 。
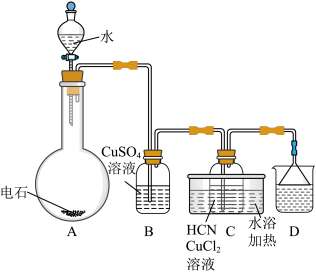
(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有臭鸡蛋气味,这种物质是___________ 。
(6)从下列选择装置D中可盛放的溶液___________。
(7)工业用 含
含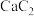 质量分数
质量分数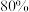 的电石,实际生产得到丙烯腈
的电石,实际生产得到丙烯腈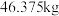 ,计算产率
,计算产率_______ 。(写出计算过程)
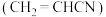 是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与
是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与 反应制得。原理如下HC≡CH+HCN
反应制得。原理如下HC≡CH+HCN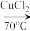 CH2=CHCN
CH2=CHCNⅠ.制备催化剂

(1)通过查阅资料有两种方案可以制备
方案1:铜屑与
 在浓盐酸中反应
在浓盐酸中反应方案2:铜丝在氯气中燃烧
方案1的实验原理如图所示
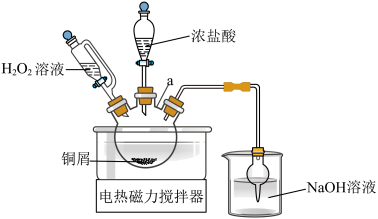
 的名称
的名称②请用离子方程式表达,写出方案1的反应原理
(2)用恒压滴液漏斗分批多次滴加
 ,且
,且 过量,原因是
过量,原因是(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体
 ,为检测
,为检测 的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测
的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测 为
为Ⅱ.合成丙烯腈
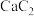 ,还含有少量硫化钙
,还含有少量硫化钙②易挥发,有毒,具有较强的还原性
(4)
 的电子式
的电子式(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有臭鸡蛋气味,这种物质是
(6)从下列选择装置D中可盛放的溶液___________。
| A.高锰酸钾溶液 | B. 溶液 溶液 | C.饱和食盐水 | D.盐酸溶液 |
(7)工业用
 含
含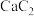 质量分数
质量分数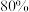 的电石,实际生产得到丙烯腈
的电石,实际生产得到丙烯腈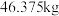 ,计算产率
,计算产率
您最近半年使用:0次
解题方法
7 . 一种处理废旧电池正极材料(主要成分为 ),制备三元锂电池正极材料
),制备三元锂电池正极材料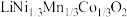 的工业流程如下:
的工业流程如下:
② 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。
回答下列问题:
(1)基态 价层电子排布图是
价层电子排布图是_____ 。
(2)“酸浸”中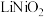 发生反应的化学方程式为
发生反应的化学方程式为_____ ;“酸浸”中 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是_____ 。
(3)假设正极材料酸浸后溶液中金属阳离子浓度均为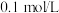 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是_____ (溶液中某离子浓度小于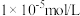 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。
(4)“沉锂”过程发生反应的离子方程式为_____ 。
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行_____ (填“预烧”、“酸洗”或“搅拌”)。
(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为: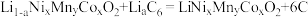 (石墨)
(石墨)
放电时工作装置简图如下,写出放电时A电极的电极反应式_____ 。
 ),制备三元锂电池正极材料
),制备三元锂电池正极材料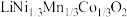 的工业流程如下:
的工业流程如下: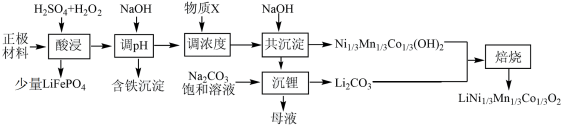

②
 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。| 物质 |  | 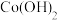 | 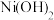 | 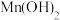 |
 | 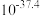 | 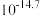 | 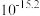 |  |
(1)基态
 价层电子排布图是
价层电子排布图是(2)“酸浸”中
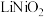 发生反应的化学方程式为
发生反应的化学方程式为 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是(3)假设正极材料酸浸后溶液中金属阳离子浓度均为
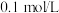 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是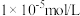 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。(4)“沉锂”过程发生反应的离子方程式为
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的
 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为:
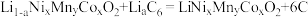 (石墨)
(石墨)放电时工作装置简图如下,写出放电时A电极的电极反应式

您最近半年使用:0次
2024-04-29更新
|
54次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
解题方法
8 . 以菱锌矿(主要含有ZnCO3,另含有少量CaO、Fe2O3、FeO、CoO、CuO、SiO2等)为原料电解制Zn的流程如图:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有___________ (写出一种即可)。
(2)“调pH过滤”中,物质X最适宜选择___________ (填标号)。
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为___________ 。若反应结束时,溶液pH为5,则残留的c(Fe3+)=___________ mol·L-l。
(4)H2O2是常见绿色氧化剂,原因是___________ 。
(5)“脱钙镁过滤”后,溶液中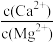 =
=___________ 。
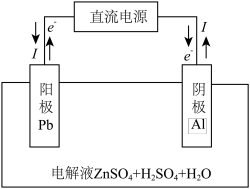
(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为___________ 。
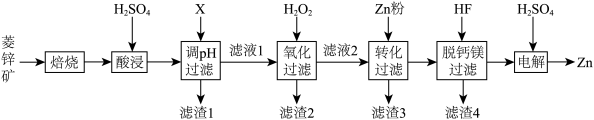
| 物质 | Fe(OH)3 | Zn(OH)2 | MgF2 | CaF2 |
| Ksp | 2.7×10-39 | 1.3×10-17 | 5.2×10-11 | 3.9×10-9 |
(1)“酸浸”时为提高锌的浸出率,可采取的措施有
(2)“调pH过滤”中,物质X最适宜选择
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为
(4)H2O2是常见绿色氧化剂,原因是
(5)“脱钙镁过滤”后,溶液中
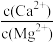 =
=(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
您最近半年使用:0次
解题方法
9 . 高压氢还原法可直接从溶液中提取金属粉。以硫化铜(CuS)精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下: 如下表所示:
如下表所示:
请回答下列问题:
(1)“浸取”时能提高反应速率的措施有_____ (答一条即可)。
(2)“浸取”时增大 压强可促进
压强可促进 的浸出,从沉淀溶解平衡角度进行解释:
的浸出,从沉淀溶解平衡角度进行解释:_____ 。
(3)固体 的主要成分是
的主要成分是 和
和_____ (填化学式)。
(4)利用上述表格数据,计算 的
的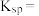
_____ 。
(5)“中和调 ”应控制的
”应控制的 范围是
范围是_____ 。
(6)“还原”中发生反应的离子方程式为_____ 。
(7)金属 为
为_____ 。

 如下表所示:
如下表所示:| 物质 |  |  |  |
开始沉淀 的 的 | 2.2 | 5.2 | 6.7 |
沉淀完全 的 的 | 3.2 | 6.7 | 8.2 |
(1)“浸取”时能提高反应速率的措施有
(2)“浸取”时增大
 压强可促进
压强可促进 的浸出,从沉淀溶解平衡角度进行解释:
的浸出,从沉淀溶解平衡角度进行解释:(3)固体
 的主要成分是
的主要成分是 和
和(4)利用上述表格数据,计算
 的
的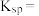
(5)“中和调
 ”应控制的
”应控制的 范围是
范围是(6)“还原”中发生反应的离子方程式为
(7)金属
 为
为
您最近半年使用:0次
名校
解题方法
10 . 有效去除大气中的NOx和水体中的氮,并且转化为可利用的资源是重要课题。
(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=_______ kJ·mol-1
(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。_______ (请填“C”或“D”)极相连。
②该电解池的阳极反应式为_______ 。
③该电解池(图乙)中离子交换膜为_______ (请填“阴”或“阳”)离子交换膜。
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)_______ mol。
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的活化能。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮( 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。_______ 。
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是_______ 。
(1)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: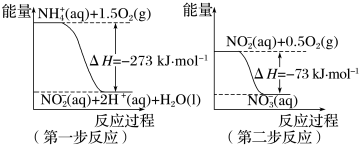
 (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。
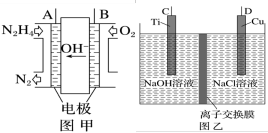
②该电解池的阳极反应式为
③该电解池(图乙)中离子交换膜为
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
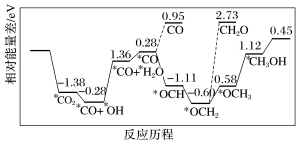
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(
 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。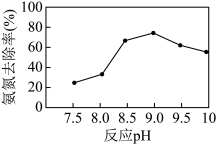
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是
您最近半年使用:0次



