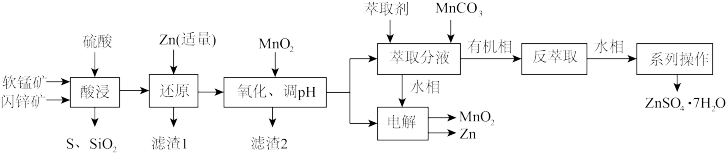
1 . 资源的综合利用越来越受到重视。科研人员综合利用软锰矿(含MnO2,少量SiO2、Al2O3)和闪锌矿(含ZnS,少量FeS、CuS、SiO2)制备ZnSO4∙7H2O、Zn和MnO2的工艺流程如下:
已知:25℃时相关物质的Ksp见下表。
(开始沉淀的金属离子浓度为1.0 mol∙L-1;金属离子浓度≤1.0×10-5 mol∙L-1时,可认为该离子沉淀完全。)
回答下列问题:
(1)“酸浸”时,MnO2和CuS反应生成MnSO4,氧化产物与还原产物物质的量之比为_______ 。
(2)加适量Zn还原的金属阳离子是_______ ,加MnO2氧化Fe2+生成滤渣的离子方程式为_______ ,调节pH的范围是_______ 。
(3)“萃取”过程中,发生如下阳离子交换反应: ,
, (HR代表有机萃取剂,易挥发)。加入MnCO3的作用为
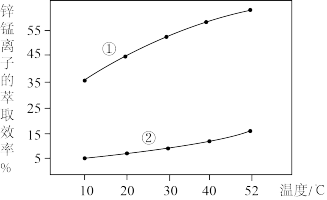
(HR代表有机萃取剂,易挥发)。加入MnCO3的作用为_______ 。实验测定锌锰离子的萃取率与温度的关系如图所示,表示Zn2+的萃取效率的曲线是_______ (填“①”“②”),萃取反应温度一般选择常温,理由为_______ 。
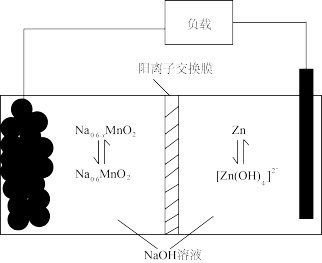
(4)“电解”产物可用于Na-Zn双离子电池中(装置如图)。电池工作时,正极上发生的电极反应为_______ ;每转移0.1mol电子,负极区电解质溶液质量增加_______ g。

已知:25℃时相关物质的Ksp见下表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| Ksp |  | 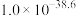 |  |  |  |
回答下列问题:
(1)“酸浸”时,MnO2和CuS反应生成MnSO4,氧化产物与还原产物物质的量之比为
(2)加适量Zn还原的金属阳离子是
(3)“萃取”过程中,发生如下阳离子交换反应:
 ,
, (HR代表有机萃取剂,易挥发)。加入MnCO3的作用为
(HR代表有机萃取剂,易挥发)。加入MnCO3的作用为
(4)“电解”产物可用于Na-Zn双离子电池中(装置如图)。电池工作时,正极上发生的电极反应为

您最近一年使用:0次
名校
2 .  去除酸性废水中
去除酸性废水中 的反应机理如图所示(图中“HS·”为自由基)。下列说法错误的是
的反应机理如图所示(图中“HS·”为自由基)。下列说法错误的是
 去除酸性废水中
去除酸性废水中 的反应机理如图所示(图中“HS·”为自由基)。下列说法错误的是
的反应机理如图所示(图中“HS·”为自由基)。下列说法错误的是
A.X的化学式为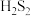 |
| B.HS·反应活性较强,不能稳定存在 |
| C.步骤III反应中氧化剂与还原剂的物质的量比为8∶1 |
D.步骤IV除砷的方程式为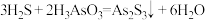 |
您最近一年使用:0次
2023-04-26更新
|
611次组卷
|
4卷引用:山东省济宁市2023届高三二模考试(4月)化学试题
3 . 以镉铁矿(主要成分为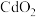 )为原料制备
)为原料制备 的部分工艺流程如下:
的部分工艺流程如下:
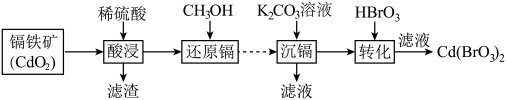
已知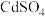 溶于水,
溶于水,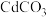 难溶于水。下列说法不正确的是
难溶于水。下列说法不正确的是
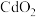 )为原料制备
)为原料制备 的部分工艺流程如下:
的部分工艺流程如下:
已知
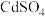 溶于水,
溶于水,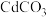 难溶于水。下列说法不正确的是
难溶于水。下列说法不正确的是A.已知 在周期表中位于第五周期第ⅡB族,则 在周期表中位于第五周期第ⅡB族,则 的价层电子排布式是 的价层电子排布式是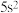 |
B.还原镉时可产生 ,该反应中氧化剂与还原剂的物质的量之比为3∶1 ,该反应中氧化剂与还原剂的物质的量之比为3∶1 |
C.“沉镉”所得滤液中的 ,其空间构型是正四面体 ,其空间构型是正四面体 |
D.“转化”中发生的反应为: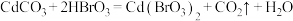 |
您最近一年使用:0次
名校
解题方法
4 . 利用V2O3制备氧钒碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}的工艺流程如下:

已知:+4价钒在弱酸性环境中具有还原性。下列说法正确的是

已知:+4价钒在弱酸性环境中具有还原性。下列说法正确的是
| A.V2O3制备NaVO3过程中,氧化剂与还原剂物质的量之比为1:2 |
B.生成V2O5的反应为2NaVO3+2NH4C1 2NaC1+V2O5+2NH3↑ 2NaC1+V2O5+2NH3↑ |
| C.由V2O5制备VOC12的两种路径,路径I更符合绿色化学思想 |
| D.路径II中若盐酸浓度过低,可能生成副产物VO2Cl |
您最近一年使用:0次
2023-03-19更新
|
657次组卷
|
4卷引用:山东省烟台市、德州市、滨州市2023届高三一模考试化学试题
解题方法
5 . “价一类”二维图是研究物质性质的重要工具,下图是硫元素的“价一类”二维图。

回答下列问题:
(1)c→d反应的化学方程式为_______ 。
(2)反应a+c→b中,氧化产物与还原产物的物质的量之比为_______ 。
(3)溶液e久置于空气中会生成f,该过程溶液的酸性_______ (填“增强”或“减弱”)。
(4)可用铜与f的浓溶液反应制备c,反应的化学方程式为_______ 。
(5)将c通入到酸性KMnO4溶液中,溶液颜色逐渐变浅,该反应中c表现出_______ (填“还原”或“漂白”)性。

回答下列问题:
(1)c→d反应的化学方程式为
(2)反应a+c→b中,氧化产物与还原产物的物质的量之比为
(3)溶液e久置于空气中会生成f,该过程溶液的酸性
(4)可用铜与f的浓溶液反应制备c,反应的化学方程式为
(5)将c通入到酸性KMnO4溶液中,溶液颜色逐渐变浅,该反应中c表现出
您最近一年使用:0次
解题方法
6 . 汽车安全气囊系统中有一定比例的叠氮化钠( ),氧化铁、硝酸铵等物质,受到撞击点火器点火引发叠氨化钠迅速分解生成氮气和钠,硝酸铵分解为一氧化二氮和水蒸气。下列说法错误的是
),氧化铁、硝酸铵等物质,受到撞击点火器点火引发叠氨化钠迅速分解生成氮气和钠,硝酸铵分解为一氧化二氮和水蒸气。下列说法错误的是
 ),氧化铁、硝酸铵等物质,受到撞击点火器点火引发叠氨化钠迅速分解生成氮气和钠,硝酸铵分解为一氧化二氮和水蒸气。下列说法错误的是
),氧化铁、硝酸铵等物质,受到撞击点火器点火引发叠氨化钠迅速分解生成氮气和钠,硝酸铵分解为一氧化二氮和水蒸气。下列说法错误的是| A.叠氮化钠的稳定性较弱 |
| B.硝酸铵分解反应中,氧化剂和还原剂的物质的量之比为2∶1 |
| C.金属钠和氧化铁反应生成铁和氧化钠 |
| D.该系统利用了化学反应的物质变化、能量变化和化学反应速率等因素 |
您最近一年使用:0次
解题方法
7 . 铁、氯元素的单质及化合物与生产、生活密切相关,请回答下列问题。
(1)铁元素与人体健康密切相关,工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,原因是NaNO2把人体内血红蛋白中的Fe2+转化为Fe3+而失去与O2结合的能力。上述事实说明NaNO2具有_______ 性,工业盐中毒后,可服用维生素C来缓解中毒状况,说明维生素C具有_______ 性。
(2)含氯消毒剂在生产生活中有着广泛的用途。
①写出实验室实中用二氧化锰与浓盐酸制取氯气的离子方程式_______ ,在制备和收集氯气的实验过程中,下列选项正确的是_______ (填字母)。
a.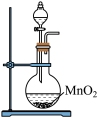 b.
b. 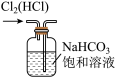 c.
c. 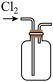 d.
d. 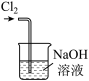
A.用装置a制取氯气 B.用装置b除去氯气中的少量氯化氢
C.用装置c收集氯气 D.用装置d吸收多余的氯气
②实验室也可以用高锰酸钾与浓盐酸制取氯气。已知KMnO4与浓盐酸反应的化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。0.1molKMnO4发生上述反应,消耗_______ molHCl,其中有_______ molHCl被氧化。分别利用二氧化锰和高锰酸钾制备等量的氯气,消耗HCl的物质的量之比为_______ 。
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的数目为_______ 。
④氯气通入石灰乳中可以制得漂白粉,氯气被氧化得到的产物是_______ ,还原剂与氧化剂的质量之比为_______ 。某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与 的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为_______ 。
(1)铁元素与人体健康密切相关,工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,原因是NaNO2把人体内血红蛋白中的Fe2+转化为Fe3+而失去与O2结合的能力。上述事实说明NaNO2具有
(2)含氯消毒剂在生产生活中有着广泛的用途。
①写出实验室实中用二氧化锰与浓盐酸制取氯气的离子方程式
a.
 b.
b.  c.
c.  d.
d. 
A.用装置a制取氯气 B.用装置b除去氯气中的少量氯化氢
C.用装置c收集氯气 D.用装置d吸收多余的氯气
②实验室也可以用高锰酸钾与浓盐酸制取氯气。已知KMnO4与浓盐酸反应的化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。0.1molKMnO4发生上述反应,消耗
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的数目为
④氯气通入石灰乳中可以制得漂白粉,氯气被氧化得到的产物是
 的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
您最近一年使用:0次
名校
解题方法
8 . “铬鞣制法”可以使皮革变的柔软和耐用,为检测皮革中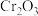 的含量,可以采取碘量法测定,过程如下:
的含量,可以采取碘量法测定,过程如下:
①高温熔融: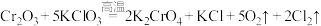
②酸化: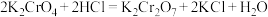
③加碘化钾滴定: 、
、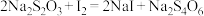
若皮革样品质量为 ,滴定过程共消耗
,滴定过程共消耗 的
的 。下列说法正确的是
。下列说法正确的是
 的含量,可以采取碘量法测定,过程如下:
的含量,可以采取碘量法测定,过程如下:①高温熔融:
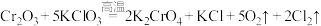
②酸化:
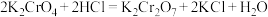
③加碘化钾滴定:
 、
、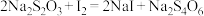
若皮革样品质量为
 ,滴定过程共消耗
,滴定过程共消耗 的
的 。下列说法正确的是
。下列说法正确的是| A.反应①中氧化剂与还原剂的物质的量比为5∶1 |
B. 元素参与了3个氧化还原过程 元素参与了3个氧化还原过程 |
C.实验过程中,所得 与 与 的物质的量比可能大于5∶2 的物质的量比可能大于5∶2 |
D.皮革中 的含量为 的含量为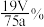 |
您最近一年使用:0次
2022-11-09更新
|
326次组卷
|
4卷引用:山东省潍坊市2022-2023学年高三上学期期中考试化学考试题
名校
解题方法
9 . 某化学小组在实验室中利用 进行如下实验。下列说法错误的是
进行如下实验。下列说法错误的是

 进行如下实验。下列说法错误的是
进行如下实验。下列说法错误的是
A.红色固体是 |
| B.加热过程发生的反应中氧化产物与还原产物的物质的量之比为1∶1 |
C.在标准状况下,气体Y的体积可能为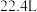 |
D.气体Y通入 溶液中可产生白色沉淀 溶液中可产生白色沉淀 |
您最近一年使用:0次
2022-11-09更新
|
336次组卷
|
4卷引用:山东省潍坊市2022-2023学年高三上学期期中考试化学考试题
解题方法
10 . 科学家发明了一种硫自养生物反应装置,该装置可将酸性废水中 还原为更易被去除的
还原为更易被去除的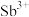 ,其反应机理如图。下列说法正确的是
,其反应机理如图。下列说法正确的是

 还原为更易被去除的
还原为更易被去除的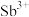 ,其反应机理如图。下列说法正确的是
,其反应机理如图。下列说法正确的是 
| A.该过程可以实现S单质的循环利用 |
B.反应①的离子方程式为: |
C.生成 时,转移 时,转移 |
D.生成 参加反应的S中氧化剂与还原剂物质的量比为3∶1 参加反应的S中氧化剂与还原剂物质的量比为3∶1 |
您最近一年使用:0次
2022-07-08更新
|
205次组卷
|
2卷引用:山东省东营市2021-2022学年高二下学期期末考试化学试题



