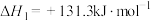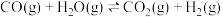名校
解题方法
1 . 推动 的综合利用实现碳中和是党中央作出的重大战略决策。
的综合利用实现碳中和是党中央作出的重大战略决策。
Ⅰ. 催化加氢法:以下是
催化加氢法:以下是 催化加氢合成二甲醚发生的两个主要反应:
催化加氢合成二甲醚发生的两个主要反应:
反应Ⅰ:
反应Ⅱ:
(1)反应
___________ 。
(2)在恒压、 和
和 起始量一定的条件下,
起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图。其中:
的选择性随温度的变化如图。其中: 的选择性
的选择性
 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是___________ 。
②220℃时,在催化剂作用下 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性为:
的选择性为: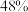 (图中
(图中 点)。不改变反应时间和温度,一定能提高
点)。不改变反应时间和温度,一定能提高 选择性的措施有:
选择性的措施有:___________ 。(答1点即可)
Ⅱ. 催化加氢法:高炉气中捕集
催化加氢法:高炉气中捕集 制
制 的综合利用示意图如图所示。
的综合利用示意图如图所示。 。
。
(3)T℃时,当吸收池中溶液的 时,此时该溶液中
时,此时该溶液中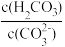 =
=___________ 。
(4)电解池中 电催化还原为
电催化还原为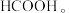
① 在铂电极反应方程式为
在铂电极反应方程式为___________ 。
②铂电极上的副反应除析氢外,没有其它放电过程。若生成 的电解效率
的电解效率 ,当电路中转移
,当电路中转移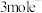 时,阴极室溶液的质量增加
时,阴极室溶液的质量增加___________  。定义:
。定义: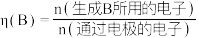
 的综合利用实现碳中和是党中央作出的重大战略决策。
的综合利用实现碳中和是党中央作出的重大战略决策。Ⅰ.
 催化加氢法:以下是
催化加氢法:以下是 催化加氢合成二甲醚发生的两个主要反应:
催化加氢合成二甲醚发生的两个主要反应:反应Ⅰ:

反应Ⅱ:

(1)反应

(2)在恒压、
 和
和 起始量一定的条件下,
起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图。其中:
的选择性随温度的变化如图。其中: 的选择性
的选择性
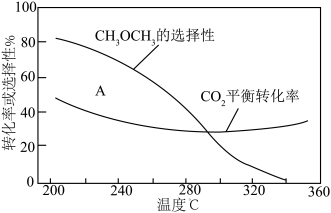
 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是②220℃时,在催化剂作用下
 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性为:
的选择性为: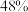 (图中
(图中 点)。不改变反应时间和温度,一定能提高
点)。不改变反应时间和温度,一定能提高 选择性的措施有:
选择性的措施有:Ⅱ.
 催化加氢法:高炉气中捕集
催化加氢法:高炉气中捕集 制
制 的综合利用示意图如图所示。
的综合利用示意图如图所示。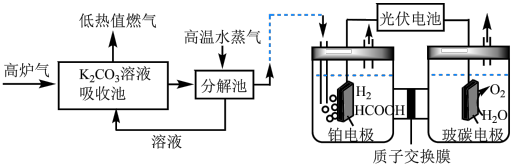
 。
。(3)T℃时,当吸收池中溶液的
 时,此时该溶液中
时,此时该溶液中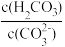 =
=(4)电解池中
 电催化还原为
电催化还原为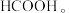
①
 在铂电极反应方程式为
在铂电极反应方程式为②铂电极上的副反应除析氢外,没有其它放电过程。若生成
 的电解效率
的电解效率 ,当电路中转移
,当电路中转移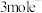 时,阴极室溶液的质量增加
时,阴极室溶液的质量增加 。定义:
。定义: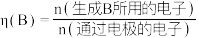
您最近半年使用:0次
名校
2 . 化学反应中均伴随有能量变化。回答下列问题:
(1)下列反应中,反应物的总能量小于生成物的总能量的是___________ (填选项字母)。
A.Na2O2与H2O反应 B.乙醇的燃烧反应 C.CaCO3受热分解
(2)已知25℃时,下列物质的相对能量如表所示:
①表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
②36g 分解生成
分解生成 和
和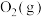
___________ (填“吸收”或“放出”)___________ kJ的热量。
(3)已知反应: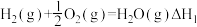

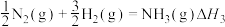
写出氨气和氧气反应生成NO2和水蒸气的热化学方程式___________ (用 、
、 、
、 、
、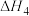 表示反应的
表示反应的 )
)
(4)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为
 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程___________ (填“吸收”或“放出”)的热量是___________ kJ。
(5)甲醇是一种新型的汽车动力燃料。
①以 和
和 为原料合成甲醇(CH3OH),反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇(CH3OH),反应的能量变化如下图所示,则图中A处应填写的内容为___________ 。
设CO以C≡O键构成,则工业制备甲醇的热化学方程式为___________ 。
(1)下列反应中,反应物的总能量小于生成物的总能量的是
A.Na2O2与H2O反应 B.乙醇的燃烧反应 C.CaCO3受热分解
(2)已知25℃时,下列物质的相对能量如表所示:
| 物质 |  | 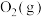 |  | 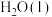 |
| 相对能量(kJ·mol-1) | 0 | 0 | -242 | -286 |
 燃烧热的热化学方程式为
燃烧热的热化学方程式为②36g
 分解生成
分解生成 和
和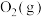
(3)已知反应:
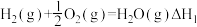

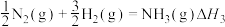
写出氨气和氧气反应生成NO2和水蒸气的热化学方程式
 、
、 、
、 、
、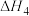 表示反应的
表示反应的 )
)(4)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为
 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程(5)甲醇是一种新型的汽车动力燃料。
①以
 和
和 为原料合成甲醇(CH3OH),反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇(CH3OH),反应的能量变化如下图所示,则图中A处应填写的内容为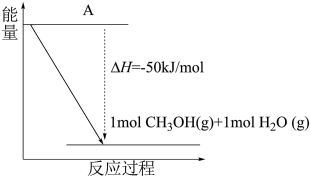
②工业上利用CO和H2来制备甲醇(CH3OH,结构式为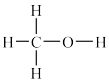 )气体。已知某些化学键的键能数据如下表:
)气体。已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
您最近半年使用:0次
3 . 乙醇是一种重要的化工产品,有关乙醇的研究是化工生产中重要的课题。
(1)乙醇部分氧化制氢涉及以下几个反应:
①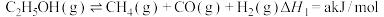
②
③
存在反应乙醇中氢原子全部转化为目标产物: ,则该反应的反应热
,则该反应的反应热
___________  (用含
(用含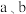 和
和 的式子表示)。
的式子表示)。
(2)用乙醇制乙烯,其他条件相同,乙醇转化率和乙烯选择性 [
[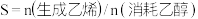 ]随温度、乙醇进料量(mL·min-1)的关系如图甲所示。在
]随温度、乙醇进料量(mL·min-1)的关系如图甲所示。在 温度范围内,下列说法正确的是___________。
温度范围内,下列说法正确的是___________。
(3)利用二甲醚催化羰化制备乙醇主要涉及以下两个反应:
反应I:CO(g)+CH3OCH3(g) CH3COOCH3(g)
CH3COOCH3(g)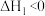
反应Ⅱ:CH3COOCH3(g)+2H2(g) CH3CH2OH(g)+CH3OH(g)
CH3CH2OH(g)+CH3OH(g) 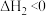
在固定CO、CH3OCH3、H2的原料比及体系压强不变的条件下,同时发生反应I、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图乙所示。___________ 。
②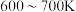 时,
时,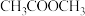 物质的量分数随温度升高而降低的原因是
物质的量分数随温度升高而降低的原因是___________ 。
③一定温度和压强下,向初始体积为1L的密闭容器中通入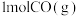 和
和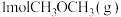 与
与 ,发生以上两反应,测得平衡时
,发生以上两反应,测得平衡时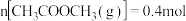 ,体积减小
,体积减小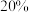 ,则平衡时,
,则平衡时,
___________ ,反应Ⅱ的平衡常数
___________ (保留2位有效数字)。
(4)用KOH溶液吸收工业废气中的CO2,电解得到的K2CO3溶液可生产乙醇等有机物。相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率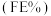 随电解电压的变化如图所示:
随电解电压的变化如图所示: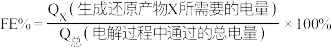
选择性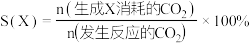
写出当电解电压为U1时阴极主要发生的电极反应式___________ 。当电解电压为U2时,生成CH3CH2OH和HCOO-的选择性之比为___________ 。
(1)乙醇部分氧化制氢涉及以下几个反应:
①
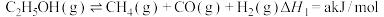
②

③

存在反应乙醇中氢原子全部转化为目标产物:
 ,则该反应的反应热
,则该反应的反应热
 (用含
(用含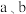 和
和 的式子表示)。
的式子表示)。(2)用乙醇制乙烯,其他条件相同,乙醇转化率和乙烯选择性
 [
[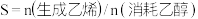 ]随温度、乙醇进料量(mL·min-1)的关系如图甲所示。在
]随温度、乙醇进料量(mL·min-1)的关系如图甲所示。在 温度范围内,下列说法正确的是___________。
温度范围内,下列说法正确的是___________。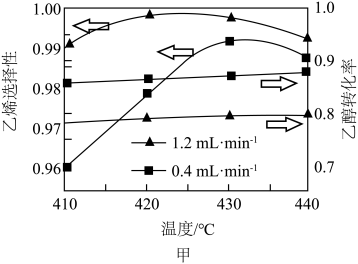
| A.一定温度下,增大乙醇进料量,乙醇转化率增大 |
| B.当温度一定,随乙醇进料量增大,乙烯选择性增大 |
| C.当乙醇进料量一定,随乙醇转化率增大,乙烯选择性升高 |
| D.当乙醇进料量一定,随温度的升高,乙烯选择性不一定增大 |
(3)利用二甲醚催化羰化制备乙醇主要涉及以下两个反应:
反应I:CO(g)+CH3OCH3(g)
 CH3COOCH3(g)
CH3COOCH3(g)
反应Ⅱ:CH3COOCH3(g)+2H2(g)
 CH3CH2OH(g)+CH3OH(g)
CH3CH2OH(g)+CH3OH(g) 
在固定CO、CH3OCH3、H2的原料比及体系压强不变的条件下,同时发生反应I、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图乙所示。
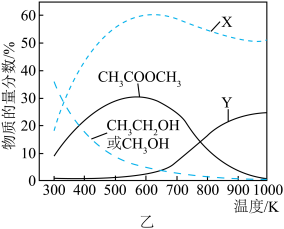
②
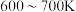 时,
时,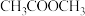 物质的量分数随温度升高而降低的原因是
物质的量分数随温度升高而降低的原因是③一定温度和压强下,向初始体积为1L的密闭容器中通入
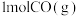 和
和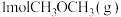 与
与 ,发生以上两反应,测得平衡时
,发生以上两反应,测得平衡时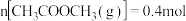 ,体积减小
,体积减小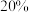 ,则平衡时,
,则平衡时,

(4)用KOH溶液吸收工业废气中的CO2,电解得到的K2CO3溶液可生产乙醇等有机物。相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率
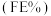 随电解电压的变化如图所示:
随电解电压的变化如图所示:
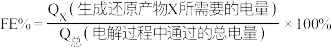
选择性
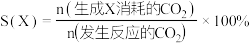
写出当电解电压为U1时阴极主要发生的电极反应式
您最近半年使用:0次
4 . 氢能新质生产力正加速发展。工业上利用天然气制备氢气,还能得到乙烯、乙炔等化工产品,有关反应原理如下:
反应①:2CH4(g) C2H2(g)+3H2(g) ∆H1=+376.3kJ/mol K1;
C2H2(g)+3H2(g) ∆H1=+376.3kJ/mol K1;
反应②:2CH4(g) C2H4(g)+2H2(g) ∆H2=+202.0kJ/mol K2;
C2H4(g)+2H2(g) ∆H2=+202.0kJ/mol K2;
回答下列问题:
(1)反应③:C2H2(g)+2H2(g) C2H4(g) ∆H3=
C2H4(g) ∆H3=___________ kJ/mol,K3=___________ (用含K1、K2的代数式表示)。
(2)若用 、
、 、
、 和
和 表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应①,从吸附到解吸的过程中,能量状态最高的是
表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应①,从吸附到解吸的过程中,能量状态最高的是___________ (填字母)。___________ T2(填“>”“<”或“=”)。
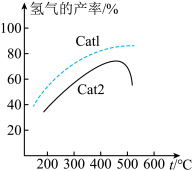
(4)向恒温恒容密闭容器中充入适量CH4,同时发生上述反应①和反应②,在不同催化剂Cat1、Cat2作用下,测得单位时间内H2的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是___________ (填“Cat1”或“Cat2”)。在Cat2作用下,温度高于500℃时,H2的产率迅速降低的原因是___________ 。 C2H2(g)+H2(g)制备氢气。
C2H2(g)+H2(g)制备氢气。
①实际操作中,往往向反应器中充入一定量的水蒸气,其目的是___________ 。
②忽略其他副反应,若向反应器中充入5mol水蒸气,平衡时(C2H4的转化率为75%,则该反应的Kp=___________ 。
反应①:2CH4(g)
 C2H2(g)+3H2(g) ∆H1=+376.3kJ/mol K1;
C2H2(g)+3H2(g) ∆H1=+376.3kJ/mol K1;反应②:2CH4(g)
 C2H4(g)+2H2(g) ∆H2=+202.0kJ/mol K2;
C2H4(g)+2H2(g) ∆H2=+202.0kJ/mol K2;回答下列问题:
(1)反应③:C2H2(g)+2H2(g)
 C2H4(g) ∆H3=
C2H4(g) ∆H3=(2)若用
 、
、 、
、 和
和 表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应①,从吸附到解吸的过程中,能量状态最高的是
表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应①,从吸附到解吸的过程中,能量状态最高的是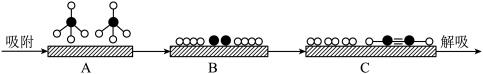
(4)向恒温恒容密闭容器中充入适量CH4,同时发生上述反应①和反应②,在不同催化剂Cat1、Cat2作用下,测得单位时间内H2的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是
 C2H2(g)+H2(g)制备氢气。
C2H2(g)+H2(g)制备氢气。①实际操作中,往往向反应器中充入一定量的水蒸气,其目的是
②忽略其他副反应,若向反应器中充入5mol水蒸气,平衡时(C2H4的转化率为75%,则该反应的Kp=
您最近半年使用:0次
名校
解题方法
5 . 铁的化合物在工业中有重要价值。回答下列问题:
(1)复合氧化物铁酸锰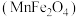 可用于热化学循环分解制氢气,原理如下:
可用于热化学循环分解制氢气,原理如下:
①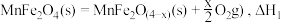
②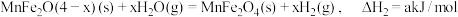
③
则 的燃烧热
的燃烧热
___________ 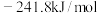 (填>、=或<),
(填>、=或<),
___________ (用含a的代数式表示)
(2)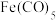 是一种重要的催化剂,制取反应为
是一种重要的催化剂,制取反应为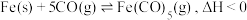 。在
。在 恒容密闭容器中加入足量铁粉和
恒容密闭容器中加入足量铁粉和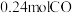 。
。
①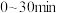 内在T温度下进行反应,测得
内在T温度下进行反应,测得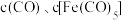 随时间的变化关系,以及
随时间的变化关系,以及 和
和 开始随条件的变化关系如图甲所示。
开始随条件的变化关系如图甲所示。 内用
内用 表示的平均反应速率为
表示的平均反应速率为___________  ;则此温度下的
;则此温度下的
___________ (写出计算式即可)。
②曲线I代表___________ [填 或
或 ]浓度的变化,
]浓度的变化,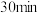 时改变的条件是
时改变的条件是___________ 。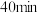 后曲线Ⅱ下降的原因是
后曲线Ⅱ下降的原因是___________ 。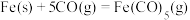 达到平衡状态的是
达到平衡状态的是___________ 。
A.密度保持不变 B. 体积分数保持不变
体积分数保持不变
C.平均摩尔质量保持不变 D.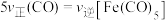
(1)复合氧化物铁酸锰
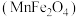 可用于热化学循环分解制氢气,原理如下:
可用于热化学循环分解制氢气,原理如下:①
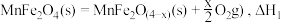
②
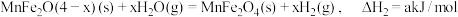
③

则
 的燃烧热
的燃烧热
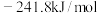 (填>、=或<),
(填>、=或<),
(2)
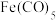 是一种重要的催化剂,制取反应为
是一种重要的催化剂,制取反应为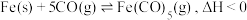 。在
。在 恒容密闭容器中加入足量铁粉和
恒容密闭容器中加入足量铁粉和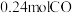 。
。①
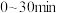 内在T温度下进行反应,测得
内在T温度下进行反应,测得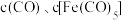 随时间的变化关系,以及
随时间的变化关系,以及 和
和 开始随条件的变化关系如图甲所示。
开始随条件的变化关系如图甲所示。 内用
内用 表示的平均反应速率为
表示的平均反应速率为 ;则此温度下的
;则此温度下的
②曲线I代表
 或
或 ]浓度的变化,
]浓度的变化,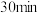 时改变的条件是
时改变的条件是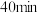 后曲线Ⅱ下降的原因是
后曲线Ⅱ下降的原因是
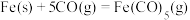 达到平衡状态的是
达到平衡状态的是A.密度保持不变 B.
 体积分数保持不变
体积分数保持不变C.平均摩尔质量保持不变 D.
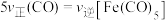
您最近半年使用:0次
6 . 用 还原
还原 可合成
可合成 。回答下列问题:
。回答下列问题:
(1)利用 光解水制
光解水制 具有重要的经济价值,原理如图所示。
具有重要的经济价值,原理如图所示。 表面发生的电极反应式为
表面发生的电极反应式为_____ 。
写出 还原
还原 生成
生成 和
和 的热化学方程式:
的热化学方程式:_____ 。
(3)一定条件下,向某恒容密闭容器中充入2
 和3
和3
 反应生成
反应生成 和
和 ,起始时压强为
,起始时压强为 ,测得在相同时间内不同温度下
,测得在相同时间内不同温度下 的转化率如图所示。
的转化率如图所示。_____ 。
② K时,该反应的平衡常数
K时,该反应的平衡常数
_____ (列出计算式即可,不必化简。以分压代替浓度,分压=总压×物质的量分数)。
(4)为了探究浓度对反应速率的影响,473K时,向某恒容密闭容器中充入 和
和 进行实验,实验数据如下表所示:
进行实验,实验数据如下表所示:
该反应速率的通式为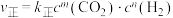 ,
,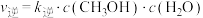 (
( 、
、 是只与温度有关的速率常数)。由表中数据可确定反应速率通式中
是只与温度有关的速率常数)。由表中数据可确定反应速率通式中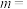
_____ 、
_____ 。实验发现,当实验1中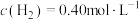 时达到平衡,请计算该温度下此反应的
时达到平衡,请计算该温度下此反应的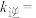
_____ 。
 还原
还原 可合成
可合成 。回答下列问题:
。回答下列问题:(1)利用
 光解水制
光解水制 具有重要的经济价值,原理如图所示。
具有重要的经济价值,原理如图所示。 表面发生的电极反应式为
表面发生的电极反应式为
| 共价键 |  |  |  |  |  |
键能/( ) ) | 464 | 358 | 799 | 432 | 411 |
 还原
还原 生成
生成 和
和 的热化学方程式:
的热化学方程式:(3)一定条件下,向某恒容密闭容器中充入2

 和3
和3
 反应生成
反应生成 和
和 ,起始时压强为
,起始时压强为 ,测得在相同时间内不同温度下
,测得在相同时间内不同温度下 的转化率如图所示。
的转化率如图所示。
②
 K时,该反应的平衡常数
K时,该反应的平衡常数
(4)为了探究浓度对反应速率的影响,473K时,向某恒容密闭容器中充入
 和
和 进行实验,实验数据如下表所示:
进行实验,实验数据如下表所示:| 实验 | 起始浓度/( ) ) | 初始速率/( ) ) | |
 |  | ||
| 1 | 0.25 | 1.00 | 0.45 |
| 2 | 0.25 | 2.00 | 3.60 |
| 3 | 2.00 | 1.00 | 3.6 |
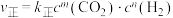 ,
,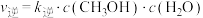 (
( 、
、 是只与温度有关的速率常数)。由表中数据可确定反应速率通式中
是只与温度有关的速率常数)。由表中数据可确定反应速率通式中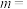

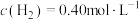 时达到平衡,请计算该温度下此反应的
时达到平衡,请计算该温度下此反应的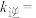
您最近半年使用:0次
名校
解题方法
7 . 有效去除大气中的NOx和水体中的氮是环境保护的重要课题。
(1)已知:①2CO(g)+O2(g)=2CO2(g);ΔH1=-566.0kJ·mol-1
②N2(g)+2O2(g)=2NO2(g);ΔH2=+64kJ·mol-1
反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g);ΔH3=________ 。
(2)近年研究发现,电催化CO2和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。________ 。
(3)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(NH 和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH
和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH ),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。
),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。
①生成磷酸铵镁沉淀的离子反应方程式为________ 。
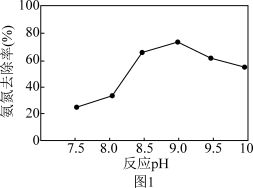
②测得反应pH对氨氮去除率的影响如下图1所示,当pH从7.5增至9.0的过程中,水中氨氮的去除率明显增加,原因是________ 。
①NZVI/BC和(CuPd)/BC复合材料还原硝酸盐的反应机理如下图2所示, 转化为N2或
转化为N2或 的过程可描述为
的过程可描述为________ 。 去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是
去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是________ 。
(1)已知:①2CO(g)+O2(g)=2CO2(g);ΔH1=-566.0kJ·mol-1
②N2(g)+2O2(g)=2NO2(g);ΔH2=+64kJ·mol-1
反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g);ΔH3=
(2)近年研究发现,电催化CO2和含氮物质(
 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。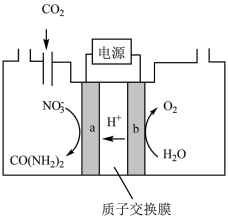
(3)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(NH
 和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH
和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH ),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。
),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。①生成磷酸铵镁沉淀的离子反应方程式为
②测得反应pH对氨氮去除率的影响如下图1所示,当pH从7.5增至9.0的过程中,水中氨氮的去除率明显增加,原因是
①NZVI/BC和(CuPd)/BC复合材料还原硝酸盐的反应机理如下图2所示,
 转化为N2或
转化为N2或 的过程可描述为
的过程可描述为 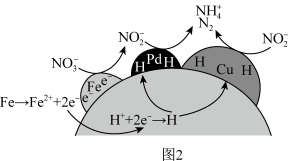
 去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是
去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是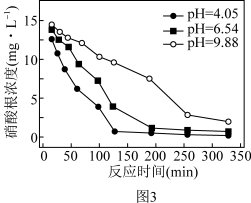
您最近半年使用:0次
解题方法
8 . 二氧化碳加氢制甲烷过程中的主要反应为
Ⅰ.

Ⅱ.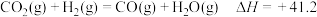

在密闭容器中, 时,
时, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率随温度的变化如图所示。
实际转化率随温度的变化如图所示。 的选择性可表示为
的选择性可表示为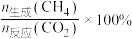 。下列说法正确的是
。下列说法正确的是
Ⅰ.


Ⅱ.
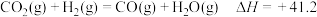

在密闭容器中,
 时,
时, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率随温度的变化如图所示。
实际转化率随温度的变化如图所示。 的选择性可表示为
的选择性可表示为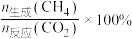 。下列说法正确的是
。下列说法正确的是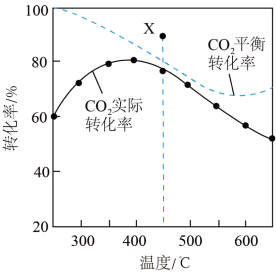
A.反应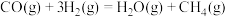 的焓变 的焓变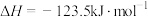 |
B.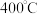 前 前 实际转化率增大的主要原因是:温度升高,反应Ⅱ平衡正移 实际转化率增大的主要原因是:温度升高,反应Ⅱ平衡正移 |
C.降低体系温度, 的平衡选择性增大 的平衡选择性增大 |
D.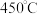 时,使用更高效催化剂,有可能使 时,使用更高效催化剂,有可能使 平衡转化率达到 平衡转化率达到 点 点 |
您最近半年使用:0次
名校
解题方法
9 . 反应: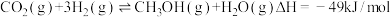 ,可减少
,可减少 排放,并合成清洁能源。
排放,并合成清洁能源。
(1)该反应一般认为通过如下步骤来实现:
①
②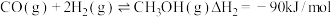 ,
,
已知反应①的v正=k正c(CO2)c(H2),v逆=k逆c(H2O)c(CO)(k正、k逆为速率常数,与温度、催化剂有关),计算
___________ (写出数值);若平衡后升高温度,则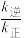
___________ (填“增大”、“不变”或“减小”)。
(2)对于反应 ,将
,将 和
和 以一定的比例在密闭容器中通过两种不同的催化剂(I、Ⅱ)进行反应,相同时间内,
以一定的比例在密闭容器中通过两种不同的催化剂(I、Ⅱ)进行反应,相同时间内, 的转化率
的转化率 随温度变化曲线如图乙所示。
随温度变化曲线如图乙所示。 温度下M点的反应速率
温度下M点的反应速率___________  温度下N点反应速率(填“>”、“<”或“=”)。
温度下N点反应速率(填“>”、“<”或“=”)。
②催化剂Ⅱ条件下,当温度低于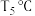 时,
时, 转化率随温度升高而升高的原因可能是:
转化率随温度升高而升高的原因可能是:___________ 。
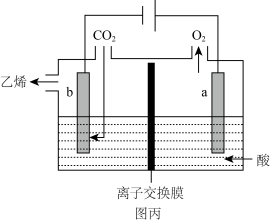
(3)利用电化学法还原二氧化碳制乙烯,在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:___________ ,该装置中使用的是___________ (填“阴”或“阳”)离子交换膜。
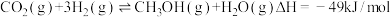 ,可减少
,可减少 排放,并合成清洁能源。
排放,并合成清洁能源。(1)该反应一般认为通过如下步骤来实现:
①

②
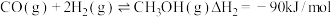 ,
,已知反应①的v正=k正c(CO2)c(H2),v逆=k逆c(H2O)c(CO)(k正、k逆为速率常数,与温度、催化剂有关),计算

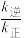
(2)对于反应
 ,将
,将 和
和 以一定的比例在密闭容器中通过两种不同的催化剂(I、Ⅱ)进行反应,相同时间内,
以一定的比例在密闭容器中通过两种不同的催化剂(I、Ⅱ)进行反应,相同时间内, 的转化率
的转化率 随温度变化曲线如图乙所示。
随温度变化曲线如图乙所示。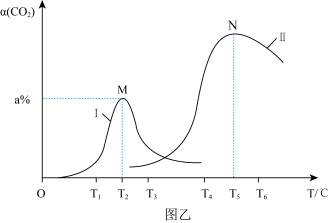
 温度下M点的反应速率
温度下M点的反应速率 温度下N点反应速率(填“>”、“<”或“=”)。
温度下N点反应速率(填“>”、“<”或“=”)。②催化剂Ⅱ条件下,当温度低于
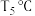 时,
时, 转化率随温度升高而升高的原因可能是:
转化率随温度升高而升高的原因可能是:(3)利用电化学法还原二氧化碳制乙烯,在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:
您最近半年使用:0次
解题方法
10 . 水煤气是一种优质燃料和重要的化工原料,其制备方法是将水蒸气与焦炭在高温下混合反应,然后投入固体 进行处理。
进行处理。
I.在温度 下将高温水蒸气通入炽热的焦炭中,其中可能发生的一些反应如下:
下将高温水蒸气通入炽热的焦炭中,其中可能发生的一些反应如下:
(1)已知反应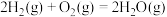 的焓变
的焓变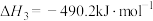 ,近似认为反应焓变不随温度变化,则焦炭的燃烧热
,近似认为反应焓变不随温度变化,则焦炭的燃烧热
______  。
。
(2)在温度 下体系达到化学平衡,将这一时刻记为
下体系达到化学平衡,将这一时刻记为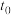 ,然后将可压缩的恒温反应容器突然压缩至原来体积的一半。将压缩之后这一瞬间的时刻记为
,然后将可压缩的恒温反应容器突然压缩至原来体积的一半。将压缩之后这一瞬间的时刻记为 ,重新达到平衡时的时刻记为
,重新达到平衡时的时刻记为 ,则______(填标号)。
,则______(填标号)。
(3)反应②的平衡常数 很小,若近似忽略生成
很小,若近似忽略生成 的反应,在一个体积固定的恒温容器内投入足量焦炭与一定量的水蒸气,在温度
的反应,在一个体积固定的恒温容器内投入足量焦炭与一定量的水蒸气,在温度 下达到平衡时水蒸气的转化率为
下达到平衡时水蒸气的转化率为 ,下图的三条曲线分别代表了达到平衡时不同的转化率
,下图的三条曲线分别代表了达到平衡时不同的转化率 对应的水蒸气分压、
对应的水蒸气分压、 分压、体系的总压,则代表
分压、体系的总压,则代表 分压的曲线是
分压的曲线是______ (填标号)。欲使平衡转化率为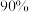 ,则初始充入水蒸气的压强应为
,则初始充入水蒸气的压强应为______  (结果保留两位有效数字)。
(结果保留两位有效数字)。 ,生成
,生成 。除了以外,钙还有多种氧化物。
。除了以外,钙还有多种氧化物。
(4) 在大约
在大约 的高压条件下还可以进一步与
的高压条件下还可以进一步与 反应得到由
反应得到由 和
和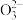 构成的另一种钙的氧化物
构成的另一种钙的氧化物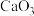 ,预测
,预测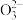 的VSEPR模型名称是
的VSEPR模型名称是______ .
(5)反应生成的 在自然界中会被溶解有
在自然界中会被溶解有 的雨水溶蚀,该过程的离子方程式为
的雨水溶蚀,该过程的离子方程式为______ 。已知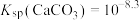 ,碳酸的
,碳酸的 (碳酸浓度以
(碳酸浓度以 形式计算)、
形式计算)、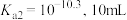 某雨水恰好能够溶解
某雨水恰好能够溶解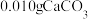 ,此时该雨水中的
,此时该雨水中的 浓度为
浓度为 ,忽略固体溶解产生的体积变化,则此时该雨水的
,忽略固体溶解产生的体积变化,则此时该雨水的 为
为______ 。
 进行处理。
进行处理。I.在温度
 下将高温水蒸气通入炽热的焦炭中,其中可能发生的一些反应如下:
下将高温水蒸气通入炽热的焦炭中,其中可能发生的一些反应如下:反应方程式 | 焓变 | 压强平衡常数 |
① |
|
|
② |
|
|
(1)已知反应
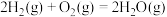 的焓变
的焓变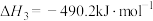 ,近似认为反应焓变不随温度变化,则焦炭的燃烧热
,近似认为反应焓变不随温度变化,则焦炭的燃烧热
 。
。(2)在温度
 下体系达到化学平衡,将这一时刻记为
下体系达到化学平衡,将这一时刻记为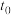 ,然后将可压缩的恒温反应容器突然压缩至原来体积的一半。将压缩之后这一瞬间的时刻记为
,然后将可压缩的恒温反应容器突然压缩至原来体积的一半。将压缩之后这一瞬间的时刻记为 ,重新达到平衡时的时刻记为
,重新达到平衡时的时刻记为 ,则______(填标号)。
,则______(填标号)。A. 时,反应①的正反应速率比 时,反应①的正反应速率比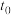 时增大 时增大 | B. 时,反应②的逆反应速率比 时,反应②的逆反应速率比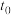 时减小 时减小 |
C. 时,反应①的压强平衡常数 时,反应①的压强平衡常数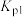 比 比 时增大 时增大 | D. 时,水蒸气的转化率比 时,水蒸气的转化率比 时减小 时减小 |
(3)反应②的平衡常数
 很小,若近似忽略生成
很小,若近似忽略生成 的反应,在一个体积固定的恒温容器内投入足量焦炭与一定量的水蒸气,在温度
的反应,在一个体积固定的恒温容器内投入足量焦炭与一定量的水蒸气,在温度 下达到平衡时水蒸气的转化率为
下达到平衡时水蒸气的转化率为 ,下图的三条曲线分别代表了达到平衡时不同的转化率
,下图的三条曲线分别代表了达到平衡时不同的转化率 对应的水蒸气分压、
对应的水蒸气分压、 分压、体系的总压,则代表
分压、体系的总压,则代表 分压的曲线是
分压的曲线是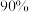 ,则初始充入水蒸气的压强应为
,则初始充入水蒸气的压强应为 (结果保留两位有效数字)。
(结果保留两位有效数字)。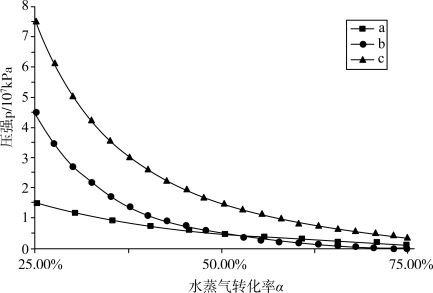
 ,生成
,生成 。除了以外,钙还有多种氧化物。
。除了以外,钙还有多种氧化物。(4)
 在大约
在大约 的高压条件下还可以进一步与
的高压条件下还可以进一步与 反应得到由
反应得到由 和
和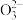 构成的另一种钙的氧化物
构成的另一种钙的氧化物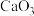 ,预测
,预测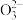 的VSEPR模型名称是
的VSEPR模型名称是(5)反应生成的
 在自然界中会被溶解有
在自然界中会被溶解有 的雨水溶蚀,该过程的离子方程式为
的雨水溶蚀,该过程的离子方程式为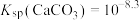 ,碳酸的
,碳酸的 (碳酸浓度以
(碳酸浓度以 形式计算)、
形式计算)、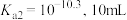 某雨水恰好能够溶解
某雨水恰好能够溶解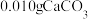 ,此时该雨水中的
,此时该雨水中的 浓度为
浓度为 ,忽略固体溶解产生的体积变化,则此时该雨水的
,忽略固体溶解产生的体积变化,则此时该雨水的 为
为
您最近半年使用:0次