解题方法
1 . 天然气、石油钻探过程会释放出CO2、H2S等气体。某种将CO2和H2S共活化的工艺涉及如下反应:
①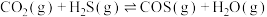
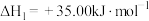
②

③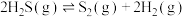
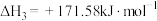
④

回答下列问题:
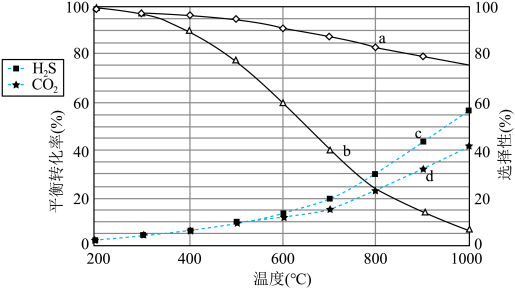
(1)已知:298K时,18g气态水转化为液态水释放出44kJ的能量;H2S(g)的标准摩尔燃烧焓(△H)为-586kJ·mol-1,则COS(g)的标准摩尔燃烧焓( )为
)为___________ kJ·mol-1,反应②在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
(2)一定条件下,向起始压强为200kPa的恒容密闭容器中通入等物质的量的CO2(g)和H2S(g)混合气体,发生上述反应,25min时,测得体系总压强为210kPa,S2(g)的平均反应速率为___________ kPa·min-1.达到平衡时,测得体系总压强为230kPa,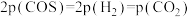 ,此时H2S(g)的平衡转化率为
,此时H2S(g)的平衡转化率为___________ ,反应②的标准平衡常数
___________ (已知:分压=总压×该组分物质的量分数,对于反应 ,
,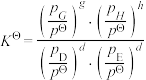 ,其中
,其中 ,
,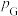 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。
(3)将等物质的量的CO2(g)和H2S(g)混合气体充入恒压密闭容器中,发生上述反应,反应物的平衡转化率、COS或H2O的选择性与温度关系如图所示。COS的选择性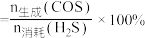 ,H2O的选择性
,H2O的选择性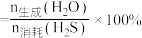 。
。___________ (填“曲线a”或“曲线b”);
②温度低于500℃时,H2S的转化率与CO2的相等,原因是___________ 。
①
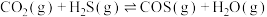
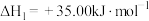
②


③
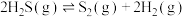
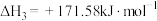
④


回答下列问题:
(1)已知:298K时,18g气态水转化为液态水释放出44kJ的能量;H2S(g)的标准摩尔燃烧焓(△H)为-586kJ·mol-1,则COS(g)的标准摩尔燃烧焓(
 )为
)为(2)一定条件下,向起始压强为200kPa的恒容密闭容器中通入等物质的量的CO2(g)和H2S(g)混合气体,发生上述反应,25min时,测得体系总压强为210kPa,S2(g)的平均反应速率为
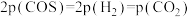 ,此时H2S(g)的平衡转化率为
,此时H2S(g)的平衡转化率为
 ,
, ,其中
,其中 ,
,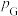 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。(3)将等物质的量的CO2(g)和H2S(g)混合气体充入恒压密闭容器中,发生上述反应,反应物的平衡转化率、COS或H2O的选择性与温度关系如图所示。COS的选择性
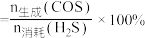 ,H2O的选择性
,H2O的选择性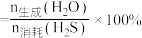 。
。
②温度低于500℃时,H2S的转化率与CO2的相等,原因是
您最近半年使用:0次
2 . I.电解法可处理氯化钙废液同时,吸收CO2,装置如图所示。_______ 和 。
。
II.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、H2还原脱硫:
(2)300℃,发生反应:①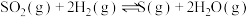

②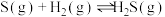

③

请用一个等式来表示三个反应的 之间的关系
之间的关系_______ 。
(3)反应③,在恒温、恒容的密闭容器中,充入 和
和 ,平衡常数
,平衡常数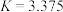 ,测得平衡时
,测得平衡时 和
和 的浓度均为
的浓度均为 ,则平衡时
,则平衡时 的值为
的值为_______ 。
方法二、O2氧化脱硫:
(4)某同学探究活性炭吸附催化氧化 ,以N2作稀释剂,一定温度下,通入
,以N2作稀释剂,一定温度下,通入 、
、 和
和 反应生成
反应生成 ,其中不同温度下,
,其中不同温度下, 在活性炭上的吸附情况如图,下列说法正确的是_______。
在活性炭上的吸附情况如图,下列说法正确的是_______。
(5)在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3,其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由_______ 。
 。
。II.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、H2还原脱硫:
(2)300℃,发生反应:①
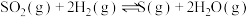

②
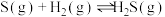

③


请用一个等式来表示三个反应的
 之间的关系
之间的关系(3)反应③,在恒温、恒容的密闭容器中,充入
 和
和 ,平衡常数
,平衡常数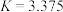 ,测得平衡时
,测得平衡时 和
和 的浓度均为
的浓度均为 ,则平衡时
,则平衡时 的值为
的值为方法二、O2氧化脱硫:
(4)某同学探究活性炭吸附催化氧化
 ,以N2作稀释剂,一定温度下,通入
,以N2作稀释剂,一定温度下,通入 、
、 和
和 反应生成
反应生成 ,其中不同温度下,
,其中不同温度下, 在活性炭上的吸附情况如图,下列说法正确的是_______。
在活性炭上的吸附情况如图,下列说法正确的是_______。
| A.温度越低,SO2的吸附量越高,SO2氧化反应速率越快 |
| B.已知:SO2的物理吸附过程能自发进行,可推断该过程是熵减、放热的过程,温度过高不利 |
| C.原料中水蒸气的含量越大,脱硫速率一定越快 |
D.随着时间的推移,SO2吸附速率降低,可能是由于生成的 占据了吸附位点没及时脱出导致 占据了吸附位点没及时脱出导致 |
(5)在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3,其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由

您最近半年使用:0次
7日内更新
|
127次组卷
|
2卷引用:浙江绍兴市2023-2024学年高三下学期选考科目适应性考试化学试题
名校
解题方法
3 . 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①
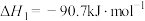

②
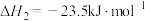

③
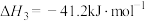

回答下列问题:
(1)反应 的平衡常数K=
的平衡常数K=________ (用 、
、 、
、 表示)。
表示)。
(2)在保持反应物投料不变的情况下,请写出一条提高甲醇产率的措施________ 。
(3)一定温度下,将0.2molCO和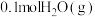 通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得
通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5min内
的体积分数为0.1。则0~5min内
________ ,CO的转化率为________ 。
(4)将合成气以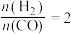 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应:
 ,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是________ (填字母)。 B.
B.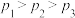 C.若在
C.若在 和316℃时,起始时
和316℃时,起始时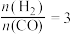 ,则平衡时,α(CO)小于50%
,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和 制备二甲醚(DME)。观察图2,当
制备二甲醚(DME)。观察图2,当 约为
约为________ 时最有利于二甲醚的合成。
①

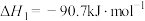

②

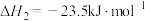

③

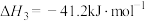

回答下列问题:
(1)反应
 的平衡常数K=
的平衡常数K= 、
、 、
、 表示)。
表示)。(2)在保持反应物投料不变的情况下,请写出一条提高甲醇产率的措施
(3)一定温度下,将0.2molCO和
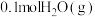 通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得
通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5min内
的体积分数为0.1。则0~5min内
(4)将合成气以
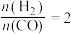 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应:
 ,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
图1
A. B.
B.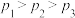 C.若在
C.若在 和316℃时,起始时
和316℃时,起始时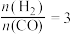 ,则平衡时,α(CO)小于50%
,则平衡时,α(CO)小于50%(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和
 制备二甲醚(DME)。观察图2,当
制备二甲醚(DME)。观察图2,当 约为
约为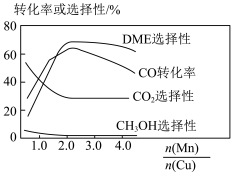
图2
您最近半年使用:0次
名校
解题方法
4 . 化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。
(1)汽车排气管内的催化转化器可实现尾气无毒处理。
已知:


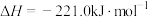
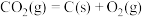
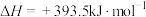 ,则:
,则:
①反应 的
的
________  。
。
②在600K时,将3.0molNO、3.6molCO通入固定容积3L的密闭容器中,20min后,反应达平衡,测得 的浓度为
的浓度为 ,则NO的转化率α=
,则NO的转化率α=________ 。
③若改变下列条件之一,达新平衡时NO的体积分数一定减小的是________ (填序号)。
a.增加CO的量 b.加入催化剂 c.降低温度 d.扩大容器体积
(2)某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
①探究浓度对平衡的影响
已知四氯合钴(Ⅱ)离子(蓝色)与六水合钴(Ⅱ)离子(粉红色)之间存在如下平衡: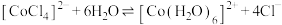 。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为
。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为________ 色;乙同学向溶液中加水,平衡移动方向为________ (填“向右”、“向左”或“不移动”),说明原因________ 。
②运用数字化实验探究压强对平衡的影响
将一收集满干燥 的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。________ 。
(1)汽车排气管内的催化转化器可实现尾气无毒处理。
已知:



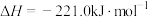
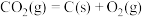
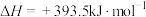 ,则:
,则:①反应
 的
的
 。
。②在600K时,将3.0molNO、3.6molCO通入固定容积3L的密闭容器中,20min后,反应达平衡,测得
 的浓度为
的浓度为 ,则NO的转化率α=
,则NO的转化率α=③若改变下列条件之一,达新平衡时NO的体积分数一定减小的是
a.增加CO的量 b.加入催化剂 c.降低温度 d.扩大容器体积
(2)某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
①探究浓度对平衡的影响
已知四氯合钴(Ⅱ)离子(蓝色)与六水合钴(Ⅱ)离子(粉红色)之间存在如下平衡:
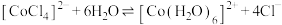 。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为
。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为②运用数字化实验探究压强对平衡的影响
将一收集满干燥
 的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
您最近半年使用:0次
名校
解题方法
5 .  是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为
是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为 。主反应如下:
。主反应如下:
反应Ⅰ.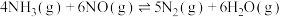
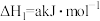
反应Ⅱ.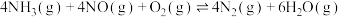
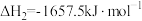
(1)已知:
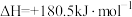 。则
。则
_______  。某条件下对于反应Ⅰ,
。某条件下对于反应Ⅰ, ,
,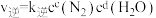 ,
, 、
、 为速率常数。升高温度时,
为速率常数。升高温度时, 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则m_______ n(填“>”、“<”或“=”)。
(2)将模拟烟气按一定的流量通入掺杂不同金属的催化剂,在不同温度下进行反应并测定相关物质浓度,得出不同情况下NO的转化率、 的选择性、
的选择性、 的生成量随温度变化关系如下图。
的生成量随温度变化关系如下图。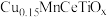 时,温度高于260℃时NO转化率下降的原因可能是
时,温度高于260℃时NO转化率下降的原因可能是_______ 。
②综合考虑应选择_______ 为该脱硝过程的催化剂,选择合适的催化剂_______ (填写“能”或“不能”)提高 的平衡产率。
的平衡产率。
③为探究氨的催化脱硝过程中生成 的机理,将含有不同同位素原子的物质(
的机理,将含有不同同位素原子的物质(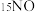 与
与 、
、 )通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。
)通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。 与NO、
与NO、 反应生成
反应生成 的化学方程式为
的化学方程式为_______ (需标出N原子的质量数)。
(3)当温度为273℃,在恒容密闭的容器中,假设仅发生两个主反应。通入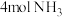 、
、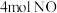 、
、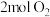 ,初始压强为
,初始压强为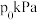 情况下,达到平衡后测定
情况下,达到平衡后测定 转化率为30%,平衡体系中
转化率为30%,平衡体系中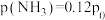 。则NO的转化率为
。则NO的转化率为______ ,反应Ⅱ的
______ (写出计算式即可)。
 是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为
是一种脱硝性能较好的催化剂。采用共沉淀法等比掺入金属M后,催化剂的脱硝性能会发生改变。烟气脱硝主要副产物为 。主反应如下:
。主反应如下:反应Ⅰ.
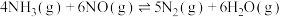
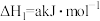
反应Ⅱ.
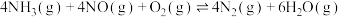
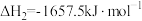
(1)已知:

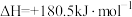 。则
。则
 。某条件下对于反应Ⅰ,
。某条件下对于反应Ⅰ, ,
,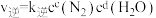 ,
, 、
、 为速率常数。升高温度时,
为速率常数。升高温度时, 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则m(2)将模拟烟气按一定的流量通入掺杂不同金属的催化剂,在不同温度下进行反应并测定相关物质浓度,得出不同情况下NO的转化率、
 的选择性、
的选择性、 的生成量随温度变化关系如下图。
的生成量随温度变化关系如下图。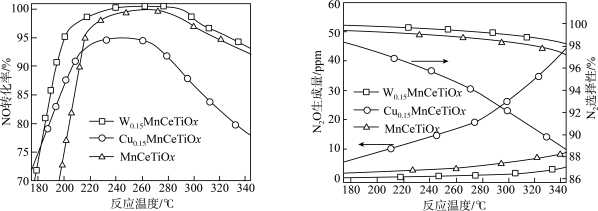
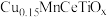 时,温度高于260℃时NO转化率下降的原因可能是
时,温度高于260℃时NO转化率下降的原因可能是②综合考虑应选择
 的平衡产率。
的平衡产率。③为探究氨的催化脱硝过程中生成
 的机理,将含有不同同位素原子的物质(
的机理,将含有不同同位素原子的物质(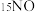 与
与 、
、 )通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。
)通入反应容器进行一系列温度编程实验,通过质谱仪测定产物气体分子的含量随温度的变化曲线如下图。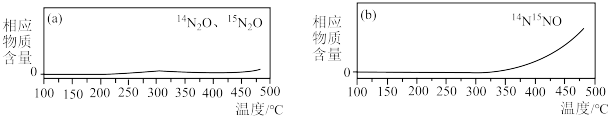
 与NO、
与NO、 反应生成
反应生成 的化学方程式为
的化学方程式为(3)当温度为273℃,在恒容密闭的容器中,假设仅发生两个主反应。通入
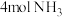 、
、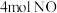 、
、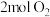 ,初始压强为
,初始压强为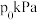 情况下,达到平衡后测定
情况下,达到平衡后测定 转化率为30%,平衡体系中
转化率为30%,平衡体系中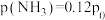 。则NO的转化率为
。则NO的转化率为
您最近半年使用:0次
名校
解题方法
6 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
(1)甲醇可以替代汽油和柴油作为内燃机燃料。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25°C、101 kPa 时,1 molC8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应燃烧热的热化学方程式为_______ 。
(2)甲醇的合成以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。_________ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______ 。(填“变大”“变小”或“不变”)
(3)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1= -870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2= -393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) ΔH3= -285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=__________ 。
(1)甲醇可以替代汽油和柴油作为内燃机燃料。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25°C、101 kPa 时,1 molC8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应燃烧热的热化学方程式为
(2)甲醇的合成以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
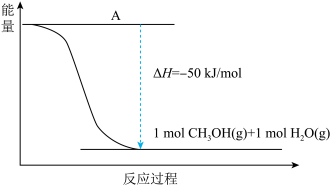
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH
(3)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1= -870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2= -393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) ΔH3= -285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=
您最近半年使用:0次
名校
7 . 油气开采、石油化工、煤化工等行业的废气中普遍含有 ,需要对
,需要对 回收处理并加以利用。
回收处理并加以利用。
已知:①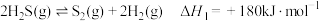
②
③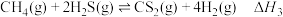
回答下列问题:
(1)反应③的
___________ 。
(2)下列叙述不能说明反应③达到平衡状态的是___________(填标号)。
(3)在不同温度、反应压强为 ,进料
,进料 的物质的量分数为
的物质的量分数为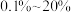 的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为
的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为___________ 。温度一定时,H2S的物质的量分数越大,H2S分解的平衡转化率越小,原因是___________ 。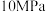 时,向恒压密闭容器中充入
时,向恒压密闭容器中充入 发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表
发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表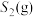 的是曲线
的是曲线___________ (填“I”“II”或“III”)。X点对应温度下,反应①的压强平衡常数
___________  。
。
(5)反应①的速率方程为 ,
,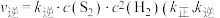 为速率常数)。
为速率常数)。
①某温度下,反应①的化学平衡常数K=10,k逆=3,则k正=___________ 。
②已知: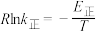 (式中,R为常数,
(式中,R为常数,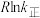 单位为
单位为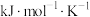 ,温度
,温度 单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度(
单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度( )关系如图3所示。相同条件下,催化效率较高的是
)关系如图3所示。相同条件下,催化效率较高的是___________ (填“Catl”或“Cat2”),判断依据是___________ 。在催化剂Cat2作用下,正反应的活化能为___________  。
。
 ,需要对
,需要对 回收处理并加以利用。
回收处理并加以利用。已知:①
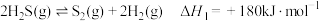
②

③
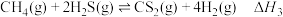
回答下列问题:
(1)反应③的

(2)下列叙述不能说明反应③达到平衡状态的是___________(填标号)。
A.断裂 键的同时断裂 键的同时断裂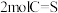 键 键 |
| B.恒容恒温条件下,反应体系的气体压强不再变化 |
| C.恒容条件下,反应体系的气体密度不再变化 |
D.反应速率: |
(3)在不同温度、反应压强为
 ,进料
,进料 的物质的量分数为
的物质的量分数为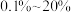 的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为
的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为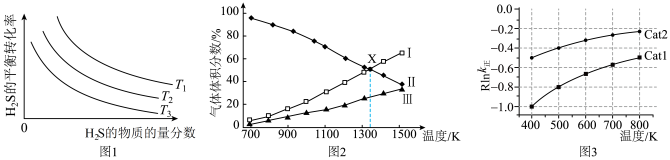
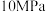 时,向恒压密闭容器中充入
时,向恒压密闭容器中充入 发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表
发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表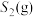 的是曲线
的是曲线
 。
。(5)反应①的速率方程为
 ,
,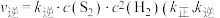 为速率常数)。
为速率常数)。①某温度下,反应①的化学平衡常数K=10,k逆=3,则k正=
②已知:
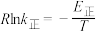 (式中,R为常数,
(式中,R为常数,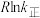 单位为
单位为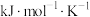 ,温度
,温度 单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度(
单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度( )关系如图3所示。相同条件下,催化效率较高的是
)关系如图3所示。相同条件下,催化效率较高的是 。
。
您最近半年使用:0次
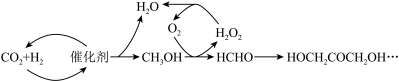
8 . 为尽快实现“碳达峰”“碳中和”,碳化学研究已成为当前科学研究的热点。由CO2合成淀粉的部分流程如图所示:
①
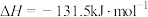
②
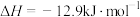
③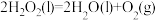
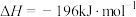
④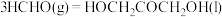
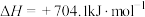
回答下列问题:
(1)反应①中,反应物的总能量_______ (填“大于”、“小于”或“等于”,下同)生成物的总能量,反应④中,反应物的总键能_______ 生成物的总键能。
(2)反应①中使用催化剂的作用有_______ (填标号);
a.有效降低了反应活化能 b.提高了的平衡转化率 c.加快了反应①的反应速率
(3)CO2合成淀粉过程中,当有1kgCO2转化为HOCH2COCH2OH时,理论上反应体系共需向外界_______ (填“吸收”或“放出”)的热量为______ kJ。(所有能量均充分利用,且不考㤐能量的损耗)
①

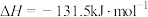
②

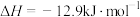
③
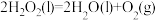
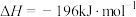
④
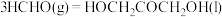
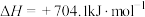
回答下列问题:
(1)反应①中,反应物的总能量
(2)反应①中使用催化剂的作用有
a.有效降低了反应活化能 b.提高了的平衡转化率 c.加快了反应①的反应速率
(3)CO2合成淀粉过程中,当有1kgCO2转化为HOCH2COCH2OH时,理论上反应体系共需向外界
您最近半年使用:0次
名校
解题方法
9 .  还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ.

Ⅱ.
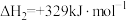
反应 的
的
___________  。
。
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ.


Ⅱ.

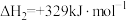
反应
 的
的
 。
。
您最近半年使用:0次
名校
10 . 中国科学家首次实现了二氧化碳到淀粉的从头合成,CO2的捕集、利用与封存成为科学家研究的重要课题。
以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
I.CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
II.C2H6(g) CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
(1)反应I的反应历程可分为如下两步:
i. C2H6(g) C2H4(g)+H2(g) ΔH1 (反应速率较快)
C2H4(g)+H2(g) ΔH1 (反应速率较快)
ii. H2(g)+CO2(g) H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
①∆H1=_______
②相比于提高c(C2H6),提高c(CO2)对反应I速率影响更大,原因是_______ 。
(2)向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂K-Fe-Mn/Si-2性能的影响如图所示,工业生产综合各方面的因素,反应选择800℃的原因是_______ 。 C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示: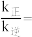
____ (用含有x的代数式表示);当温度升高时,k正增大m倍,k逆增大n倍,则m_____ n(填“>”、“<”或“=”)。
以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
I.CO2(g)+C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)
C2H4(g)+H2O(g)+CO(g) ΔH=+177kJ·mol-1 (主反应)II.C2H6(g)
 CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ΔH=+9kJ·mol-1 (副反应)(1)反应I的反应历程可分为如下两步:
i. C2H6(g)
 C2H4(g)+H2(g) ΔH1 (反应速率较快)
C2H4(g)+H2(g) ΔH1 (反应速率较快)ii. H2(g)+CO2(g)
 H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)
H2O(g)+CO(g) ΔH2=+44kJ·mol-1 (反应速率较慢)①∆H1=
②相比于提高c(C2H6),提高c(CO2)对反应I速率影响更大,原因是
(2)向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂K-Fe-Mn/Si-2性能的影响如图所示,工业生产综合各方面的因素,反应选择800℃的原因是
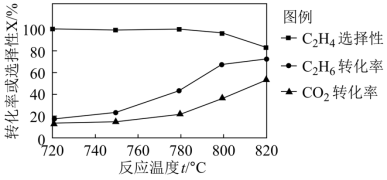
 C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
C2H4(g)+2H2(g) ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示: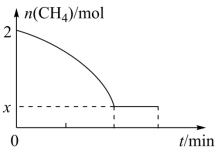
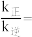
您最近半年使用:0次



