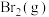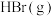1 . 天然气、石油钻探过程会释放出CO2、H2S等气体。某种将CO2和H2S共活化的工艺涉及反应如下:
①

②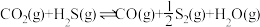

③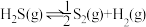
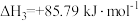
④
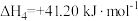
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:i.CO2和H2S的初始物质的量相等:
ii.产率=转化率×选择性:
iii.COS的选择性 ,H2O的选择性
,H2O的选择性 。
。
回答下列问题:
(1)COS分子的空间结构为__________ 形。
(2)
_________  。
。
(3)以下温度,COS的产率最高的是__________。
(4)温度高于500℃时,H2S的转化率大于CO2,原因是____________________ 。
(5)可提高S2平衡产率的方法为__________。
(6)700℃时反应①的平衡常数K=__________ (精确到0.01)。
(7)催化剂CeO2-MgO对反应②具有高选择性,通过理论计算得到反应的主要路径如下图所示。表示状态2的为__________ 。

A. B.
B. C.
C.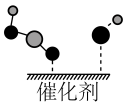
①


②
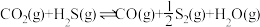

③
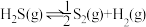
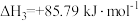
④

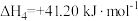
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:i.CO2和H2S的初始物质的量相等:
ii.产率=转化率×选择性:
iii.COS的选择性
 ,H2O的选择性
,H2O的选择性 。
。
回答下列问题:
(1)COS分子的空间结构为
(2)

 。
。(3)以下温度,COS的产率最高的是__________。
A. | B. | C. | D. |
(4)温度高于500℃时,H2S的转化率大于CO2,原因是
(5)可提高S2平衡产率的方法为__________。
| A.升高温度 | B.增大压强 | C.降低温度 | D.充入氩气 |
(6)700℃时反应①的平衡常数K=
(7)催化剂CeO2-MgO对反应②具有高选择性,通过理论计算得到反应的主要路径如下图所示。表示状态2的为

A.
 B.
B. C.
C.
您最近半年使用:0次
2 . 回答下列问题
(1)已知 时有关弱酸的电离平衡常数:
时有关弱酸的电离平衡常数:
①同温度下,等物质的量浓度的下列溶液, 值最小的是
值最小的是_______ (填序号)。
a. b.
b. c.
c.
② 时将
时将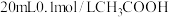 溶液和
溶液和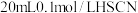 溶液分别与
溶液分别与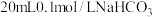 溶液混合。
溶液混合。
反应结束后所得两溶液中,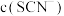
_______ 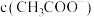 (填“>”、“<”“>”或“=”)
(填“>”、“<”“>”或“=”)
(2)煤燃烧的烟气也含氮氧化物,用 催化还原
催化还原 生成无毒的
生成无毒的 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
已知: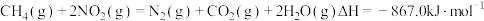
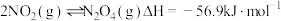

在常温下, 催化还原
催化还原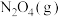 的热化学方程式
的热化学方程式______________ 。
(3)电池可以提升能量利用率。下图是利用甲烷燃料电池电解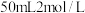 的氯化铜溶液的装置示意图,请回答下列问题:
的氯化铜溶液的装置示意图,请回答下列问题:

①甲烷燃料电池的负极反应式是______________ ;
②当A中消耗 氧气时,B中
氧气时,B中_______ 极(填a或b)增重_______ g。
(1)已知
 时有关弱酸的电离平衡常数:
时有关弱酸的电离平衡常数:| 弱酸化学式 |  |  |  |  |
| 电离平衡常数 | 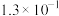 |  |  |   |
 值最小的是
值最小的是a.
 b.
b. c.
c.
②
 时将
时将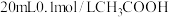 溶液和
溶液和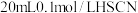 溶液分别与
溶液分别与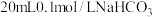 溶液混合。
溶液混合。反应结束后所得两溶液中,
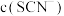
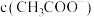 (填“>”、“<”“>”或“=”)
(填“>”、“<”“>”或“=”)(2)煤燃烧的烟气也含氮氧化物,用
 催化还原
催化还原 生成无毒的
生成无毒的 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。已知:
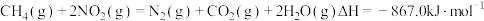
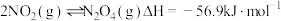

在常温下,
 催化还原
催化还原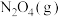 的热化学方程式
的热化学方程式(3)电池可以提升能量利用率。下图是利用甲烷燃料电池电解
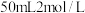 的氯化铜溶液的装置示意图,请回答下列问题:
的氯化铜溶液的装置示意图,请回答下列问题:
①甲烷燃料电池的负极反应式是
②当A中消耗
 氧气时,B中
氧气时,B中
您最近半年使用:0次
名校
解题方法
3 . 由CO2与H2制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由CO2人工合成淀粉(节选途径见图)中的重要反应之一,已知:
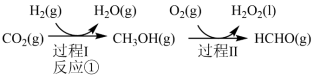
反应②:

反应③: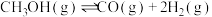
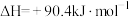
(1)反应①: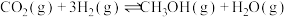 的
的
_______ 。
(2)反应①在有无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。

该反应历程中,催化剂使决速步骤的活化能降低_______ eV。
(3)“茚垂四烃”小组采用上述催化剂,向密闭容器中通入3molH2和1molCO2,只发生反应①和反应②,曲线a和b表示在不同条件下达到平衡:在T=300℃下甲醇的物质的量分数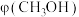 随压强p的变化,在p=600kPa下
随压强p的变化,在p=600kPa下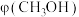 随温度T的变化,如图所示。
随温度T的变化,如图所示。

X点对应的温度和压强为_______ ℃、_______ kPa。M点时,容器中CO2为 ,CO为
,CO为 ,则H2的分压为
,则H2的分压为_______ kPa,反应①的压强平衡常数Kp=_______ kPa-2。图中M点的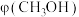 高于N点的原因是
高于N点的原因是_______ 。
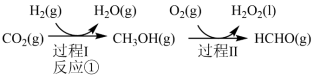
反应②:


反应③:
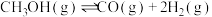
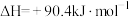
(1)反应①:
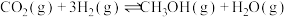 的
的
(2)反应①在有无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。

该反应历程中,催化剂使决速步骤的活化能降低
(3)“茚垂四烃”小组采用上述催化剂,向密闭容器中通入3molH2和1molCO2,只发生反应①和反应②,曲线a和b表示在不同条件下达到平衡:在T=300℃下甲醇的物质的量分数
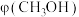 随压强p的变化,在p=600kPa下
随压强p的变化,在p=600kPa下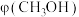 随温度T的变化,如图所示。
随温度T的变化,如图所示。
X点对应的温度和压强为
 ,CO为
,CO为 ,则H2的分压为
,则H2的分压为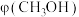 高于N点的原因是
高于N点的原因是
您最近半年使用:0次
名校
解题方法
4 . 二氧化碳加氢制甲烷过程中的主要反应为
反应1: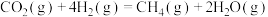
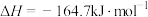
反应2:
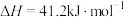
在密闭容器中, 、
、 时,
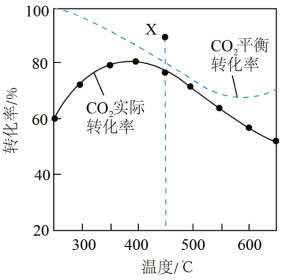
时, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率随温度的变化如题图所示。下列说法正确的是
实际转化率随温度的变化如题图所示。下列说法正确的是
反应1:
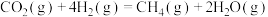
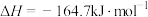
反应2:

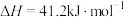
在密闭容器中,
 、
、 时,
时, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率随温度的变化如题图所示。下列说法正确的是
实际转化率随温度的变化如题图所示。下列说法正确的是
A.反应 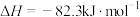 |
B.增大压强,能使 平衡转化率增大 平衡转化率增大 |
| C.用该催化剂催化二氧化碳反应的最佳温度范围约为480~530℃ |
D.450℃时,降低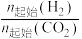 ,能使 ,能使 平衡转化率达到X点的值 平衡转化率达到X点的值 |
您最近半年使用:0次
名校
5 . 我国力争在2030年前实现碳达峰,2060年前实现碳中和。将二氧化碳资源化尤为重要。
(1)CO2可与H2制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
①则:Ⅲ.CO(g)+2H2(g) CH3OH(g)△H3=
CH3OH(g)△H3=___________ 。
②若将等物质的量的CO和H2充入恒温恒容密闭容器中进行上述反应Ⅲ,下列事实能说明此反应已达到平衡状态的是___________ 。
A.生成CH3OH的速率与生成H2的速率相等
B.CO和H2的物质的量之比为定值
C.混合气体的平均相对分子质量不变
D.容器内气体密度保持不变
E.CO的体积分数保持不变
③将CO2与H2充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ。CO2的转化率和CO、CH3OH的产率随反应温度的变化如图所示,由图判断合成CH3OH最适宜的温度是___________ ;高于该温度后,随着温度的升高CH3OH的产率发生变化的主要原因是___________ 。(答两点)

(2)CO2可与NH3制尿素:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)△H=—87kJ∙mol-1。研究发现,合成尿素的反应分两步进行。
CO(NH2)2(s)+H2O(g)△H=—87kJ∙mol-1。研究发现,合成尿素的反应分两步进行。
第1步:2NH3(g)+CO2(g) NH2COONH4(s)△H1=
NH2COONH4(s)△H1=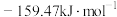
第2步:NH2COONH4(s) CO(NH2)2(s)+H2O(g)△H2=+72.47kJ∙mol-1
CO(NH2)2(s)+H2O(g)△H2=+72.47kJ∙mol-1
①一定条件下,向刚性容器中充入3molNH3和4molCO2,平衡时CO2的体积分数为60%,则平衡时NH3的转化率α(NH3)=___________ (保留一位小数),此条件下,第2步反应的Kp=akPa,则反应2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g)的平衡常数Kp=
CO(NH2)2(s)+H2O(g)的平衡常数Kp=___________ (kPa)-2。
②若要加快反应速率并提高NH3平衡转化率,可采取的措施有___________ (任写一条)。
(1)CO2可与H2制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)
①则:Ⅲ.CO(g)+2H2(g)
 CH3OH(g)△H3=
CH3OH(g)△H3=②若将等物质的量的CO和H2充入恒温恒容密闭容器中进行上述反应Ⅲ,下列事实能说明此反应已达到平衡状态的是
A.生成CH3OH的速率与生成H2的速率相等
B.CO和H2的物质的量之比为定值
C.混合气体的平均相对分子质量不变
D.容器内气体密度保持不变
E.CO的体积分数保持不变
③将CO2与H2充入装有催化剂的密闭容器中,发生反应Ⅰ和Ⅱ。CO2的转化率和CO、CH3OH的产率随反应温度的变化如图所示,由图判断合成CH3OH最适宜的温度是

(2)CO2可与NH3制尿素:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g)△H=—87kJ∙mol-1。研究发现,合成尿素的反应分两步进行。
CO(NH2)2(s)+H2O(g)△H=—87kJ∙mol-1。研究发现,合成尿素的反应分两步进行。第1步:2NH3(g)+CO2(g)
 NH2COONH4(s)△H1=
NH2COONH4(s)△H1=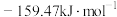
第2步:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g)△H2=+72.47kJ∙mol-1
CO(NH2)2(s)+H2O(g)△H2=+72.47kJ∙mol-1①一定条件下,向刚性容器中充入3molNH3和4molCO2,平衡时CO2的体积分数为60%,则平衡时NH3的转化率α(NH3)=
 CO(NH2)2(s)+H2O(g)的平衡常数Kp=
CO(NH2)2(s)+H2O(g)的平衡常数Kp=②若要加快反应速率并提高NH3平衡转化率,可采取的措施有
您最近半年使用:0次
名校
6 . 氮的氧化物是大气污染物之一,研究它们的反应机理,对于消除环境污染,促进社会可持续发展有重要意义。回答下列问题:
(1)已知:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.0kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1269.0kJ/mol
写出NH3与NO反应生成N2和H2O(g)的热化学方程式:_______ 。
(2)氢气选择性催化还原NO是一种比NH3还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如图:
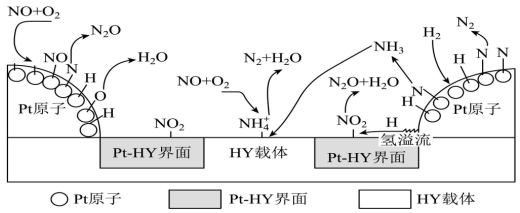
Pt原子表面上发生的反应除N+N=N2、2H+O=H2O外还有_______ 。
(3)在密闭容器中充入4molNO和5molH2,发生反应:2NO(g)+2H2(g) N2(g)+2H2O(g) △H<0,平衡时NO的体积分数随温度、压强的变化关系如图。
N2(g)+2H2O(g) △H<0,平衡时NO的体积分数随温度、压强的变化关系如图。
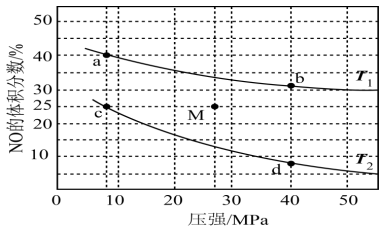
①下列物理量中,图中d点大于b点的是_______ (填字母)。
A.正反应速率 B.H2的转化率
C.N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为_______ 。
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点:_______ 。
(4)T℃时,向容积为2L的恒容容器中充入0.4molNO、0.8molH2发生反应:2NO(g)+2H2(g) N2(g)+2H2O(g),体系的总压强p随时间t的变化如下表所示:
N2(g)+2H2O(g),体系的总压强p随时间t的变化如下表所示:
①0~20min内该反应的平均反应速率v(NO)= _______ mol/(L·min)。
②该温度下反应的平衡常数Kp=_______ kPa-1(用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数)。
(1)已知:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.0kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1269.0kJ/mol
写出NH3与NO反应生成N2和H2O(g)的热化学方程式:
(2)氢气选择性催化还原NO是一种比NH3还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如图:

Pt原子表面上发生的反应除N+N=N2、2H+O=H2O外还有
(3)在密闭容器中充入4molNO和5molH2,发生反应:2NO(g)+2H2(g)
 N2(g)+2H2O(g) △H<0,平衡时NO的体积分数随温度、压强的变化关系如图。
N2(g)+2H2O(g) △H<0,平衡时NO的体积分数随温度、压强的变化关系如图。
①下列物理量中,图中d点大于b点的是
A.正反应速率 B.H2的转化率
C.N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点:
(4)T℃时,向容积为2L的恒容容器中充入0.4molNO、0.8molH2发生反应:2NO(g)+2H2(g)
 N2(g)+2H2O(g),体系的总压强p随时间t的变化如下表所示:
N2(g)+2H2O(g),体系的总压强p随时间t的变化如下表所示:| t/min | 0 | 10 | 20 | 30 | 40 |
| p/kPa | 240 | 226 | 216 | 210 | 210 |
②该温度下反应的平衡常数Kp=
您最近半年使用:0次
名校
解题方法
7 . 绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措,可以用以下方法制备氢气。
Ⅰ.甲烷和水蒸气催化制氢气。主要反应如下:
i.CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=+206.2kJ•mol-1
ii.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH=-41.2kJ•mol-1
(1)反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的 ΔH=___________ kJ•mol-1。
(2)在容积不变的绝热密闭容器中发生反应i,下列能说明反应达到平衡状态的是___________ (填标号)。
A.气体混合物的密度不再变化
B.CH4消耗速率和H2的生成速率相等
C.CO的浓度保持不变
D.气体平均相对分子质量不再变化
E.体系的温度不再发生变化
(3)恒定压强为P0MPa时,将n(CH4):n(H2O)=1:3的混合气体投入反应器中发生反应i和ii,平衡时,各组分的物质的量分数与温度的关系如图所示。
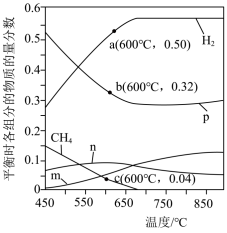
①图中表示CO2的物质的量分数与温度的变化曲线是___________ (填字母)。
②结合图中数据,其他条件不变,若要H2的产量最大,最适宜的反应温度是___________ (填标号)。
A.550~600℃ B.650~700℃ C.750~800℃
在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H2的含量,原因是________ 。
③600℃时,反应ii的平衡常数的计算式为Kp=___________ (Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。
Ⅱ.“氰化提金”产生的废水中含有一定量的 ,为处理含氰废水科研人员进行了大量研究。回答下列问题:
,为处理含氰废水科研人员进行了大量研究。回答下列问题:
(4)25℃,氢氰酸(HCN)、碳酸在水中的电离常数如下表:
①将少量 通入NaCN溶液中,反应的离子方程式是
通入NaCN溶液中,反应的离子方程式是___________ 。
②常温下,在 溶液中加入
溶液中加入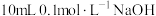 溶液。所得混合溶液中离子浓度由大到小的顺序是
溶液。所得混合溶液中离子浓度由大到小的顺序是___________ 。
Ⅰ.甲烷和水蒸气催化制氢气。主要反应如下:
i.CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=+206.2kJ•mol-1
ii.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH=-41.2kJ•mol-1
(1)反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的 ΔH=
(2)在容积不变的绝热密闭容器中发生反应i,下列能说明反应达到平衡状态的是
A.气体混合物的密度不再变化
B.CH4消耗速率和H2的生成速率相等
C.CO的浓度保持不变
D.气体平均相对分子质量不再变化
E.体系的温度不再发生变化
(3)恒定压强为P0MPa时,将n(CH4):n(H2O)=1:3的混合气体投入反应器中发生反应i和ii,平衡时,各组分的物质的量分数与温度的关系如图所示。

①图中表示CO2的物质的量分数与温度的变化曲线是
②结合图中数据,其他条件不变,若要H2的产量最大,最适宜的反应温度是
A.550~600℃ B.650~700℃ C.750~800℃
在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H2的含量,原因是
③600℃时,反应ii的平衡常数的计算式为Kp=
Ⅱ.“氰化提金”产生的废水中含有一定量的
 ,为处理含氰废水科研人员进行了大量研究。回答下列问题:
,为处理含氰废水科研人员进行了大量研究。回答下列问题:(4)25℃,氢氰酸(HCN)、碳酸在水中的电离常数如下表:
| 酸 | HCN |  |
 | 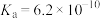 |   |
 通入NaCN溶液中,反应的离子方程式是
通入NaCN溶液中,反应的离子方程式是②常温下,在
 溶液中加入
溶液中加入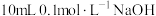 溶液。所得混合溶液中离子浓度由大到小的顺序是
溶液。所得混合溶液中离子浓度由大到小的顺序是
您最近半年使用:0次
名校
8 . A、B、C是三种常见短周期元素的单质,常温下D为无色液体,E是一种常见的温室气体,F是化合物.其转化关系如图(反应条件和部分产物略去)。试回答:

(1)E的结构式是______ 。
(2)单质X和B或D均能反应生成黑色晶体Y,Y的化学式是;______ ;
(3)E的大量排放会引起很多环境问题.有科学家提出,用E和 合成
合成 和
和 ,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是
,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是______ 。
已知
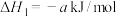
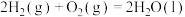
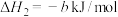
(4)已知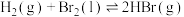
 ;蒸发1mol
;蒸发1mol 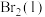 需要吸收的能量为30kJ,其它相关数据如下表。则表中a为
需要吸收的能量为30kJ,其它相关数据如下表。则表中a为______ 。
(5)以NaCl等为原料制备 的过程如下:
的过程如下:
①在无隔膜、微酸性条件下电解,发生反应: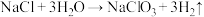 (未配平)。
(未配平)。
②在电解后溶液中加入KCl发生复分解反应,降温结晶,得
③一定条件下反应: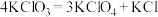 ,将产物分离得到
,将产物分离得到 。
。
该过程制得的 样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使
样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使 全部转化为
全部转化为 ,反应为:
,反应为: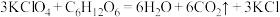 ,加入少量
,加入少量 溶液作指示剂,用
溶液作指示剂,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积V mL。滴定达到终点时,产生砖红色
溶液体积V mL。滴定达到终点时,产生砖红色 沉淀。计算
沉淀。计算 样品的纯度
样品的纯度______ (用含c、V的代数式表示)。

(1)E的结构式是
(2)单质X和B或D均能反应生成黑色晶体Y,Y的化学式是;
(3)E的大量排放会引起很多环境问题.有科学家提出,用E和
 合成
合成 和
和 ,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是
,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是已知

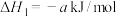
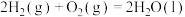
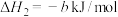
(4)已知
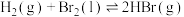
 ;蒸发1mol
;蒸发1mol 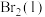 需要吸收的能量为30kJ,其它相关数据如下表。则表中a为
需要吸收的能量为30kJ,其它相关数据如下表。则表中a为物质 |
|
|
|
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
(5)以NaCl等为原料制备
 的过程如下:
的过程如下:①在无隔膜、微酸性条件下电解,发生反应:
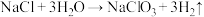 (未配平)。
(未配平)。②在电解后溶液中加入KCl发生复分解反应,降温结晶,得

③一定条件下反应:
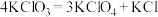 ,将产物分离得到
,将产物分离得到 。
。该过程制得的
 样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使
样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使 全部转化为
全部转化为 ,反应为:
,反应为: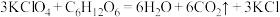 ,加入少量
,加入少量 溶液作指示剂,用
溶液作指示剂,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积V mL。滴定达到终点时,产生砖红色
溶液体积V mL。滴定达到终点时,产生砖红色 沉淀。计算
沉淀。计算 样品的纯度
样品的纯度
您最近半年使用:0次
2024-01-21更新
|
59次组卷
|
2卷引用:新疆乌鲁木齐市第九中学2023-2024学年高三上学期11月月考化学试题
名校
9 . 环氧乙烷(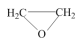 ,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。
,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。
(1)一定条件下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)的过程中部分物料与能量变化如图所示。
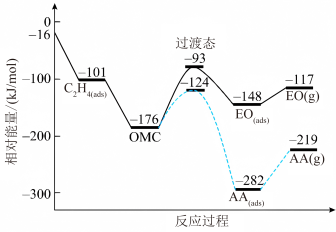
①中间体OMC生成吸附态EO(ads)的活化能为_______ kJ/mol。
②由EO(g)生成AA(g)的热化学方程式为_______ 。
(2)一定条件下,用Ag作催化剂,氧气直接氧化乙烯制环氧乙烷(部分机理未配平)。
主反应:2CH2=CH2(g)+O2(g)=2EO(g) ΔH=-213.8kJ/mol
副反应:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH=-1323kJ/mol
催化机理:O2+Ag(助剂)→ (ads)+Ag+
(ads)+Ag+
 (ads)+ CH2=CH2+Ag+→EO+ O(ads)+Ag
(ads)+ CH2=CH2+Ag+→EO+ O(ads)+Ag
O(ads)+ CH2=CH2→CO2+H2O
实际生产采用220-260℃的可能原因是________ 。
(3)乙烯电解制备EO的原理示意如图。
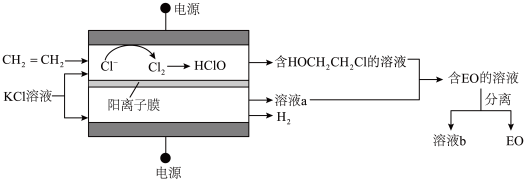
阳极室产生Cl2后发生的反应有:Cl2+H2O=HCl+HClO、CH2=CH2+HClO=HOCH2CH2Cl。
法拉第效率FE的定义:FE(B)= ×100%
×100%
①若FE(EO)=100%,则溶液b的溶质为________ (化学式)。
②一定条件下,反应物按一定流速通过该装置。当乙烯完全消耗时,测得FE(EO)≈70%,S(EO)≈97%。
推测FE(EO)≈70%的原因:若没有生成EO的乙烯全部在阳极放电生成CO2,则生成CO2的电极反应方程式为______ ,FE(CO2)≈____ %。经检验阳极放电产物没有CO2,则S(EO)≈97%的可能原因是______ 。
 ,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。
,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。(1)一定条件下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)的过程中部分物料与能量变化如图所示。

①中间体OMC生成吸附态EO(ads)的活化能为
②由EO(g)生成AA(g)的热化学方程式为
(2)一定条件下,用Ag作催化剂,氧气直接氧化乙烯制环氧乙烷(部分机理未配平)。
主反应:2CH2=CH2(g)+O2(g)=2EO(g) ΔH=-213.8kJ/mol
副反应:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH=-1323kJ/mol
催化机理:O2+Ag(助剂)→
 (ads)+Ag+
(ads)+Ag+ (ads)+ CH2=CH2+Ag+→EO+ O(ads)+Ag
(ads)+ CH2=CH2+Ag+→EO+ O(ads)+AgO(ads)+ CH2=CH2→CO2+H2O
实际生产采用220-260℃的可能原因是
(3)乙烯电解制备EO的原理示意如图。

阳极室产生Cl2后发生的反应有:Cl2+H2O=HCl+HClO、CH2=CH2+HClO=HOCH2CH2Cl。
法拉第效率FE的定义:FE(B)=
 ×100%
×100%①若FE(EO)=100%,则溶液b的溶质为
②一定条件下,反应物按一定流速通过该装置。当乙烯完全消耗时,测得FE(EO)≈70%,S(EO)≈97%。
推测FE(EO)≈70%的原因:若没有生成EO的乙烯全部在阳极放电生成CO2,则生成CO2的电极反应方程式为
您最近半年使用:0次
名校
10 . 工业上制硫酸的主要反应之一为: ,反应过程中能量的变化如下图所示。
,反应过程中能量的变化如下图所示。
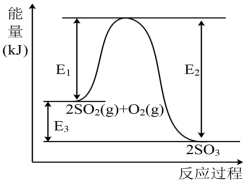
(1)向反应体系中加入催化剂后,图中
___________ (填“增大”、“减小”或“不变”,下同),
___________ 。
(2)已知:
 ;
;
 ;若
;若 与
与 反应产生
反应产生 和
和 ,则该反应的热化学方程式为
,则该反应的热化学方程式为___________ 。
(3)在接触室中,某温度下,反应的起始浓度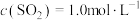 ,
,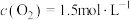 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为___________ 。
(4)在 温度时,该反应的平衡常数K=
温度时,该反应的平衡常数K=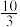 ,若在此温度下,向1L的恒容密闭容器中,充入0.03mol
,若在此温度下,向1L的恒容密闭容器中,充入0.03mol 、0.16mol
、0.16mol ,和0.03mol
,和0.03mol ,则反应开始时向
,则反应开始时向___________ (填“正反应方向”或“逆反应方向”)进行,正反应速率___________ (填“>”、“=”或“<”)逆反应速率。
(5)恒温恒容条件下,下列叙述能证明该反应已达化学平衡状态的是___________。(填字母)
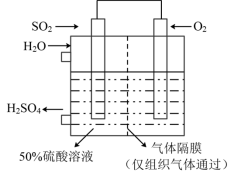
(6)若以如图所示装置生产硫酸,将 、
、 以一定压强喷到活性电极上反应。负极的电极反应式为
以一定压强喷到活性电极上反应。负极的电极反应式为___________ 。
 ,反应过程中能量的变化如下图所示。
,反应过程中能量的变化如下图所示。
(1)向反应体系中加入催化剂后,图中


(2)已知:

 ;
;
 ;若
;若 与
与 反应产生
反应产生 和
和 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(3)在接触室中,某温度下,反应的起始浓度
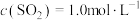 ,
,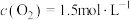 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为(4)在
 温度时,该反应的平衡常数K=
温度时,该反应的平衡常数K=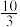 ,若在此温度下,向1L的恒容密闭容器中,充入0.03mol
,若在此温度下,向1L的恒容密闭容器中,充入0.03mol 、0.16mol
、0.16mol ,和0.03mol
,和0.03mol ,则反应开始时向
,则反应开始时向(5)恒温恒容条件下,下列叙述能证明该反应已达化学平衡状态的是___________。(填字母)
A. 的体积分数不再发生变化 的体积分数不再发生变化 |
| B.恒容时,容器内压强不再发生变化 |
| C.容器内,气体原子总数不再发生变化 |
D.相同时间内消耗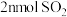 的同时生成 的同时生成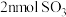 |
 、
、 以一定压强喷到活性电极上反应。负极的电极反应式为
以一定压强喷到活性电极上反应。负极的电极反应式为
您最近半年使用:0次