1 . 在一定条件下,在容积为2L的密闭容器中,将2molA气体和3molB气体相混合,发生如下反应:2A(g)+3B(g)⇌xC(g)+3D(g),4s后该反应达到平衡时,生成2.4molD,并测得C的反应速率为0.1mol·L-1·s-1,下列有关叙述错误的是
| A.x=1 | B.0~4s内,v(B)=0.3mol·L-1·s-1 |
| C.α(A):α(B)=1:1 | D.该反应的平衡常数为64 |
您最近一年使用:0次
名校
2 . 氨是最基本的化工原料之一,工业合成氨是人类科学技术的一项重大突破,目前己有三位科学家因其获得诺贝尔奖,其反应原理为:
回答下列问题:
(1)合成氨反应在常温下___________ (填“能”或“不能”)自发。
(2)___________ 温(填“高”或“低”,下同)有利于提高反应速率,___________ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用___________ ℃。增大压强,既有利于提高反应速率,又有利于提高平衡转化率。但是,压强越大,对材料的强度和设备的要求就越高,需要的动力也越大,这样会大大增加成本,并可能降低综合经济效益。目前,我国的合成氨厂,一般采用的压强为___________  。
。
(3)针对反应速率与平衡产率的矛盾,我国科学家在2016年合成了一种新型催化剂( 复合催化剂)较好的解决二者矛盾。
复合催化剂)较好的解决二者矛盾。

下列说法正确的是___________ 。
A. 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高
B.同温同压下,复合催化剂有利于提高氨的平衡产率
C.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为: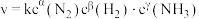 ,根据表中数据,
,根据表中数据,
___________ ;
在合成氨过程中,需要不断分离出氨的原因为___________ 。
A.提高正反应速率 B.防止催化剂中毒 C.有利于平衡正向移动

回答下列问题:
(1)合成氨反应在常温下
(2)
 。
。(3)针对反应速率与平衡产率的矛盾,我国科学家在2016年合成了一种新型催化剂(
 复合催化剂)较好的解决二者矛盾。
复合催化剂)较好的解决二者矛盾。
下列说法正确的是
A.
 时,复合催化剂比单一催化剂效率更高
时,复合催化剂比单一催化剂效率更高B.同温同压下,复合催化剂有利于提高氨的平衡产率
C.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为:
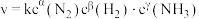 ,根据表中数据,
,根据表中数据,
| 实验 | 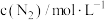 | 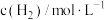 |  |  |
| 1 | m | n | p | q |
| 2 | 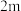 | n | p |  |
| 3 | m | n |  | 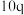 |
| 4 | m |  | p | 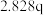 |
A.提高正反应速率 B.防止催化剂中毒 C.有利于平衡正向移动
您最近一年使用:0次
名校
3 . 环境问题作为全球性问题,利用反应 I2O5(s)+5CO(g) I2(s)+5CO2(g)可消除CO 污染。不同温度下,向装有足量I2O5的2L恒容密闭容器中通入2molCO,测得CO2的体积分数 φ(CO2)随时间 t 变化曲线如图所示。下列说法正确的是
I2(s)+5CO2(g)可消除CO 污染。不同温度下,向装有足量I2O5的2L恒容密闭容器中通入2molCO,测得CO2的体积分数 φ(CO2)随时间 t 变化曲线如图所示。下列说法正确的是
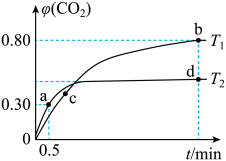
 I2(s)+5CO2(g)可消除CO 污染。不同温度下,向装有足量I2O5的2L恒容密闭容器中通入2molCO,测得CO2的体积分数 φ(CO2)随时间 t 变化曲线如图所示。下列说法正确的是
I2(s)+5CO2(g)可消除CO 污染。不同温度下,向装有足量I2O5的2L恒容密闭容器中通入2molCO,测得CO2的体积分数 φ(CO2)随时间 t 变化曲线如图所示。下列说法正确的是
| A.T1<T2 ,K1 <K2 |
| B.0~a 段,v(CO)=0.12 mol / (L·min) |
| C.c 点时,正反应速率大于逆反应速率 |
| D.增大压强可以缩短反应时间和提高CO的平衡转化率 |
您最近一年使用:0次
名校
解题方法
4 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。减轻汽车尾气(CO、NOx)对大气的污染,对这些排放气的处理以及再利用是化学工作者研究的重要课题。请思考回答下列问题:
Ⅰ.已知H2还原CO合成甲醇的热化学方程式为:
①CO(g)+2H2(g) CH3OH(g) △H1,K1;
CH3OH(g) △H1,K1;
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=–49kJ·mol-1,K2;
CH3OH(g)+H2O(g) △H2=–49kJ·mol-1,K2;
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=–41.1kJ·mol-1,K3;
CO2(g)+H2(g) △H3=–41.1kJ·mol-1,K3;
(1)则△H1=_______ ,K2=_______ (用K1、K3表示)。
Ⅱ. 是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)
是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中为速率常数。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中为速率常数。
(2)则Kp=_______ (用 表示)。
表示)。
Ⅲ.已知4CO(g)+2NO2(g) 4CO2(g)+N2(g) ∆H=﹣1200kJ•mol﹣1,在恒温恒容下发生上述反应。
4CO2(g)+N2(g) ∆H=﹣1200kJ•mol﹣1,在恒温恒容下发生上述反应。
(3)能说明该反应达到化学平衡状态的是_______ (填代号)。
a.v正(CO)=4v逆(N2)
b.CO2和N2的体积比保持不变
c.混合气体的平均相对分子质量保持不变
d.混合气体的密度保持不变
(4)某温度下,向1L恒容密闭容器中充入2molCO和1molNO2,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
①0~10min用CO2的浓度变化表示的反应速率为_______ 。
②此温度下,反应的平衡常数Kp=_______ kPa–1(Kp为以分压表示的平衡常数);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡_______ (填“右移”、“左移”或“不移动”)。
Ⅰ.已知H2还原CO合成甲醇的热化学方程式为:
①CO(g)+2H2(g)
 CH3OH(g) △H1,K1;
CH3OH(g) △H1,K1;②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=–49kJ·mol-1,K2;
CH3OH(g)+H2O(g) △H2=–49kJ·mol-1,K2;③CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=–41.1kJ·mol-1,K3;
CO2(g)+H2(g) △H3=–41.1kJ·mol-1,K3;(1)则△H1=
Ⅱ.
 是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)
是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中为速率常数。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中为速率常数。(2)则Kp=
 表示)。
表示)。Ⅲ.已知4CO(g)+2NO2(g)
 4CO2(g)+N2(g) ∆H=﹣1200kJ•mol﹣1,在恒温恒容下发生上述反应。
4CO2(g)+N2(g) ∆H=﹣1200kJ•mol﹣1,在恒温恒容下发生上述反应。(3)能说明该反应达到化学平衡状态的是
a.v正(CO)=4v逆(N2)
b.CO2和N2的体积比保持不变
c.混合气体的平均相对分子质量保持不变
d.混合气体的密度保持不变
(4)某温度下,向1L恒容密闭容器中充入2molCO和1molNO2,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 压强/kPa | 120 | 117.44 | 115.36 | 113.12 | 111.52 | 110 | 110 |
②此温度下,反应的平衡常数Kp=
您最近一年使用:0次
名校
5 . 某反应 的速率方程为
的速率方程为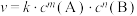 。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
 的速率方程为
的速率方程为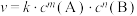 。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是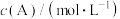 | 0.25 | 0.50 | 1.00 | 0.50 | 1.00 |  |
 | 0.050 | 0.050 | 0.100 | 0.100 | 0.200 |  |
 | 1.6 | 3.2 | 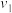 | 3.2 |  | 4.8 |
A.上述表格中的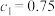 、 、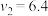 |
B.该反应的速率常数 |
| C.升温、加入催化剂均可使k增大,反应瞬时速率加快 |
| D.在过量的B存在时,当剩余6.25%的A时,所需的时间是375min |
您最近一年使用:0次
2024-01-24更新
|
469次组卷
|
3卷引用:重庆市第七中学校2023-2024学年高三下学期2月月考化学试题
重庆市第七中学校2023-2024学年高三下学期2月月考化学试题2024届浙江省瑞安中学高三上学期首考适应性考试 化学试题(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
6 . 可用CO2催化加氢合成CH3OH,主要反应的热化学方程式如下:
反应Ⅰ: ΔH1
ΔH1
反应Ⅱ: ΔH2=+41.0kJ/mol
ΔH2=+41.0kJ/mol
(1)已知几种化学键的键能如表所示,根据键能估算反应Ⅰ的ΔH1=___________ 。
(2)向某一密闭容器中充入1molCO2和3molH2发生反应Ⅰ,下列能说明反应Ⅰ在恒温恒压条件下达到平衡的是___________(填序号)。
(3)向恒压(3.0MPa)密闭装置中通入1molCO2和2molH2,在不同催化剂下测定甲醇的平均生成速率随温度的变化曲线,如图所示。
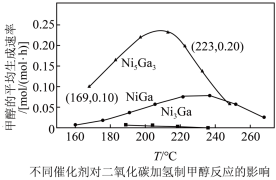
①最佳催化剂及最佳反应温度是___________ 。
②甲醇的平均生成速率呈先增大后减小的抛物线趋势,请解释后减小的原因:___________ 。
③二氧化碳加氢制甲醇的速率方程可表示为v=k·pm(CO2)·pn(H2),其中k为速率常数,各物质起始分压的指数为各物质的反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用Ni5Ga3催化剂时,反应温度由169℃升高到223℃,若CO2反应级数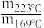 =2,H2反应级数不变,则速率常数之比
=2,H2反应级数不变,则速率常数之比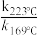 =
=___________ 。
(4)某温度时,向压强为5.0MPa的恒压装置中加入1molCO2(g)和3molH2(g)反应并达到平衡状态,CO2平衡转化率为40%,甲醇选择性为50%,则甲醇的平衡分压为___________ (结果保留2位有效数字)。已知:甲醇选择性x(CH3OH)%= 。
。
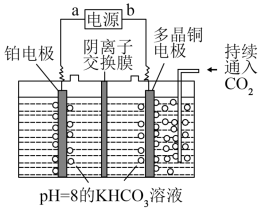
(5)如图所示的电解装置可实现低电位下高效催化CO2制取甲烷,温度控制在10℃左右,持续通入二氧化碳,电解过程中阴极区KHCO3物质的量基本不变。阴极反应为___________ 。
反应Ⅰ:
 ΔH1
ΔH1反应Ⅱ:
 ΔH2=+41.0kJ/mol
ΔH2=+41.0kJ/mol(1)已知几种化学键的键能如表所示,根据键能估算反应Ⅰ的ΔH1=
| 化学键 | H-H | C-O | C-H | H-O | C=O |
| E(kJ/mol) | 436 | 351 | 406 | 465 | 800 |
| A.容器内混合气体的密度不再改变 |
| B.容器内混合气体的压强不再改变 |
| C.反应物转化率的比值不再改变 |
| D.v正(CO2)=3v逆(H2O) |

①最佳催化剂及最佳反应温度是
②甲醇的平均生成速率呈先增大后减小的抛物线趋势,请解释后减小的原因:
③二氧化碳加氢制甲醇的速率方程可表示为v=k·pm(CO2)·pn(H2),其中k为速率常数,各物质起始分压的指数为各物质的反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用Ni5Ga3催化剂时,反应温度由169℃升高到223℃,若CO2反应级数
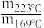 =2,H2反应级数不变,则速率常数之比
=2,H2反应级数不变,则速率常数之比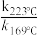 =
=(4)某温度时,向压强为5.0MPa的恒压装置中加入1molCO2(g)和3molH2(g)反应并达到平衡状态,CO2平衡转化率为40%,甲醇选择性为50%,则甲醇的平衡分压为
 。
。(5)如图所示的电解装置可实现低电位下高效催化CO2制取甲烷,温度控制在10℃左右,持续通入二氧化碳,电解过程中阴极区KHCO3物质的量基本不变。阴极反应为

您最近一年使用:0次
2024-01-23更新
|
300次组卷
|
3卷引用:重庆市巴蜀中学校2023-2024学年高三上学期11月期中化学试题
名校
解题方法
7 . 研究发现燃煤脱硫过程中生成的 CaSO₄(s) 与 CO(g) 在密闭体系中将发生如下反应:
Ⅰ.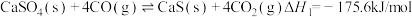
Ⅱ.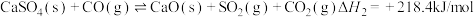
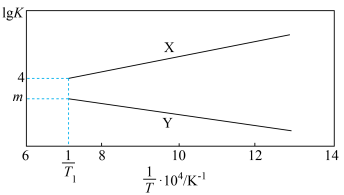
已知图为反应Ⅰ和反应Ⅱ的平衡常数(K) 与温度(T) 的变化关系。现维持温度为 T1,往某2L刚性密闭反应器中投入足量的CaSO4(s) 和1mol CO(g),经t小时反应体系达到平衡,此时体系压强为原来的1.4倍。下列说法正确的是
Ⅰ.
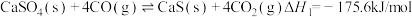
Ⅱ.
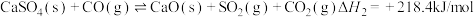
已知图为反应Ⅰ和反应Ⅱ的平衡常数(K) 与温度(T) 的变化关系。现维持温度为 T1,往某2L刚性密闭反应器中投入足量的CaSO4(s) 和1mol CO(g),经t小时反应体系达到平衡,此时体系压强为原来的1.4倍。下列说法正确的是

A.若用生石灰固硫的反应为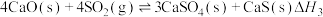 ,则 ,则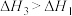 |
B.提高反应体系的温度能降低反应体系中 的生成量 的生成量 |
C.反应体系中 CO 的消耗速率为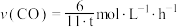 |
| D.m≈0.3 |
您最近一年使用:0次
名校
解题方法
8 . 水在超临界状态下呈现许多特殊的性质。一定实验条件下,测得乙醇的超临界水氧化结果如图甲、乙所示,其中x为以碳元素计的物质的量分数,t为反应时间。下列说法错误 的是
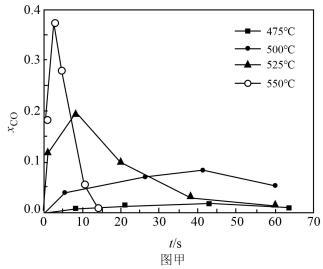



A.乙醇的超临界水氧化过程中,CO是中间产物, 是最终产物 是最终产物 |
| B.乙醇的超临界水氧化过程中经历两步反应,第一步速率较快,第二步较慢 |
C.随温度升高,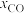 峰值出现的时间提前且峰值更高,说明乙醇的氧化速率比CO氧化速率的增长幅度更大 峰值出现的时间提前且峰值更高,说明乙醇的氧化速率比CO氧化速率的增长幅度更大 |
D.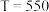 ℃条件下,3s~8s区间乙醇的超临界水氧化过程中, ℃条件下,3s~8s区间乙醇的超临界水氧化过程中,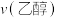 、 、 、 、 的数值关系为 的数值关系为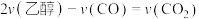 |
您最近一年使用:0次
2024-01-15更新
|
261次组卷
|
3卷引用:重庆市第八中学校2023-2024学年高三上学期一诊适应性考试化学试卷
名校
9 . CuBr2的分解反应为2CuBr2(s)=2CuBr(s)+Br2(g) ΔH=+105.4kJ/mol。起始状态Ⅰ中有CuBr2、CuBr和 Br2,经下列过程达到各平衡状态:

已知状态Ⅰ 和Ⅲ的固体质量相等,上述过程中Br2始终为气态。下列叙述正确的是

已知状态Ⅰ 和Ⅲ的固体质量相等,上述过程中Br2始终为气态。下列叙述正确的是
| A.从Ⅰ到Ⅱ的过程 ΔS<0 |
| B.平衡常数:K(Ⅱ)>K(Ⅳ) |
C.若体积V(Ⅰ)=2V(Ⅲ),则Q(Ⅰ)= K(Ⅲ) K(Ⅲ) |
| D.逆反应的速率:v(Ⅰ)>v(Ⅱ)=v(Ⅲ)>v(Ⅳ) |
您最近一年使用:0次
名校
解题方法
10 . 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) ΔH<0。
CH3OH(g) ΔH<0。
(1)已知,该反应ΔS_____ 0(填“<”“>”或“=”)。
(2)在300℃,5 MPa条件下,将0.20 mol的CO与0.58 mol H2的混合气体充入2L密闭容器中发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
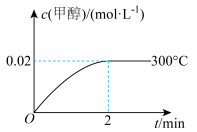
①在0~2min内,以H2表示的平均反应速率为_______ mol·L-1·min-1。
②300℃时该反应的平衡常数K=_______ 。
 CH3OH(g) ΔH<0。
CH3OH(g) ΔH<0。(1)已知,该反应ΔS
(2)在300℃,5 MPa条件下,将0.20 mol的CO与0.58 mol H2的混合气体充入2L密闭容器中发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。

①在0~2min内,以H2表示的平均反应速率为
②300℃时该反应的平衡常数K=
您最近一年使用:0次



