名校
1 . 已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定正确的是
| A.简单离子半径:W > X |
| B.含氧酸的酸性:W > Z |
| C.气态氢化物的稳定性:W < Y |
| D.若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
您最近一年使用:0次
2017-03-27更新
|
889次组卷
|
3卷引用:2017届山东省济南市高三第一次模拟考试理科综合化学试卷
名校
2 . 下表是元素周期表的一部分,回答下列有关问题:
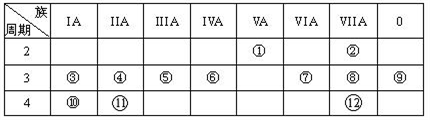
(1)在这些元素中,最活泼的金属元素和最活泼的非金属元素分别是____ 、______ 。(用元素符号作答)
(2)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的化学方程式______ 。
(3)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该化 学方程式
学方程式________ 。
(4)如何验证元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方 程式
程式__________ 。

(1)在这些元素中,最活泼的金属元素和最活泼的非金属元素分别是
(2)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的化学方程式
(3)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该化
 学方程式
学方程式(4)如何验证元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方
 程式
程式
您最近一年使用:0次
2017-03-22更新
|
393次组卷
|
2卷引用:2016-2017学年山东省枣庄市第八中学北校区高一下学期第一次月考化学试卷
解题方法
3 . 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
回答下列问题:
(1)元素x在周期表中的位置是____ ,其单质可采用电解熔融________ 的方法制备。
(2)气体分子(mn)2的电子式为____ ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为____ 。
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:____ ,负极:_____ 。
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式____ 。
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是
(2)气体分子(mn)2的电子式为
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式
您最近一年使用:0次
解题方法
4 . 下表列出了A﹣R 9种元素在周期表中的位置
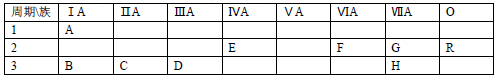
(1)这 9种元素中化学性质最不活泼的是________ (以上均填元素符号)
(2)B、C、D三种元素按原子半径由大到小的顺序排列为________ (用元素符号表示)
(3)F元素简单氢化物的化学式是________ ,H元素跟B元素形成化合物的化学式是______ ,高温灼烧该化合物时,火焰呈________ 色.
(4)G元素和 H元素两者核电荷数之差是________ .

(1)这 9种元素中化学性质最不活泼的是
(2)B、C、D三种元素按原子半径由大到小的顺序排列为
(3)F元素简单氢化物的化学式是
(4)G元素和 H元素两者核电荷数之差是
您最近一年使用:0次
名校
解题方法
5 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。请用相关的化学术语回答下列问题:
(1) 在这些元素中,最不活泼的是 ,非金属性最强的是___________,金属性最强的是___________;(填元素符号或化学式,下同。)
(2) 这些元素形成的最高价氧化物对应的水化物中碱性最强的 ,酸性最强的__________;
(3) ①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为 ;
(4) ⑥的氢化物的电子式为 ,① 在空气中燃烧后生成产物的电子式 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA[ | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
(2) 这些元素形成的最高价氧化物对应的水化物中碱性最强的 ,酸性最强的__________;
(3) ①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为 ;
(4) ⑥的氢化物的电子式为 ,① 在空气中燃烧后生成产物的电子式 。
您最近一年使用:0次
解题方法
6 . R元素的单质4.5g,跟足量的硫酸反应生成R2(SO4)3,并放出5.6L的H2(标准状况下).试求:
(1)R的相对原子质量为_____
(2)若R原子中质子数比中子数少1,则R是(填元素符号)_____ ,它在元素周期表的位置为第_____ 周期第_____ 族.
(1)R的相对原子质量为
(2)若R原子中质子数比中子数少1,则R是(填元素符号)
您最近一年使用:0次
解题方法
7 . 表中所列字母分别代表一种元素。
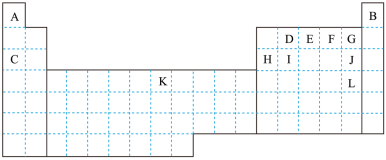
(1)G的气态氢化物比J的气态氢化物_______ (填“稳定”或“不稳定”)。
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为_______ ;该物质溶于水后的溶液呈_______ 性(填“酸”、“碱”或“中”)。
(3)元素C和H的最高价氧化物对应的水化物相互反应的离子方程式为:_______ 。
(4)元素G和L的原子序数相差:_______ ,它们的氢化物的水溶液酸性相对强的是:_______ (填化学式)
(5)表中A和F两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为:_______
(6)K为生产、生活中应用最广泛的金属,通常采用的冶炼方法为:_______

(1)G的气态氢化物比J的气态氢化物
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
(3)元素C和H的最高价氧化物对应的水化物相互反应的离子方程式为:
(4)元素G和L的原子序数相差:
(5)表中A和F两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为:_______
| A.MnO2 | B.Na2SO4 | C.FeCl3 | D.KMnO4 |
| A.电解法 | B.热分解法 | C.热还原法 |
您最近一年使用:0次
8 . 下表列出了7种短周期元素在元素周期表中的相对位置,其中元素①的最低负化合价的绝对值与其原子最外层电子数相等,元素⑤是地壳中含量最多的金属元素。
请用相应的化学用语回答下列问题:
(1)元素①在元素周期表中所处的位置是_______ 。
(2)上述7中元素中,非金属性最强的是______ (填元素符号);最高价氧化物对应水化物中,碱性最强的物质的化学式是_______ 。
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是________ 。
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是_______________ 。
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是_______ 。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是_______ 。
| ① | ② | ③ | |||
| ④ | ⑤ | ⑥ | ⑦ |
请用相应的化学用语回答下列问题:
(1)元素①在元素周期表中所处的位置是
(2)上述7中元素中,非金属性最强的是
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是
您最近一年使用:0次
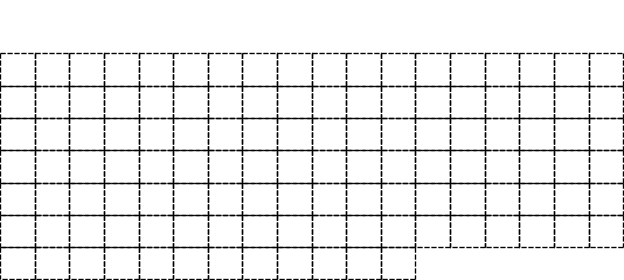
9 . 在如图所示元素周期表中请用实线(黑色中性笔)画出主族元素的边界和金属元素与非金属元素的分界线.

您最近一年使用:0次
解题方法
10 . 下表为周期表的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)表中属于d区的元素是_____________ (填编号)。
(2)写出元素⑨的基态原子的电子排布式_____________ ;
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为_____________ 对,其单质的电子式为_____________ ;
(4)元素④的氢化物的分子构型为_____________ ,中心原子的杂化方式为_____________ ;
(5)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表_____________ (填元素符号);其中电负性最大的是_____________ (填图中的序号)。
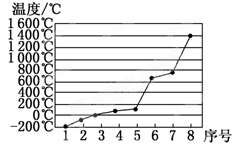

请回答下列问题:
(1)表中属于d区的元素是
(2)写出元素⑨的基态原子的电子排布式
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为
(4)元素④的氢化物的分子构型为
(5)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表

您最近一年使用:0次



