解题方法
1 . 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
回答下列问题:
(1)D的元素名称是_______ ,H的元素符号是_______ ,B在元素周期表中的位置是(周期、族)_______ 。
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是_______ .化合物F2A2的电子式是:_______ ,构成该物质的化学键类型为_______ 。
(3)用电子式表示A的简单氢化物的形成过程如下:_______ ;G的氢化物的结构式为_______ 。
(4)一定条件下,IA2气体与足量的A单质充分反应生成20 g气态化合物,放出24.6 kJ热量,写出其热化学方程式_______ 。
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:_______ 。
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10﹣10m) | 0.74 | 1.60 | 1.52 | 1.10[ | 0.99 | 1.86 | 0.75 | 0.82 | 0.102 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5[ | +7 | +1 | +5 | +3 | +6 | +1 | |
| ﹣2 | ﹣3 | ﹣1 | ﹣3 | ﹣2 |
(1)D的元素名称是
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是
(3)用电子式表示A的简单氢化物的形成过程如下:
(4)一定条件下,IA2气体与足量的A单质充分反应生成20 g气态化合物,放出24.6 kJ热量,写出其热化学方程式
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:
您最近一年使用:0次
解题方法
2 . 五种短周期元素A、B、C、D、E的原子序数依次增大,其中只有C为金属元素。A和C同主族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是__________ ,非金属性最强的是__________ (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是__________ (用化学式表示);
(3)D在周期表的位置为__________
(4)A和B形成的化合物与A和E形成的化合物反应,产物的化学式为__________ ,该化合物溶于水,显__________ 性(填“酸”、“碱”、“中”)原因是__________ (用离子方程式表示);
(5)D和E可形成一种所有原子都满足8电子结构的化合物,其化学式为__________ 。
(1)五种元素中,原子半径最大的是
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是
(3)D在周期表的位置为
(4)A和B形成的化合物与A和E形成的化合物反应,产物的化学式为
(5)D和E可形成一种所有原子都满足8电子结构的化合物,其化学式为
您最近一年使用:0次
解题方法
3 . 如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
(1)周期表中元素最高正价与最低价代数和为零的是______________ 族(用族序号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为_______________ (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式______________________ ;
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式__________________ 。
(5)已知W+X=Y+Z(反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种十电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式_______________________ 。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
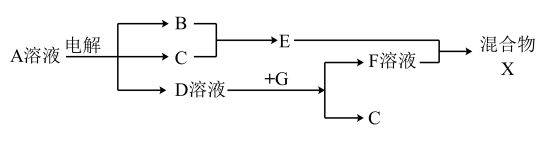
①写出D溶液与G反应的化学方程式_______________________ 。
②写出检验A溶液中溶质的阴离子的方法___________________________ 。
(1)周期表中元素最高正价与最低价代数和为零的是
(2)⑥和⑦的最高价含氧酸的酸性强弱为
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑧ | ⑨ | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(5)已知W+X=Y+Z(反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种十电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的化学方程式
②写出检验A溶液中溶质的阴离子的方法
您最近一年使用:0次
解题方法
4 . 已知两种相邻周期、相邻主族的短周期非金属元素X、Y,其最高价氧化物对应的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
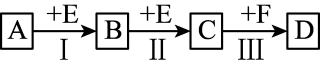
(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于________ (填“离子化合物”或“共价化合物”)。
②反应Ⅰ的化学方程式为______________________________ 。
③将1.92 g铜粉与一定量的D的浓溶液反应,当铜完全反应时收集到气体1.12 L(标准状况),则反应耗的D的物质的量为________ mol。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34 g·mol-1,则:①将铜粉与D的浓溶液反应所得溶液加热蒸干,得的白色固体物质为________ (填化学式)。
②将少量Na2Y溶液滴加到次氯酸钠溶液中发生应,无沉淀生成,请写出该反应的离子方程式__________________ 。在该反中若有74.5 g NaClO被还原,则转移电子的物质量为________ mol。
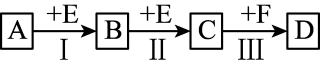
(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于
②反应Ⅰ的化学方程式为
③将1.92 g铜粉与一定量的D的浓溶液反应,当铜完全反应时收集到气体1.12 L(标准状况),则反应耗的D的物质的量为
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34 g·mol-1,则:①将铜粉与D的浓溶液反应所得溶液加热蒸干,得的白色固体物质为
②将少量Na2Y溶液滴加到次氯酸钠溶液中发生应,无沉淀生成,请写出该反应的离子方程式
您最近一年使用:0次
5 . X、Y是短周期元素,且X的原子序数比Y大4。请填空:
I.若X是金属元素,Y是非金属元素,化合物XY是优质的耐高温材料。
(1)元素Y在元素周期表的位置为 。
(2)粉末状X是制造烟花的重要原料之一,生产粉末状X时,将X蒸气在某种气体中冷却。下列可作为冷却气体的是 。
II.若X是短周期最活泼的金属元素。
(3)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为 。该电池中OH-移向 极。
(4)25℃时,往a mol·L-1 YH3的水溶液(甲)中滴加0.01 mol·L-1H2SO4溶液(乙),滴加过程中溶液的导电能力 (填“增强”、“减弱”或“不变”),当甲与乙等体积混合后,溶液呈中性(设温度不变),甲中溶质的电离常数Kb= (填表达式,用含a的代数式表示)。
I.若X是金属元素,Y是非金属元素,化合物XY是优质的耐高温材料。
(1)元素Y在元素周期表的位置为 。
(2)粉末状X是制造烟花的重要原料之一,生产粉末状X时,将X蒸气在某种气体中冷却。下列可作为冷却气体的是 。
| A.空气 | B.氮气 | C.氩气 | D.二氧化碳 |
II.若X是短周期最活泼的金属元素。
(3)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为 。该电池中OH-移向 极。
(4)25℃时,往a mol·L-1 YH3的水溶液(甲)中滴加0.01 mol·L-1H2SO4溶液(乙),滴加过程中溶液的导电能力 (填“增强”、“减弱”或“不变”),当甲与乙等体积混合后,溶液呈中性(设温度不变),甲中溶质的电离常数Kb= (填表达式,用含a的代数式表示)。
您最近一年使用:0次
解题方法
6 . A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与 E同周期;E元素原子的最外层电子数是其次外层电子数的 3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)E元素在元素周期表中的位置是_______________ 。
(2)由A、B、C三种元素形成的离子化合物的化学式为_________________ 。
(3)A可分别与C、E形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式)_______________ 。
(4)F含有的化学键类型是___________ 和_____________ ,其水溶液呈酸性,请用相关的离子方程式解释其原因___________ 。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为______ 。
(1)E元素在元素周期表中的位置是
(2)由A、B、C三种元素形成的离子化合物的化学式为
(3)A可分别与C、E形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式)
(4)F含有的化学键类型是
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为
您最近一年使用:0次
解题方法
7 . 已知A、B、C、D四种元素分别为短周期元素,表示中三个不同短周期的主族元素,且原子序数依次增
大。D原子的质子数是B原子质子数的2倍,A原子与D原子的最外层电子数之和是B原子与C原子质子
数之和的1/3。A与B可形成BA3型化合物,该化合物与C的单质在一定条件下反应,能生成化合物BC,请按要求填写下列空白:
(1)D元素的名称____________ ,C元素在元素周期表中的位置_____________ 。
(2)写出BA3的电子式____________ ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式________________________________ 。
(3)D单质在工业上最重要的用途是_________ ,写出工业上制取D单质的化学方程式__________ 。
(4)在实验室中B的最高价氧化物的水化物的浓溶液应如何保存__________________ ,用化学方程
式说明理由____________________________________ 。
大。D原子的质子数是B原子质子数的2倍,A原子与D原子的最外层电子数之和是B原子与C原子质子
数之和的1/3。A与B可形成BA3型化合物,该化合物与C的单质在一定条件下反应,能生成化合物BC,请按要求填写下列空白:
(1)D元素的名称
(2)写出BA3的电子式
(3)D单质在工业上最重要的用途是
(4)在实验室中B的最高价氧化物的水化物的浓溶液应如何保存
式说明理由
您最近一年使用:0次
名校
8 . 下列叙述不正确的是
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥已知2H2(g)+O2(g)=2H2O(l) △H=﹣571kJ·mol﹣1,则氢气的燃烧热为285.5kJ·mol﹣1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥已知2H2(g)+O2(g)=2H2O(l) △H=﹣571kJ·mol﹣1,则氢气的燃烧热为285.5kJ·mol﹣1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A.②④⑥ | B.①③⑤⑦ | C.②④⑥⑦ | D.⑤⑥⑦ |
您最近一年使用:0次
2016-12-09更新
|
2036次组卷
|
6卷引用:2016届湖南省衡阳县第四中学高三9月月考试化学试卷
解题方法
9 . 短周期元素X、Y、Z、W在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是
| X | Y | ||
| Z | W |
| A.钠与Y只能形成Na2Y |
| B.Z形成的单质易溶于由X与Z形成的化合物 |
| C.Z得电子能力比W强 |
| D.X有多种同素异形体,而Y不存在同素异形体 |
您最近一年使用:0次
10-11高一·山西忻州·阶段练习
解题方法
10 . 已知X、Y、Z、W为四种短周期元素,其原子序数依次增大,且由这些元素所组成的单质在常温下均呈气态。X、Y、W处于不同周期,且在一定条件下其单质能发生反应:X2+Y2→甲,X2+W2→乙,甲、乙可化合生成离子化合物丙。试回答下列问题:
(1)W元素在周期表中的位置是_________ ;甲的空间构型为___________ 。
(2)丙的水溶液呈酸性,用离子方程式表示其原因____________________________ 。
(3)X、Z可组成四原子化合物丁,丁是一种二元弱酸,写出丁在水中的电离方程式_________________ ;X、Y组成的液态化合物Y2X416克与足量丁反应生成Y2和液态水,放出Q kJ的热量,请写出该反应的热化学方程式___________
Y2X4还可以和Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为____________________ 。
(1)W元素在周期表中的位置是
(2)丙的水溶液呈酸性,用离子方程式表示其原因
(3)X、Z可组成四原子化合物丁,丁是一种二元弱酸,写出丁在水中的电离方程式
Y2X4还可以和Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为
您最近一年使用:0次



