名校
解题方法
1 . 下列方案设计、现象和结论正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 探究H2SO3和 的酸性强弱 的酸性强弱 | 将SO2气体通入Ca(ClO)2溶液中 | 若产生白色沉淀,则说明酸性:H2SO3>HClO |
| B | 验证某红棕色气体是否为 NO2 | 将气体通入淀粉碘化钾溶液 | 若溶液变蓝,则说明气体为NO2 |
| C | 探究碘在纯水和CCl4中溶解性 | 向碘的四氯化碳溶液中加入 1mL 浓KI 溶液,振荡试管。 | 若碘的四氯化碳溶液紫色变浅,说明碘在纯水中的溶解性更好 |
| D | 检验海带中是否含有碘元素 | 将海带灰溶解过滤后,取适量滤液于试管中,酸化后加入少量双氧水,充分反应后加入1~2 滴淀粉溶液 | 溶液变蓝,则证明海带中含有碘元素 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
2 . 海洋是一座巨大的化学资源宝库,从海水中或海产品中提取多种化学物质。
I.试剂级 可用海盐(含泥沙、海藻、
可用海盐(含泥沙、海藻、 等杂质)为原料制备。制备流程如下:
等杂质)为原料制备。制备流程如下:
(1)
焙炒海盐的目的是___________ 。
(2)根据除杂原理、预期沉淀的离子,填写合适的试剂。
其中步骤2和步骤3是否可以颠倒,请给出解释:___________ 。
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是___________。

Ⅱ.实验室模拟工业从海藻中提碘的流程如图:
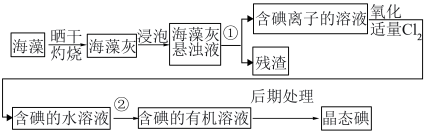
(4)选择合适实验操作名称填入流程图中:①___________ ,②___________ 。(可多选)
A.溶解 B.过滤 C.萃取 D.分液
(5)从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如下图装置完成。装置中间部分是“冷凝管”,请描述该装置中有明显的错误,请写出任一种错误___________ 。
(6)
装置 中,温度计所处的正确位置是
中,温度计所处的正确位置是___________ 。(选填编号)

Ⅲ.某化学研究性学习小组模拟工业上从浓缩的海水(海水中富含 )中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:
)中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知: 的沸点为
的沸点为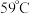 ,微溶于水,有毒。
,微溶于水,有毒。
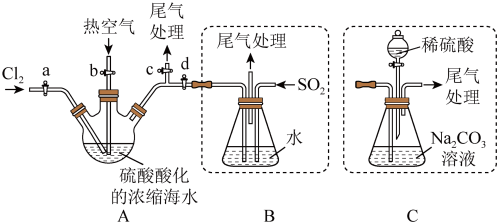
①连接 与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入
与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入 至反应完全:
至反应完全:
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气:
③进行步骤②的同时,向B中通入足量 ;
;
④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量 ;
;
⑤将B中所得液体进行萃取分液,蒸馏并收集液溴
请回答下列问题:
(7)步骤②中鼓入热空气的作用为___________ 。
(8)进行步骤③时,B中尾气可用___________吸收处理。
(9)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中流加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,c中反应生成了NaBrO3、 、
、 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
(10)与B装置相比,采用C装置的优点为___________ 。
I.试剂级
 可用海盐(含泥沙、海藻、
可用海盐(含泥沙、海藻、 等杂质)为原料制备。制备流程如下:
等杂质)为原料制备。制备流程如下:(1)

焙炒海盐的目的是
(2)根据除杂原理、预期沉淀的离子,填写合适的试剂。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | 略过量 |  、 、 |
| 步骤2 | 略过量 |  |
| 步骤3 | 略过量 |  |
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是___________。

| A.铂片上发生还原反应 |
| B.铂片端作阴极 |
| C.铅笔端有少量的氯气产生 |
| D.a连接的是电源负极 |
Ⅱ.实验室模拟工业从海藻中提碘的流程如图:

(4)选择合适实验操作名称填入流程图中:①
A.溶解 B.过滤 C.萃取 D.分液
(5)从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如下图装置完成。装置中间部分是“冷凝管”,请描述该装置中有明显的错误,请写出任一种错误
(6)

装置
 中,温度计所处的正确位置是
中,温度计所处的正确位置是
Ⅲ.某化学研究性学习小组模拟工业上从浓缩的海水(海水中富含
 )中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:
)中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知: 的沸点为
的沸点为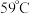 ,微溶于水,有毒。
,微溶于水,有毒。
①连接
 与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入
与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入 至反应完全:
至反应完全:②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气:
③进行步骤②的同时,向B中通入足量
 ;
;④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量
 ;
;⑤将B中所得液体进行萃取分液,蒸馏并收集液溴
请回答下列问题:
(7)步骤②中鼓入热空气的作用为
(8)进行步骤③时,B中尾气可用___________吸收处理。
| A.水 | B.浓硫酸 | C. 溶液 溶液 | D.饱和 溶液 溶液 |
(9)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中流加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,c中反应生成了NaBrO3、
 、
、 ,则该反应的化学方程式为
,则该反应的化学方程式为(10)与B装置相比,采用C装置的优点为
您最近半年使用:0次
解题方法
3 . 从海带中提取碘单质的工艺流程如下。下列关于海带制碘的说法,不 正确的是


| A.实验室在蒸发皿中灼烧干海带,并用玻璃棒搅拌 |
| B.海带灰用沸水浸泡的目的是提高碘元素的浸出率 |
C.含 的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应 的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应 |
D.碘水加入 得到 得到 的 的 溶液,该操作为“萃取” 溶液,该操作为“萃取” |
您最近半年使用:0次
解题方法
4 . 我国拥有很长的海岸线,具有丰富的海洋资源。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。
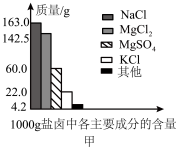
(1)根据图甲所示,写出盐卤中含量最多的盐为___________ (填化学式)其电子式为___________
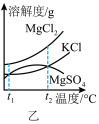
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到 ℃以上,根据溶解度曲线,首先析出的晶体应是
℃以上,根据溶解度曲线,首先析出的晶体应是___________ 。(填化学式)
(3)如图是常用于混合物的分离和提纯的装置:
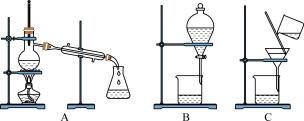
粗盐的提纯应选择图___________ (填字母,下同)装置,若实验中为了除去粗盐中的 、
、 、
、 等杂质离子加入试剂的顺序可以是
等杂质离子加入试剂的顺序可以是___________ 。
A.NaOH、Na2CO3、BaCl2、HCl B.NaOH、BaCl2、Na2CO3、HCl
C.Na2CO3、BaCl2、NaOH、HCl D.BaCl2、NaOH、Na2CO3、HCl
Ⅱ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。
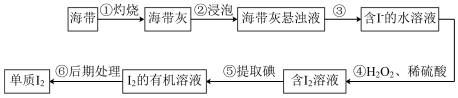
(4)实验步骤①会用到下列仪器中的___________ (填字母)
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中K+的存在,___________ 。
(6)“提取碘”存在以下两种方案。
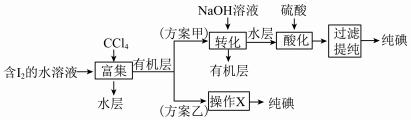
①方案乙中“操作X”的名称是___________ 。
②该流程可循环利用的物质是___________ 。
③采用方案乙得到纯碘的产率较低,原因是___________ 。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。

(1)根据图甲所示,写出盐卤中含量最多的盐为
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到
 ℃以上,根据溶解度曲线,首先析出的晶体应是
℃以上,根据溶解度曲线,首先析出的晶体应是
(3)如图是常用于混合物的分离和提纯的装置:

粗盐的提纯应选择图
 、
、 、
、 等杂质离子加入试剂的顺序可以是
等杂质离子加入试剂的顺序可以是A.NaOH、Na2CO3、BaCl2、HCl B.NaOH、BaCl2、Na2CO3、HCl
C.Na2CO3、BaCl2、NaOH、HCl D.BaCl2、NaOH、Na2CO3、HCl
Ⅱ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。

(4)实验步骤①会用到下列仪器中的
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中K+的存在,
(6)“提取碘”存在以下两种方案。

①方案乙中“操作X”的名称是
②该流程可循环利用的物质是
③采用方案乙得到纯碘的产率较低,原因是
您最近半年使用:0次
5 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。 的一种制备方法如图1所示:
的一种制备方法如图1所示: 可将
可将 氧化成
氧化成 。下列说法错误的是
。下列说法错误的是
 的一种制备方法如图1所示:
的一种制备方法如图1所示: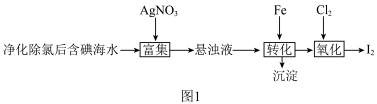
 可将
可将 氧化成
氧化成 。下列说法错误的是
。下列说法错误的是A.“转化”反应的离子方程式为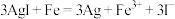 |
B.“转化”产生的沉淀可用 处理后循环使用 处理后循环使用 |
C.“氧化”时,应控制 的量,过多或过少,都会降低单质碘的收率 的量,过多或过少,都会降低单质碘的收率 |
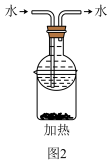
| D.获得的粗碘可采用图2装置进行纯化 |
您最近半年使用:0次
2024-01-10更新
|
85次组卷
|
2卷引用:河南省周口市项城市2023-2024学年上学期高三1月阶段测试理综试题
2023高三·全国·专题练习
6 . 一氯化碘(ICl)是一种卤素互化物。卤素互化物具有强氧化性稀溶液,可与金属直接反应,也可用作有机合成中的碘化剂,一般可由卤素单质直接化合制得。有关一氯化碘制备及性质验证,请回答下列问题:
海藻提碘可得到 的
的 溶液,从其中回收
溶液,从其中回收 的流程如图:
的流程如图:
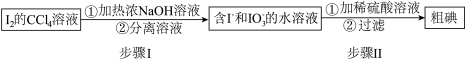
(1)步骤Ⅰ的分离溶液操作中,主要用到的玻璃仪器有烧杯和_______ 。
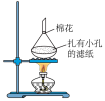
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_______ 。
海藻提碘可得到
 的
的 溶液,从其中回收
溶液,从其中回收 的流程如图:
的流程如图:
(1)步骤Ⅰ的分离溶液操作中,主要用到的玻璃仪器有烧杯和
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是

您最近半年使用:0次
2023高三·全国·专题练习
7 . 全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。空气吹出法工艺是目前“海水提溴”的最主要方法之一、其工艺流程如图:
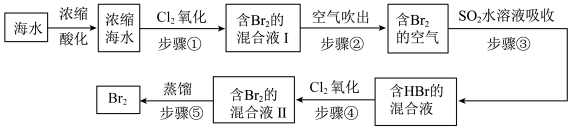
(1)步骤①中获得Br2的离子方程式为____ 。
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是____ 。
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收1molBr2共有___ 个电子转移(用NA的代数式表示)。
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤溶解和____ 。
(5)“试剂a”通常应具有一定的____ 性。利用H2O2完成“溶液A”向“溶液B”的转变。写出该反应的化学方程式:________________ 。
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___ 。(选填编号)
(7)“操作II”宜选用的装置是 。(选填编号)
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:____ 。
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液50.0mL,恰好反应完全。则所测盐中碘的含量是____ mg•g-1(保留四位小数)。

(1)步骤①中获得Br2的离子方程式为
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收1molBr2共有
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤溶解和
(5)“试剂a”通常应具有一定的
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.溴水 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶不与反应 | 与水互溶与I2反应 | 与水不互溶不与I2反应 | 与水不互溶与I2反应 |
(7)“操作II”宜选用的装置是 。(选填编号)
A. | B. | C.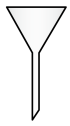 | D.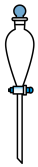 |
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O
 =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液50.0mL,恰好反应完全。则所测盐中碘的含量是
您最近半年使用:0次
名校
8 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
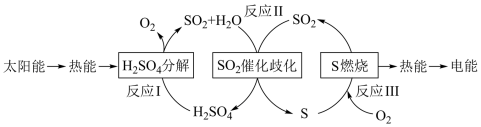
(1)已知反应 I:2H2SO4(l) 2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
反应 III:S(s) + O2 (g) SO2 (g) ΔH3 = −297 kJ/mol
SO2 (g) ΔH3 = −297 kJ/mol
所以反应 II 的热化学方程式为___________ 。
(2)试从绿色化学的角度列举该过程的优势与不足:___________ 。
上述过程中,I- 可以作为水溶液中 SO2歧化反应的催化剂,可能的催化过程如下:
ⅰ. SO2 + 4I- + 4H+ = S↓+ 2I2 + 2H2O ⅱ.I2+ 2H2O + SO2 = + 4H+ + 2I-
+ 4H+ + 2I-
某同学为探究ⅰ、ⅱ反应速率与 SO2歧化反应速率的关系, 进行如下实验:分别将 18mL SO2饱和溶液加入到 2mL 下列试剂中,密闭放置观察现象。 (已知: I2易溶解在 KI 溶液中)
(3)第 2 组是第 1 组实验的对比组,则 a=___________ 。
(4)通过比较第 1、2、3 组实验,可得出的结论是___________ 。
(5)该同学还模拟了实验室用海带制备 I2 的实验, 以下操作错误的是___________。

(1)已知反应 I:2H2SO4(l)
 2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol反应 III:S(s) + O2 (g)
 SO2 (g) ΔH3 = −297 kJ/mol
SO2 (g) ΔH3 = −297 kJ/mol所以反应 II 的热化学方程式为
(2)试从绿色化学的角度列举该过程的优势与不足:
上述过程中,I- 可以作为水溶液中 SO2歧化反应的催化剂,可能的催化过程如下:
ⅰ. SO2 + 4I- + 4H+ = S↓+ 2I2 + 2H2O ⅱ.I2+ 2H2O + SO2 =
 + 4H+ + 2I-
+ 4H+ + 2I-某同学为探究ⅰ、ⅱ反应速率与 SO2歧化反应速率的关系, 进行如下实验:分别将 18mL SO2饱和溶液加入到 2mL 下列试剂中,密闭放置观察现象。 (已知: I2易溶解在 KI 溶液中)
| 序号 | 1 | 2 | 3 | 4 |
| 试剂组成 | 0.4 mol/L KI | amol/L KI、0.2 mol/L H2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI 、0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较组 1 快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较组 1 快 |
(3)第 2 组是第 1 组实验的对比组,则 a=
(4)通过比较第 1、2、3 组实验,可得出的结论是
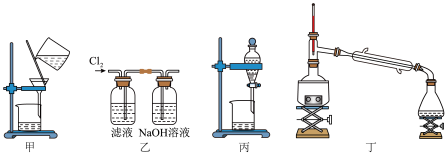
(5)该同学还模拟了实验室用海带制备 I2 的实验, 以下操作错误的是___________。

| A.图甲是过滤海带浸泡液 | B.图乙是向浸泡液中通入 Cl2 氧化 |
| C.图丙是含 I2 的 CCl4 溶液从下口放出 | D.图丁是提取 I2 的同时回收溶剂 |
您最近半年使用:0次
名校
解题方法
9 . 海带中碘元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不合理的是
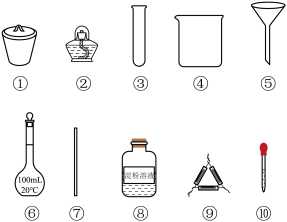

| A.海带预处理,选用①、②和⑨ | B.浸泡过滤,选用④、⑤和⑦ |
| C.处理滤液,选用④、⑥、⑦和⑩ | D.检验碘,选用③、⑧和⑩ |
您最近半年使用:0次
名校
解题方法
10 . 氢气在工业上可用于海水提溴、海带提碘。
Ⅰ.海水提溴工业流程如下图。
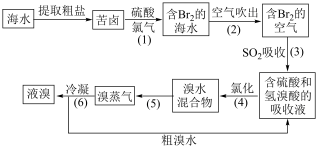
(1)骤(1)中,加硫酸的目的是___________ ;步骤(2)利用了溴的什么物理性质?___________ 。该空气的温度一般控制在80~90℃,温度过高有何不妥?___________ 。
(2)步骤(3)反应中,氧化产物是___________ 。该反应的离子方程式为___________ 。
(3)步骤(2)(3)(4)的目的是___________ 。
(4)步骤(5)、(6)的操作名称依次为___________ 、___________ 。
Ⅱ.海藻中含有丰富的碘元素。实验室中提取碘的流程如下:

(5)步骤①的目的是___________ 。欲确认步骤③中的反应已发生,可取样,加___________ (试剂名称)。
(6)在实验室中进行步骤④操作需要的仪器是___________ 。步骤⑤的名称为___________ 。
(7)关于海水提溴、海藻提碘,下列说法正确的是___________;
Ⅰ.海水提溴工业流程如下图。

(1)骤(1)中,加硫酸的目的是
(2)步骤(3)反应中,氧化产物是
(3)步骤(2)(3)(4)的目的是
(4)步骤(5)、(6)的操作名称依次为
Ⅱ.海藻中含有丰富的碘元素。实验室中提取碘的流程如下:

(5)步骤①的目的是
(6)在实验室中进行步骤④操作需要的仪器是
(7)关于海水提溴、海藻提碘,下列说法正确的是___________;
| A.都需经过浓缩、氧化、提取 |
B.海水提溴的浓缩原理是蒸发,提高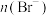 |
C.都可通氯气将 、 、 分别还原为 分别还原为 、 、 |
D.海藻提碘可采用 萃取 萃取 ,海水提溴没有萃取操作 ,海水提溴没有萃取操作 |
您最近半年使用:0次



