名校
1 . 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将23.2g
MnCl2+Cl2↑+2H2O。现将23.2g
含MnO2的质量分数为75%的软锰矿石与足量10mol/L浓盐酸完全反应(杂质不参加反应)。把反应后所得溶液稀释成200ml。计算:
(1)参加反应的MnO2的质量____ 。
(2)生成的Cl2的体积(标准状况)____ 。
(3)稀释后溶液中MnCl2的物质的量浓度____ 。
 MnCl2+Cl2↑+2H2O。现将23.2g
MnCl2+Cl2↑+2H2O。现将23.2g含MnO2的质量分数为75%的软锰矿石与足量10mol/L浓盐酸完全反应(杂质不参加反应)。把反应后所得溶液稀释成200ml。计算:
(1)参加反应的MnO2的质量
(2)生成的Cl2的体积(标准状况)
(3)稀释后溶液中MnCl2的物质的量浓度
您最近一年使用:0次
2020-10-17更新
|
777次组卷
|
5卷引用:广东省大埔县虎山中学2018-2019学年高一上学期期中考试化学试题
名校
解题方法
2 . (1)已知PCl3的熔点、沸点分别为-93.6℃和76.1℃,PCl5的熔点为167℃。常温常压下,PCl3与Cl2反应生成0.5molPCl5时放出热量61.9kJ,该反应的热化学方程式为_______________ 。
(2)某化学研究小组利用软锰矿(主要成分为MnO2)作脱硫剂,既可脱除燃煤尾气中SO2,又可制得电池材料MnO2。
已知:25℃、101kPa时,Mn(s)+O2(g)=MnO2(s)△H1=-520kJ/mol
S(s)+O2(g)=SO2(g)△H2=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s)△H3=-1065kJ/mol
则MnO2(s)+SO2(g)=MnSO4(s)的△H=_______________ kJ/mol
(3)白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—Pa kJ/mol,P—Ob kJ/mol,P=Oc kJ/mol,O=Od kJ/mol。
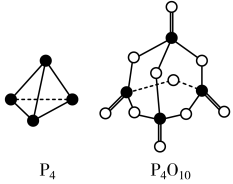
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是____________ 。
A.(6a+5d-4c-12b) kJ/mol B.(4c+12b-6a-5d) kJ/mol
C.(4c+12b-4a-5d) kJ/mol D.(4a+5d-4c-12b) kJ/mol
(2)某化学研究小组利用软锰矿(主要成分为MnO2)作脱硫剂,既可脱除燃煤尾气中SO2,又可制得电池材料MnO2。
已知:25℃、101kPa时,Mn(s)+O2(g)=MnO2(s)△H1=-520kJ/mol
S(s)+O2(g)=SO2(g)△H2=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s)△H3=-1065kJ/mol
则MnO2(s)+SO2(g)=MnSO4(s)的△H=
(3)白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—Pa kJ/mol,P—Ob kJ/mol,P=Oc kJ/mol,O=Od kJ/mol。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A.(6a+5d-4c-12b) kJ/mol B.(4c+12b-6a-5d) kJ/mol
C.(4c+12b-4a-5d) kJ/mol D.(4a+5d-4c-12b) kJ/mol
您最近一年使用:0次
2020-10-15更新
|
173次组卷
|
2卷引用:广东省广州市中山大学附属中学2019-2020学年高二10月月考化学试题
3 . 请按要求,回答下列问题:
(1)同温同压下,0.3mol氧气和0.2mol臭氧的质量比为____ 。
(2)某气体的质量为3.4g,含有6.02×1022个分子,则该气体的摩尔质量为____
(3)标准状况下,89.6LHCl气体溶于1L水(ρ=1g/mL)中,所得盐酸的密度为1.09g/mL,则此盐酸的物质的量浓度为_____
(1)同温同压下,0.3mol氧气和0.2mol臭氧的质量比为
(2)某气体的质量为3.4g,含有6.02×1022个分子,则该气体的摩尔质量为
(3)标准状况下,89.6LHCl气体溶于1L水(ρ=1g/mL)中,所得盐酸的密度为1.09g/mL,则此盐酸的物质的量浓度为
您最近一年使用:0次
2020-10-09更新
|
366次组卷
|
2卷引用:广东省湛江市2018-2019学年高一化学(人教版)第一学期期末调研化学试题
解题方法
4 . 把11.1 g铝镁合金的粉末放入200 mL某盐酸中,恰好完全反应并得到11.2 L H2(标准状况下)。试计算:
(1) 上述反应过程中,转移电子的物质的量______ 。
(2) 该合金中铝的质量分数______ 。
(1) 上述反应过程中,转移电子的物质的量
(2) 该合金中铝的质量分数
您最近一年使用:0次
10-11高二上·河南周口·期中
5 . 向8 g二价金属的氧化物固体中加入稀H2SO4,使其恰好完全溶解,已知所消耗的硫酸体积为100 mL,在所得溶液中插入铂电极进行电解,通电一段时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28 g。
(1)根据计算确定金属氧化物的名称___ 。
(2)计算通电后硫酸溶液的物质的量浓度____ (假设溶液体积不变)。
(1)根据计算确定金属氧化物的名称
(2)计算通电后硫酸溶液的物质的量浓度
您最近一年使用:0次
解题方法
6 . (1)相同物质的量的CO2和O2,其分子数之比为_______ ,原子数之比为_______ ,氧原子数之比为_______ 。
(2)0.5mol(NH4)2S的质量为________ g
(3)现要配制1 mol/L Na2CO3溶液250mL,
①若用固体溶于水配制,需用托盘天平称量Na2CO3_______ g
②也可用量筒量取________ mL 4mol/L的Na2CO3溶液,加水稀释制得。
(4)标准状况下,1.7g NH3与_______ L H2S气体含有的氢原子数相同。
(2)0.5mol(NH4)2S的质量为
(3)现要配制1 mol/L Na2CO3溶液250mL,
①若用固体溶于水配制,需用托盘天平称量Na2CO3
②也可用量筒量取
(4)标准状况下,1.7g NH3与
您最近一年使用:0次
名校
解题方法
7 . (1)某气态氧化物的化学式为RO2,在标准状况下,1.6g该氧化物的体积为560mL,则R的摩尔质量为_________ 。
(2)已知CO、SO2的混合气体质量共20.8g,标准状况下体积为8.96L,则可推知该混合气体的平均相对分子质量为__________ 。
(3)标准状况下9.03×1023个CH4所占的体积为________ ;与________ 个NH3含有相同数目的氢原子。
(4)与112gN2H4所含有分子数相同的氧气的体积(标准状况)是_________ L。
(5)质量比为85:28的NH3、CO所含质子数之比为_________ 。
(6)配制100ml 1mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g/ml,质量分数为98%)的体积为_____ mL.
(7)某常见气体在标准状况下的密度为1.25g/L,若该气体的分子式为A2型,则其名称是_____________ 。
(8)在27g某二价金属的氯化物中含有0.4mol,此氯化物的摩尔质量为_____ 。
(2)已知CO、SO2的混合气体质量共20.8g,标准状况下体积为8.96L,则可推知该混合气体的平均相对分子质量为
(3)标准状况下9.03×1023个CH4所占的体积为
(4)与112gN2H4所含有分子数相同的氧气的体积(标准状况)是
(5)质量比为85:28的NH3、CO所含质子数之比为
(6)配制100ml 1mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g/ml,质量分数为98%)的体积为
(7)某常见气体在标准状况下的密度为1.25g/L,若该气体的分子式为A2型,则其名称是
(8)在27g某二价金属的氯化物中含有0.4mol,此氯化物的摩尔质量为
您最近一年使用:0次
11-12高一上·辽宁抚顺·阶段练习
名校
解题方法
8 . 常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g•cm-3的混合溶液。计算:
(1)混合后溶液中溶质的质量分数为____ 。
(2)混合后溶液中溶质的物质的量浓度为___ 。
(3)在1000g水中需溶解____ molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等。
(1)混合后溶液中溶质的质量分数为
(2)混合后溶液中溶质的物质的量浓度为
(3)在1000g水中需溶解
您最近一年使用:0次
2020-08-31更新
|
1444次组卷
|
35卷引用:广东省仲元中学2017-2018学年高一上学期期中考试化学试题
广东省仲元中学2017-2018学年高一上学期期中考试化学试题(已下线)2011-2012学年辽宁省抚顺县高中高一9月月考理科综合试题(化学部分)(已下线)2014-2015学年云南省玉溪市一中高一上学期期中化学试卷2016-2017学年北大附中河南分校高一上第一次月考化学卷2016-2017学年湖南省双峰县第一中学高一上第一次月考化学试卷2016-2017学年湖南省湘潭县第一中学高一下学期第一次模块考试化学试卷河北省定州中学2017-2018学年高一上学期开学考试化学试题河南省林州市第一中学2017-2018学年高一(普通班)10月调研化学试题甘肃省武威第五中学2017-2018学年高一上学期第一次月考化学试题四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题河北省石家庄市第一中学2017-2018学年高一上学期期中考试化学试题福建省晋江市季延中学2017-2018学年高一上学期期中考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高一上学期11月考试化学试题河北省辛集市第一中学2017-2018学年高二上学期第三次月考化学试题江苏省南通市、盐城市六校联盟2017-2018学年高一上学期期中联考(通泰)化学试题(已下线)2018年9月7日 《每日一题》人教必修1-溶液稀释或混合的计算(已下线)2018年9月16日《每日一题》人教必修1- 每周一测(已下线)2018年10月20日 《每日一题》人教必修1 - 周末培优四川省三台中学实验学校2018-2019学年高一上学期第一次月考化学试题(已下线)第16天 溶解度、溶质质量分数和物质的量浓度之间的关系——《2019年暑假作业总动员》高一化学(已下线)2019年9月6日《每日一题》 必修1 溶液稀释或混合的计算(已下线)2019年9月15日 《每日一题》必修1 —— 每周一测2019年10月19日《每日一题》2019-2020学年高一化学人教必修1——周末培优吉林省榆树市第一高级中学2019-2020学年高一上学期期中考试化学试卷四川省成都市成都外国语学校2019-2020学年高一上学期期中考试化学试题四川省成都三中2019-2020学年高一11月月考化学试题(已下线)期中模拟卷(二)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)苏教版(2020)高一必修第一册专题2第二单元突破1 物质的量浓度的有关计算人教版(2019)高一必修第一册 第二章 专题2 物质的量浓度的有关计算鲁科版(2019)高一必修第一册第1章 认识化学科学 第3节 物质的量 专题1 物质的量浓度的有关计算高一必修第一册(鲁科2019)第1章 章末综合检测卷甘肃省武威八中2020-2021学年高一上学期10月月考化学试题甘肃省民勤县第一中学2020-2021学年高一上学期第一次月考化学试题安徽桐城重点中学2021-2022学年高一上学期开学教学质量检测化学试题(已下线)【南昌新东方】2019 湾里一中 高一上第一次月考
解题方法
9 . 请完成下列计算:
(1)标准状况下,2.24LNH3的物质的量是__ mol,与__ g水中所含氢原子数相同。
(2)用10g烧碱配制成250mL溶液,其物质的量浓度为___ mol•L-1;从中取出10mL,其物质的量浓度为__ mol·L-1,含溶质__ g。
(1)标准状况下,2.24LNH3的物质的量是
(2)用10g烧碱配制成250mL溶液,其物质的量浓度为
您最近一年使用:0次
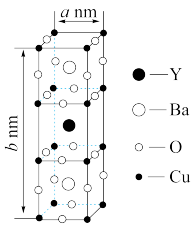
10 . 已知:钇钡铜氧晶体的晶胞是一个长方体(如图所示),其晶胞参数分别为a nm、bnm,阿伏加 德罗常数的值为NA。则该晶体的密度为________ g /cm3(列出计算式即可)。(原子量:Y-89 Ba-137 Cu-64 O-16)

您最近一年使用:0次



