1 . 如图所示的原电池,电极材料是银和锌,电解质溶液是硫酸铜,一段时间后某极析出6.4克的固体。回答下列问题:
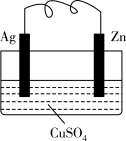
(1)正极是______ (填“锌”或“银),发生______ 反应;
(2)正极的电极反应式为______ ;
(3)上述过程中共需转移电子______ mol;
(4)锌片的质量减少了______ 克。

(1)正极是
(2)正极的电极反应式为
(3)上述过程中共需转移电子
(4)锌片的质量减少了
您最近一年使用:0次
名校
解题方法
2 . 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示。

(1)A室混合气体的物质的量为________ ,所含原子总数为________ 。
(2)实验测得A室混合气体的质量为34g,该混合气体的密度是同温同压条件下氦气密度的________ 倍,该混合气体含电子总数为________ 。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________ 刻度,容器内气体压强与反应前气体压强之比为________ 。

(1)A室混合气体的物质的量为
(2)实验测得A室混合气体的质量为34g,该混合气体的密度是同温同压条件下氦气密度的
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在
您最近一年使用:0次
3 . NH3的催化氧化是制备硝酸的重要反应之一,下面是对氨的催化氧化进行的研究。氨的催化氧化反应为4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)。在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度随时间的变化如表:
(l)c1=_____ mol•L-1;c2=_____ mol•L-1。
(2)0~2min内,v(NH3)=_____ mol•L-1•min-1。
(3)工业上需要加快氨气的反应速率,下列措施可行的是_____ (填标号)。
A.使用合适的催化剂
B.减小O2的浓度
C.适当升高温度
(4)反应达到平衡时,O2的转化率为_____ 。
| 0 | 1min | 2min | 3min | 4min | |
| c(NH3)/mol·L-1 | 0.800 | c1 | 0.300 | 0.200 | 0.200 |
| c(O2)/mol·L-1 | 1.600 | 1.100 | 0.975 | 0.850 | c2 |
(l)c1=
(2)0~2min内,v(NH3)=
(3)工业上需要加快氨气的反应速率,下列措施可行的是
A.使用合适的催化剂
B.减小O2的浓度
C.适当升高温度
(4)反应达到平衡时,O2的转化率为
您最近一年使用:0次
2020-07-28更新
|
235次组卷
|
3卷引用:广东省2019-2020学年高一下学期期末考试化学试题
解题方法
4 . 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)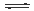 2NH3(g)
2NH3(g)
在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
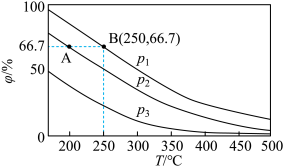
①其中,p1、p2和p3由大到小的顺序是___ ,其原因是___ 。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)___ vB(N2)(填“>”“<”或“=”)。
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为___ Pa(分压=总压×物质的量分数,保留一位小数)。
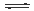 2NH3(g)
2NH3(g)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。

①其中,p1、p2和p3由大到小的顺序是
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为
您最近一年使用:0次
解题方法
5 . 将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) ⇌xC(g)+2D(g),经2min后,测得D的浓度为0.5 mol•L-1,c(A):c(B)=3:4,C的平均反应速率为0.5 mol•L-1•min-1。求
(1)此时A的浓度c(A)=_____ mol•L-1,反应开始前容器中的A、B的物质的量:n(A)=n(B)=_______ mol。
(2)B的平均反应速率ν(B)=_______ mol•L-1•min-1。
(3)x的值为_________ 。
(1)此时A的浓度c(A)=
(2)B的平均反应速率ν(B)=
(3)x的值为
您最近一年使用:0次
2020-06-26更新
|
315次组卷
|
2卷引用:广东省湛江市2019-2020学年高一下学期期末调研考试化学试题
6 . (1)现有34 g某气体,它们的摩尔质量为17 g·mol-1。则:
①该气体的物质的量为______ mol。
②该气体所含分子数为______ NA。
③该气体在标准状况下的体积为______ L。
④该气体完全溶解于500 mL水后稀释到2 L,物质的量浓度为______ mol·L-1。
(2)______ g H2O中的氧原子数目与标准状况下22.4 L CO2 中的氧原子数目相同。
(3)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为_____ 。
②NA 为阿伏加 德罗常数,已知a g 某气体中含分子数为b,则该气体的摩尔质量为_____ 。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为_____ 。
①该气体的物质的量为
②该气体所含分子数为
③该气体在标准状况下的体积为
④该气体完全溶解于500 mL水后稀释到2 L,物质的量浓度为
(2)
(3)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为
②NA 为阿伏加 德罗常数,已知a g 某气体中含分子数为b,则该气体的摩尔质量为
③已知一个铁原子的质量为b g,则铁原子摩尔质量为
您最近一年使用:0次
7 . 某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示.则:
(1)以Ca(OH)2全部转化为CaCO3时消耗的CO2质量为_____ g;
(2)4.0g样品中杂质CaCO3的质量为______________ ?(写出计算过程)
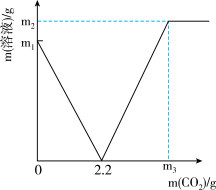
(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为_____ (精确到0.1%).若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果_____ (填“有”、“没有”)影响.原因是_____ .
(1)以Ca(OH)2全部转化为CaCO3时消耗的CO2质量为
(2)4.0g样品中杂质CaCO3的质量为

(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为
您最近一年使用:0次
8 . “题18图”为两物质的溶解度曲线。请回答:

(1)50℃时,Na2Cr2O7的溶解度为________ g;60℃时溶解度:Na2Cr2O7__________ Na2SO4(填“<”、“=”、“>”)。
(2)在50℃时,把210gNa2Cr2O7饱和溶液降温到10℃时,析出Na2Cr2O7______________ g (假设不含结晶水)。

(1)50℃时,Na2Cr2O7的溶解度为
(2)在50℃时,把210gNa2Cr2O7饱和溶液降温到10℃时,析出Na2Cr2O7
您最近一年使用:0次
9 . 2017年5月18日,中国在南海成功试采可燃冰,它将推动世界能源利用格局的改变.可燃冰是在高压低温环境条件下,水分子笼中装有甲烷分子而成的“冰块”,可直接点燃.已知某种可燃冰的化学式为:CH4•8H2O.请回答:
(1)这种可燃冰中含有_____ 种元素:原子个数比:C:H:O=_____ ;
(2)这种可燃冰中甲烷的质量分数为_____ %;936g(约1升)该可燃冰常温下可释放出_____ 升甲烷(常温下甲烷密度为0.72g/L).
(1)这种可燃冰中含有
(2)这种可燃冰中甲烷的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)___ gH2O2中所含原子数与0.2molH3PO4所含原子数相等。
(2)同温同压下某容器中分别充满了O2、CO2及某气体X时的质量分别是116g、122g、114g,则气体X的相对分子质量是___ 。
(3)14.2g无水硫酸钠配制成500毫升溶液,其物质的量浓度为___ ;若从中取出50毫升溶液,其物质的量浓度为___ ,若将这50毫升溶液用水稀释到100毫升所得溶液中Na+的物质的量浓度为___ 。
(1)
(2)同温同压下某容器中分别充满了O2、CO2及某气体X时的质量分别是116g、122g、114g,则气体X的相对分子质量是
(3)14.2g无水硫酸钠配制成500毫升溶液,其物质的量浓度为
您最近一年使用:0次



