名校
解题方法
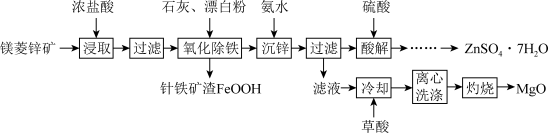
1 . 镁菱锌矿(主要成分为ZnCO3、MgCO3等,含有少量FeCO3、CaCO3等杂质)可用于生产媒染剂、防腐剂ZnSO4•7H2O以及耐火材料MgO。制备工艺流程如图:
回答下列有关问题:
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是_______ 。
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为_______ 。
(3)“沉锌”时,加入氨水调节pH的范围是_______ 。
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、_______ 制得的ZnSO4•7H2O在烘干时需减压烘干的原因是_______ 。
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:_______ 。
| 阳离子 | Fe3+ | Fe2+ | Zn2+ | Mg2+ | Ca2+ |
| 开始沉淀 | 2.7 | 7.6 | 6.2 | 9.4 | 13 |
| 完全沉淀 | 3.7 | 9.6 | 8.2 | 12.4 | _______ |
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为
(3)“沉锌”时,加入氨水调节pH的范围是
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:
您最近一年使用:0次
名校
解题方法
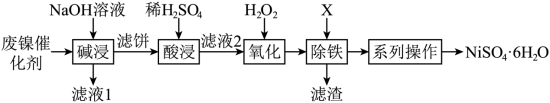
2 . 利用油脂厂废弃镍(Ni)催化剂(主要含有Ni,还含少量Al、Fe、NiO、Al2O3、Fe2O3)制备NiSO4·6H2O的工艺流程如下:
(1)为了加快“碱浸”的速率可以采取的措施是_______ (任写两条)。
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式____ 。
(3)“滤液2” 中含金属阳离子有_______ 。
(4)①“氧化”中反应的离子反应方程式是_______ 。
②“氧化”中可以代替H2O2的最佳物质是_______ (填标号)。
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的_______ 。
a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法_______ 。
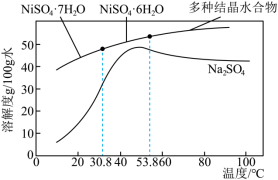
③结晶:将滤液蒸发、降温至稍高于_______ ℃结晶,过滤即获得产品,硫酸镍晶体溶解度曲线图如图所示。
(1)为了加快“碱浸”的速率可以采取的措施是
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式
(3)“滤液2” 中含金属阳离子有
(4)①“氧化”中反应的离子反应方程式是
②“氧化”中可以代替H2O2的最佳物质是
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O
 Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法
③结晶:将滤液蒸发、降温至稍高于
您最近一年使用:0次
3 . 以某四氯化钛精制厂的尾渣(主要含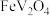 、
、 、NaCl及少量的
、NaCl及少量的 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下: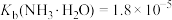 ;
; ;
;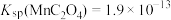
(1)“水洗”的目的为___________ 。“水洗”和“酸浸”后均采用减压过滤,与常压过滤相比,其优点为___________ 。
(2)“焙烧”的目的是将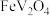 转化为
转化为 和可溶于水的
和可溶于水的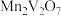 ,以利于“酸浸”时钒浸出。
,以利于“酸浸”时钒浸出。
①该反应的化学方程式为___________ 。
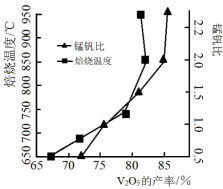
②钒浸出率与焙烧温度、锰钒比的关系如图所示。“焙烧”的最佳温度和锰钒比分别为___________ 、___________ 温度不宜过低的可能原因为___________ 。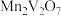 与
与 按物质的量比1:1进行反应的离子方程式为
按物质的量比1:1进行反应的离子方程式为___________
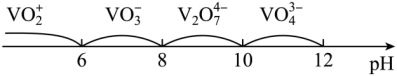
(4)“沉钒”时,在25℃下维持溶液pH=7,向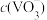 =0.2
=0.2 的酸浸液中加入等体积的
的酸浸液中加入等体积的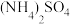 溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中
溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中 =0.005
=0.005 ,则沉钒率为
,则沉钒率为___________ %。
(5)“煅烧”所得 可制成铝钒合金(
可制成铝钒合金(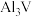 ),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为
),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为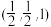 。
。___________ 。
②B点原子的分数坐标为(1, ,
,___________ )(用含b、c的代数式表示),V原子的配位数为___________ 。
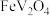 、
、 、NaCl及少量的
、NaCl及少量的 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下: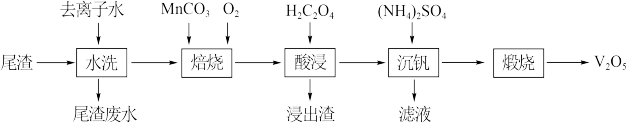
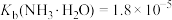 ;
; ;
;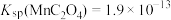
(1)“水洗”的目的为
(2)“焙烧”的目的是将
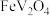 转化为
转化为 和可溶于水的
和可溶于水的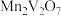 ,以利于“酸浸”时钒浸出。
,以利于“酸浸”时钒浸出。①该反应的化学方程式为
②钒浸出率与焙烧温度、锰钒比的关系如图所示。“焙烧”的最佳温度和锰钒比分别为
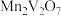 与
与 按物质的量比1:1进行反应的离子方程式为
按物质的量比1:1进行反应的离子方程式为(4)“沉钒”时,在25℃下维持溶液pH=7,向
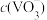 =0.2
=0.2 的酸浸液中加入等体积的
的酸浸液中加入等体积的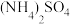 溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中
溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中 =0.005
=0.005 ,则沉钒率为
,则沉钒率为(5)“煅烧”所得
 可制成铝钒合金(
可制成铝钒合金(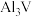 ),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为
),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为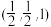 。
。
②B点原子的分数坐标为(1,
 ,
,
您最近一年使用:0次
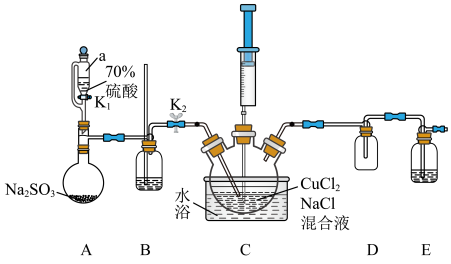
4 . 氯化亚铜(CuCl)广泛应用于有机合成,难溶于水和乙醇,在潮湿空气中易氧化和水解。某学习小组探究CuCl的制备并测定纯度。回答下列问题:
已知:①
②某些含铜化合物和离子在水中的颜色和状态如下表:
Ⅰ.组装仪器,检查装置气密性,添加药品;
Ⅱ.水浴加热三颈烧瓶,打开K1、K2;
Ⅲ.待三颈烧瓶中溶液由黄绿色变为无色,关闭K1、K2;
Ⅳ.通过注射器向三颈烧瓶中加入水,生成白色沉淀,一段时间后部分沉淀变为棕红色。
(1)仪器a的名称为___________ ;B的作用为___________ (答出一点即可)。
(2)步骤Ⅲ反应的离子方程式为___________ 。
(3)步骤Ⅳ中,沉淀由白色转化为棕红色的原因___________ 。
(4)为防止生成棕红色固体,还需在原步骤Ⅰ中通过注射器往三颈烧瓶中加入一定量___________ (药品名称),再按上述步骤进行实验即可。
(5)产品先快速水洗后再醇洗,醇洗的目的为___________ 。
(6)测定CuCl产品纯度:将10.00 g产品溶于硝酸,配成250 mL溶液,取25.00 mL,加20.00 mL 0.5000 mol/L AgNO3溶液,充分反应后,加少量硝基苯覆盖沉淀。NH4Fe(SO4)2溶液作指示剂,用0.1000mol/L NH4SCN标准溶液滴定过量的AgNO3溶液,平行实验三次,平均消耗NH4SCN溶液10.00 mL。产品的纯度为___________ ,若未加入硝基苯会导致测定结果___________ (填“偏高”或“偏低”或“无影响”)。
[已知: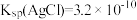 ,
,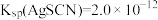 ]。
]。
已知:①

②某些含铜化合物和离子在水中的颜色和状态如下表:
| 化合物或离子 | CuCl | [CuCl4]2- | [CuCl3]2- | CuOH | Cu2O |
| 颜色和状态 | 白色沉淀 | 黄绿色溶液 | 无色溶液 | 黄色沉淀 | 棕红色沉淀 |
Ⅰ.组装仪器,检查装置气密性,添加药品;
Ⅱ.水浴加热三颈烧瓶,打开K1、K2;
Ⅲ.待三颈烧瓶中溶液由黄绿色变为无色,关闭K1、K2;
Ⅳ.通过注射器向三颈烧瓶中加入水,生成白色沉淀,一段时间后部分沉淀变为棕红色。
(1)仪器a的名称为
(2)步骤Ⅲ反应的离子方程式为
(3)步骤Ⅳ中,沉淀由白色转化为棕红色的原因
(4)为防止生成棕红色固体,还需在原步骤Ⅰ中通过注射器往三颈烧瓶中加入一定量
(5)产品先快速水洗后再醇洗,醇洗的目的为
(6)测定CuCl产品纯度:将10.00 g产品溶于硝酸,配成250 mL溶液,取25.00 mL,加20.00 mL 0.5000 mol/L AgNO3溶液,充分反应后,加少量硝基苯覆盖沉淀。NH4Fe(SO4)2溶液作指示剂,用0.1000mol/L NH4SCN标准溶液滴定过量的AgNO3溶液,平行实验三次,平均消耗NH4SCN溶液10.00 mL。产品的纯度为
[已知:
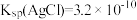 ,
,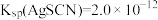 ]。
]。
您最近一年使用:0次
5 . 某小组在实验室模拟侯氏制碱工艺制备 ,装置如图所示(夹持装置略去),下列离子方程式错误的是
,装置如图所示(夹持装置略去),下列离子方程式错误的是
 ,装置如图所示(夹持装置略去),下列离子方程式错误的是
,装置如图所示(夹持装置略去),下列离子方程式错误的是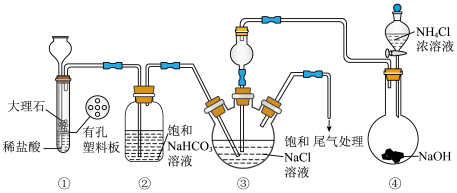
A.①中: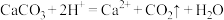 | B.②中: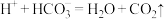 |
C.③中: | D.④中: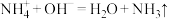 |
您最近一年使用:0次
6 . 硼氢化钠可作还原剂,与水反应的化学方程式为 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.3.8g 固体中含有的离子数为0.2 固体中含有的离子数为0.2 |
B.pH=7的纯水中含有的 数为 数为 |
C.0.1 mol 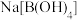 中含有的 中含有的 键数为0.4 键数为0.4 |
D.生成22.4L(已折算成标准状况)的 时,转移的电子数为2 时,转移的电子数为2 |
您最近一年使用:0次
7 . A、B、C、D、E四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D的最外层电子数是次外层电子数的3倍;E的单质是用途最广泛的半导体材料。试推断它们各是什么元素并回答下列问题:
(1)写出下列元素符号:A________ ,C________ ,E________ 。
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为_____________ (用化学式表示)
(3)画出D的离子结构示意图______________ 。
(4)用一个化学方程式证明B、E的非金属性的强弱________________ 。
(5)写出E的最高价氧化物的一种用途:_______________ 。
(1)写出下列元素符号:A
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为
(3)画出D的离子结构示意图
(4)用一个化学方程式证明B、E的非金属性的强弱
(5)写出E的最高价氧化物的一种用途:
您最近一年使用:0次
名校
8 . 一种处理温室气体二氧化碳的方法: ,
, 代表阿伏加德罗常数的值。下列说法
代表阿伏加德罗常数的值。下列说法不正确 的是
 ,
, 代表阿伏加德罗常数的值。下列说法
代表阿伏加德罗常数的值。下列说法A.标准状况下,2.24 L  中共用的电子对数为 中共用的电子对数为 |
B.0.1 mol 中含有的电子数为 中含有的电子数为 |
C.生成18 g 转移电子数为 转移电子数为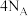 |
D.1 mol  和2 mol 和2 mol  充分反应生成 充分反应生成 的分子数为 的分子数为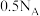 |
您最近一年使用:0次
9 . 1994年我国某物理研究所取得重大科研成果,研制出首批氧-18气体( ),氧-18是一种稳定的氧的同位素,称为重氧。下列有关说法正确的是
),氧-18是一种稳定的氧的同位素,称为重氧。下列有关说法正确的是
 ),氧-18是一种稳定的氧的同位素,称为重氧。下列有关说法正确的是
),氧-18是一种稳定的氧的同位素,称为重氧。下列有关说法正确的是A. 气体的摩尔质量是36 气体的摩尔质量是36 | B.2.0 g重氧水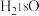 所含的中子数约为 所含的中子数约为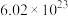 |
C.0.2 mol 气体的体积约为4.48 L 气体的体积约为4.48 L | D.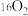 、 、 、 、 互为同位素 互为同位素 |
您最近一年使用:0次
名校
解题方法
10 . 用化学用语表示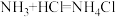 中的相关微粒,其中正确的是
中的相关微粒,其中正确的是
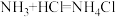 中的相关微粒,其中正确的是
中的相关微粒,其中正确的是A.中子数为8的氮原子: | B.HCl的电子式: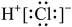 |
C. 既含共价键又含离子键 既含共价键又含离子键 | D. 的结构示意图: 的结构示意图: |
您最近一年使用:0次



