名校
1 . 高铁酸钾是一种安全性很高的水处理剂,不仅能去除水污染物和致癌化学物质,还不会产生有害产物。制备原理为: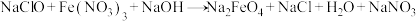 (未配平),最后加入
(未配平),最后加入 ,析出
,析出 沉淀。下列说法不正确的是
沉淀。下列说法不正确的是
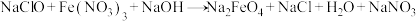 (未配平),最后加入
(未配平),最后加入 ,析出
,析出 沉淀。下列说法不正确的是
沉淀。下列说法不正确的是A.氧化性: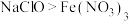 |
B.氧化产物与还原产物的物质的量之比为 |
C.每消耗 ,就会生成 ,就会生成 水 水 |
| D.高铁酸钾的溶解度小于高铁酸钠 |
您最近一年使用:0次
名校
解题方法
2 . 氧烛可用于潜艇或密闭空间供氧,由下表中物质压制成形,其原理为受热时,利用d区元素形成的氧化物催化制氧剂分解产生O2.下列说法正确的是
| 成分 | Al | Fe | KClO3 | BaO2 | SiO2、Al2O3 |
| 作用 | 燃烧物 | 产生催化剂 | 制氧剂 | Cl2吸收剂 | 定型剂 |
| A.氧烛供氧时,Al燃烧为KClO3分解提供能量 |
| B.氧烛成分中的Fe也可以用Cu来代替 |
C.BaO2吸收氯气时发生反应: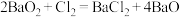 |
| D.氧烛燃尽后残留物可以全部溶解在足量氢氧化钠溶液中 |
您最近一年使用:0次
2024-03-05更新
|
646次组卷
|
3卷引用:河北省秦皇岛市部分示范高中2024届高三下学期三模化学试题
3 . 水氧化反应是水分解反应的决速步骤,章宇超团队利用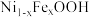 作光催化剂,通过以下转化途径,显著提升光催化水氧化反应速率,为太阳能的高效利用提供了新的策略。下列有关说法正确的是
作光催化剂,通过以下转化途径,显著提升光催化水氧化反应速率,为太阳能的高效利用提供了新的策略。下列有关说法正确的是
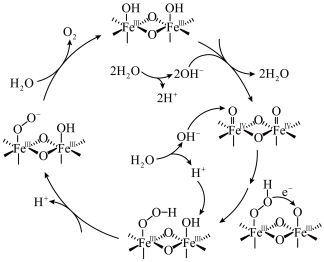
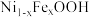 作光催化剂,通过以下转化途径,显著提升光催化水氧化反应速率,为太阳能的高效利用提供了新的策略。下列有关说法正确的是
作光催化剂,通过以下转化途径,显著提升光催化水氧化反应速率,为太阳能的高效利用提供了新的策略。下列有关说法正确的是
| A.转化途径中产生1个O2,理论上转移4个电子 |
| B.转化过程中化合态的O元素价态相同 |
| C.含Fe的化合物均为光电催化剂 |
| D.转化过程中光能最终全部转换为化学能 |
您最近一年使用:0次
解题方法
4 . 下图是某市售盐酸试剂瓶标签上的部分数据,请回答下列问题:
(1)用市售浓盐酸配制250mL 0.1 稀盐酸,配制过程中要用到的玻璃仪器有
稀盐酸,配制过程中要用到的玻璃仪器有_______ (填字母序号)。

(2)仪器E的名称是_______ ,其在使用前首先需要_______ 。
(3)市售盐酸的物质的量浓度是_______ (保留三位有效数字)。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”或“无影响”)。
①洗净的容量瓶内有少量水:_______ 。
②用量筒量取浓盐酸时仰视刻度线:_______ 。
③搅拌稀释浓盐酸时有液体溅出烧杯:_______ 。
④定容时,俯视容量瓶的刻度线定容:_______ 。
(5)若将标准状况下体积为V L的HCl气体溶于1L水中,所得溶液的密度为 ,计算所得溶液中HCl的质量分数为
,计算所得溶液中HCl的质量分数为_______ ,HCl的物质的量浓度为_______  。
。
(6)新型消毒剂 可以用浓盐酸与
可以用浓盐酸与 溶液反应制备,反应的化学方程式为
溶液反应制备,反应的化学方程式为
 ,反应生成2mol
,反应生成2mol  转移的电子数为
转移的电子数为_______ ,还原剂和还原产物的物质的量之比为_______ 。
盐酸 化学式:HCl 相对分子质量:36.5 外观:合格 密度:1.18g·cm-3 HCl的质量分数:36.5% 符合GB622-89 |
(1)用市售浓盐酸配制250mL 0.1
 稀盐酸,配制过程中要用到的玻璃仪器有
稀盐酸,配制过程中要用到的玻璃仪器有
(2)仪器E的名称是
(3)市售盐酸的物质的量浓度是
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”或“无影响”)。
①洗净的容量瓶内有少量水:
②用量筒量取浓盐酸时仰视刻度线:
③搅拌稀释浓盐酸时有液体溅出烧杯:
④定容时,俯视容量瓶的刻度线定容:
(5)若将标准状况下体积为V L的HCl气体溶于1L水中,所得溶液的密度为
 ,计算所得溶液中HCl的质量分数为
,计算所得溶液中HCl的质量分数为 。
。(6)新型消毒剂
 可以用浓盐酸与
可以用浓盐酸与 溶液反应制备,反应的化学方程式为
溶液反应制备,反应的化学方程式为
 ,反应生成2mol
,反应生成2mol  转移的电子数为
转移的电子数为
您最近一年使用:0次
5 . 钛白粉(主要成分 )是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分
)是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分 ,还有
,还有 、
、 、
、 等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:

已知:“酸溶”后钛主要以 形式存在,
形式存在, 在80°C左右水解生成
在80°C左右水解生成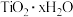
(1) 中
中 的化合价为
的化合价为___________ 。
(2)“酸溶”时主要成分发生反应的离子方程式为___________ ;废渣的主要成分为___________ 。
(3)“还原”时试剂X应选择合适的试剂是___________ ;常温下溶解度:
__________ 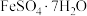 (填“大于”或“小于”)。
(填“大于”或“小于”)。
(4)“氧化”时发生的主要反应化学方程式为___________ 。
(5)以上两种工艺流程中,循环使用的物质有___________ ;请说出方法一优于方法二的理由___________ (写出一条即可)。
(6)若钛铁矿中 的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精
的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精 mg,则Ti元素的回收率为
mg,则Ti元素的回收率为___________ %(用含m的计算式表示)。
 )是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分
)是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分 ,还有
,还有 、
、 、
、 等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
已知:“酸溶”后钛主要以
 形式存在,
形式存在, 在80°C左右水解生成
在80°C左右水解生成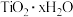
(1)
 中
中 的化合价为
的化合价为(2)“酸溶”时主要成分发生反应的离子方程式为
(3)“还原”时试剂X应选择合适的试剂是

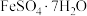 (填“大于”或“小于”)。
(填“大于”或“小于”)。(4)“氧化”时发生的主要反应化学方程式为
(5)以上两种工艺流程中,循环使用的物质有
(6)若钛铁矿中
 的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精
的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精 mg,则Ti元素的回收率为
mg,则Ti元素的回收率为
您最近一年使用:0次
解题方法
6 . 实验室可以用氯气制备多种物质,某化学小组在实验室制备 、NaClO和
、NaClO和 三种物质。实验装置如下图所示,其中C的试管里盛有15mL 30% KOH溶液,并置于热水浴中;D的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;F中硬质玻璃管中为还原铁粉,FeCl3能吸收空气里的水分而潮解。回答下列问题:
三种物质。实验装置如下图所示,其中C的试管里盛有15mL 30% KOH溶液,并置于热水浴中;D的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;F中硬质玻璃管中为还原铁粉,FeCl3能吸收空气里的水分而潮解。回答下列问题:
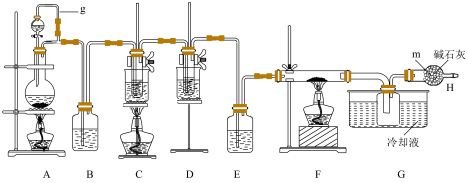
(1)装置A中用 和浓盐酸反应制备
和浓盐酸反应制备 的离子方程式为
的离子方程式为_______ 。
(2)装置A中g管的作用是_______ ;装置B中的试剂是_______ ;装置E中的试剂是_______ 。
(3)比较制取 和NaClO的反应条件,二者的差异是:
和NaClO的反应条件,二者的差异是:_______ 。
(4)写出制备NaClO反应的离子方程式_______ 。
(5)写出制备 的化学反应方程式
的化学反应方程式_______ 。
(6)若没有控制好反应温度,C中产物中可能有 、KClO和KCl三种盐生成,反应后
、KClO和KCl三种盐生成,反应后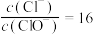 ,则溶液
,则溶液
_______ (填分数比)。
(7)碱石灰的成分是NaOH和CaO的混合物,盛放碱石灰的仪器m的名称是_______ ,其作用是(答出两条)_______ 。
 、NaClO和
、NaClO和 三种物质。实验装置如下图所示,其中C的试管里盛有15mL 30% KOH溶液,并置于热水浴中;D的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;F中硬质玻璃管中为还原铁粉,FeCl3能吸收空气里的水分而潮解。回答下列问题:
三种物质。实验装置如下图所示,其中C的试管里盛有15mL 30% KOH溶液,并置于热水浴中;D的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;F中硬质玻璃管中为还原铁粉,FeCl3能吸收空气里的水分而潮解。回答下列问题:
(1)装置A中用
 和浓盐酸反应制备
和浓盐酸反应制备 的离子方程式为
的离子方程式为(2)装置A中g管的作用是
(3)比较制取
 和NaClO的反应条件,二者的差异是:
和NaClO的反应条件,二者的差异是:(4)写出制备NaClO反应的离子方程式
(5)写出制备
 的化学反应方程式
的化学反应方程式(6)若没有控制好反应温度,C中产物中可能有
 、KClO和KCl三种盐生成,反应后
、KClO和KCl三种盐生成,反应后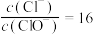 ,则溶液
,则溶液
(7)碱石灰的成分是NaOH和CaO的混合物,盛放碱石灰的仪器m的名称是
您最近一年使用:0次
名校
解题方法
7 .  可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 。
。
回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,若在实验室进行“酸浸”,则不能使用玻璃仪器,原因是_______ 。
(2)滤渣1的主要成分是_______ (填化学式,下同),滤渣2的主要成分是_______ 。
(3)写出加入 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:_______ 。
(4)已知 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是_______ ,沉铈过程中会有一种气体产生,该气体是_______ (填化学式)。
(5) 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为_______ 。
(6)常温下, ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
_______  。
。
 可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: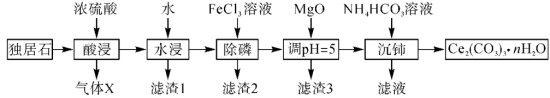
 。
。回答下列问题:
(1)
 的空间结构为
的空间结构为(2)滤渣1的主要成分是
(3)写出加入
 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:(4)已知
 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是(5)
 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为(6)常温下,
 ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
 。
。
您最近一年使用:0次
2024-03-03更新
|
152次组卷
|
2卷引用:河北省衡水董子高级中学等校2023-2024学年高三下学期2月 入校考试 化学试题
名校
解题方法
8 .  具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入
具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: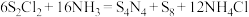 [已知
[已知 (分子结构为
(分子结构为 是硫单质中最稳定的]。下列说法错误的是
是硫单质中最稳定的]。下列说法错误的是

A. 属于分子晶体, 属于分子晶体,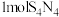 中含有 中含有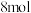 极性键 极性键 |
B. 中含有 中含有 非极性键 非极性键 |
C.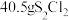 参与上述制备反应,转移 参与上述制备反应,转移 电子 电子 |
D. 的VSEPR模型均为四面体形 的VSEPR模型均为四面体形 |
您最近一年使用:0次
2024-03-03更新
|
387次组卷
|
2卷引用:河北省衡水董子高级中学等校2023-2024学年高三下学期2月 入校考试 化学试题
名校
9 . 亚氯酸钠( )主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠(
)主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠( )等为原料制备亚氯酸钠(
)等为原料制备亚氯酸钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:
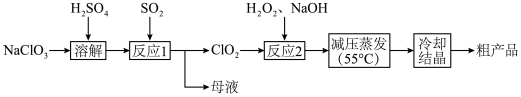
(1)实验室模拟“溶解”过程,需要480 mL 0.1 mol/L 溶液,现进行溶液配制。
溶液,现进行溶液配制。
①实验室购买的浓硫酸标签如图所示。配制所需的 溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有
溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有___________ ,需要量取的浓硫酸的体积是___________ mL。
②在容量瓶的使用方法中,下列操作正确的是___________ 。
A.使用容量瓶前检查容量瓶的气密性是否良好
B.容量瓶用蒸馏水洗净后无需干燥即可使用
C.浓硫酸的稀释可以在容量瓶中进行
D.配制好的 溶液可以长期存放在容量瓶中
溶液可以长期存放在容量瓶中
③配制过程中下列各项操作可能导致浓度偏小的有___________ (填写字母)。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.将浓硫酸稀释后立即转入容量瓶后,立即进行后续实验操作
C.转移溶液时,不慎有少量溶液洒到容量瓶外面
D.定容时,俯视容量瓶刻度线进行定容
(2)“反应1”中氧化剂和还原剂的物质的量之比是___________ 。
(3)“反应2”中加入的 的电子式是
的电子式是___________ ,发生反应的离子方程式是___________ 。
 )主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠(
)主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠( )等为原料制备亚氯酸钠(
)等为原料制备亚氯酸钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:
(1)实验室模拟“溶解”过程,需要480 mL 0.1 mol/L
 溶液,现进行溶液配制。
溶液,现进行溶液配制。①实验室购买的浓硫酸标签如图所示。配制所需的
 溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有
溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有| 硫酸化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
A.使用容量瓶前检查容量瓶的气密性是否良好
B.容量瓶用蒸馏水洗净后无需干燥即可使用
C.浓硫酸的稀释可以在容量瓶中进行
D.配制好的
 溶液可以长期存放在容量瓶中
溶液可以长期存放在容量瓶中③配制过程中下列各项操作可能导致浓度偏小的有
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.将浓硫酸稀释后立即转入容量瓶后,立即进行后续实验操作
C.转移溶液时,不慎有少量溶液洒到容量瓶外面
D.定容时,俯视容量瓶刻度线进行定容
(2)“反应1”中氧化剂和还原剂的物质的量之比是
(3)“反应2”中加入的
 的电子式是
的电子式是
您最近一年使用:0次
10 . 元素铬(Cr)为钢灰色金属,是自然界硬度最大的金属,可溶于水的化合物有 和
和 ,回答下列问题:
,回答下列问题:
(1)写出 溶于水电离方程式
溶于水电离方程式_______ 。
(2)水溶液中发生的化学反应: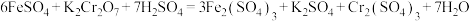 ,该反应中共有
,该反应中共有_______ 种盐,其中氧化剂是_______ ,氧化产物是_______ ,氧化剂和还原剂的物质的量之比为_______ ,用双线桥法标出该反应电子转移的方向和数目:_______ 。
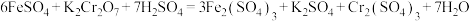
将该化学方程式改为离子方程式_______ 。
(3)铬元素的化合价有+6、+3,在下图所示步骤中,发生氧化反应的是_______ (填序号,下同),发生还原反应的是_______ ,既没发生氧化反应又没发生还原反应的是_______ 。

(4)向橙色的酸性 溶液通入足量的
溶液通入足量的 气体,溶液变为绿色的
气体,溶液变为绿色的 溶液,此反应中利用
溶液,此反应中利用 的
的_______ (填“漂白性”“酸性”“氧化性”或“还原性”)。
 和
和 ,回答下列问题:
,回答下列问题:(1)写出
 溶于水电离方程式
溶于水电离方程式(2)水溶液中发生的化学反应:
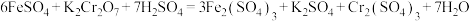 ,该反应中共有
,该反应中共有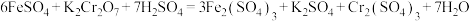
将该化学方程式改为离子方程式
(3)铬元素的化合价有+6、+3,在下图所示步骤中,发生氧化反应的是

(4)向橙色的酸性
 溶液通入足量的
溶液通入足量的 气体,溶液变为绿色的
气体,溶液变为绿色的 溶液,此反应中利用
溶液,此反应中利用 的
的
您最近一年使用:0次



