名校
1 . 标准电极电位指离子有效浓度为1mol/L时相对标准氢电极的电极电位差值,电对的标准电极电势 越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①
越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①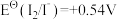 ;②
;②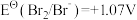 ;③
;③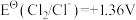 ;④
;④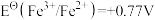 ;⑤
;⑤ ;⑥
;⑥ 。下列有关说法正确的是
。下列有关说法正确的是
 越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①
越高,其电对中氧化剂的氧化性越强。酸性介质中,以下电对的标准电极电势为:①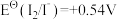 ;②
;②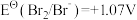 ;③
;③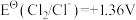 ;④
;④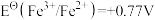 ;⑤
;⑤ ;⑥
;⑥ 。下列有关说法正确的是
。下列有关说法正确的是A.向1mol/L的HBr溶液中滴加 溶液,无明显现象发生 溶液,无明显现象发生 |
B.2mol/L的 与2mol/L的稀盐酸等体积混合有大量 与2mol/L的稀盐酸等体积混合有大量 产生 产生 |
C.在含 、 、 、 、 的混合溶液中若仅氧化 的混合溶液中若仅氧化 ,最佳的氧化剂是 ,最佳的氧化剂是 |
D.浓度相等时,还原性: |
您最近一年使用:0次
名校
解题方法
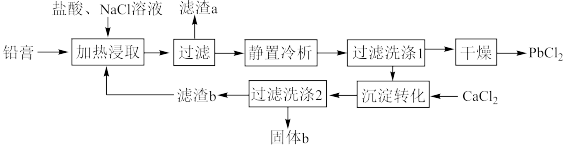
2 . 铅酸蓄电池是全球使用最广泛的化学电源,废铅酸蓄电池铅膏湿法回收铅的工艺研究是当前再生铅回收的重要研究方向,一种利用铅酸蓄电池中铅膏(主要成分为PbSO4、PbO,还含有一些不与流程中试剂反应的物质)制备PbCl2的工艺流程如图所示。请回答下列问题:
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为___________ (填“Pb”或“PbO2”),正极的电极反应式为___________ ;写出提高“加热浸取”速率的一种方法:___________ 。
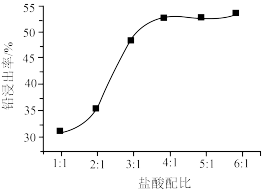
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为___________ ;盐酸配比(盐酸配比是指盐酸实际用量与理论用量之比)对铅浸出率的影响如图所示,则工业上一般选择的盐酸配比为___________ ,选择该配比的原因是___________ 。___________ ;“过滤洗涤1”时,可以用___________ (填标号)检验PbCl2是否洗涤干净;“沉淀转化”的目的是降低滤液b中 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为___________ (填化学式)。
A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为
 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
您最近一年使用:0次
2024高三·全国·专题练习
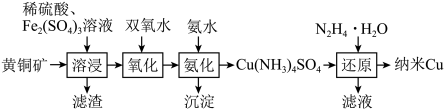
3 . 铜是人类最早使用的金属,在生产生活中有着重要的应用。一种以黄铜矿(主要成分为CuFeS2,含少量Fe的氧化物、SiO2、Au等)为原料制备纳米Cu的工艺流程如下:
②Cu2++4NH3 [Cu(NH3)4]2+。
[Cu(NH3)4]2+。
③Cu2+在一定条件下可能与铜反应转化为Cu+。
回答下列问题:
(1)为了提高“溶浸”的浸出率,可采取的措施有___________ (填两条即可)。
(2)溶浸后,滤渣的主要成分为Au、SiO2、___________ (填化学式)。
(3)写出加入双氧水氧化时反应的离子方程式:___________ 。
(4)加入N2H4·H2O “还原”,产生一种气体单质,该气体的结构式为___________ 。
若加入N2H4·H2O的量不足时,生成另一种还原产物(属于氧化物),该产物的化学式为___________ 。
(5)保持其他条件相同,分别测得纳米Cu的产率随c(N2H4·H2O)和pH变化的曲线如图。___________ 。
②pH过大,纳米Cu的产率反而下降的原因可能是___________ 。
②Cu2++4NH3
 [Cu(NH3)4]2+。
[Cu(NH3)4]2+。③Cu2+在一定条件下可能与铜反应转化为Cu+。
回答下列问题:
(1)为了提高“溶浸”的浸出率,可采取的措施有
(2)溶浸后,滤渣的主要成分为Au、SiO2、
(3)写出加入双氧水氧化时反应的离子方程式:
(4)加入N2H4·H2O “还原”,产生一种气体单质,该气体的结构式为
若加入N2H4·H2O的量不足时,生成另一种还原产物(属于氧化物),该产物的化学式为
(5)保持其他条件相同,分别测得纳米Cu的产率随c(N2H4·H2O)和pH变化的曲线如图。

②pH过大,纳米Cu的产率反而下降的原因可能是
您最近一年使用:0次
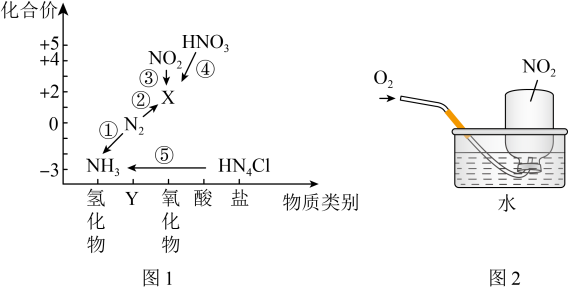
4 . 氮元素是高中化学学习的一种重要非金属元素,其价类二维图如图1所示。________ ,反应①~⑤中不属于氧化还原反应的是________ (填序号)。
(2)反应①中每消耗1mol氢气,转移电子________ mol。
(3)除去X中混有的少量 的方法是
的方法是________ 。
(4)工业以氨气为原料制备硝酸的第一步反应为氨的催化氧化,写出该反应的化学方程式________ 。
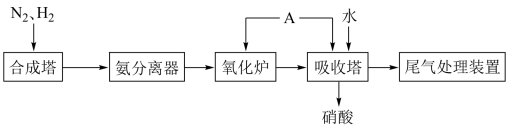
(5)用集气瓶收集 气体并倒置在水槽中,然后缓慢通入适量
气体并倒置在水槽中,然后缓慢通入适量 ,如图2所示。一段时间后,集气瓶中充满溶液。
,如图2所示。一段时间后,集气瓶中充满溶液。
①写出该过程总反应的化学方程式________ 。该实验对工业上生产硝酸的启示是________ 。
②假设该实验条件下,气体摩尔体积为 ,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为________ mol/L。
(2)反应①中每消耗1mol氢气,转移电子
(3)除去X中混有的少量
 的方法是
的方法是(4)工业以氨气为原料制备硝酸的第一步反应为氨的催化氧化,写出该反应的化学方程式
(5)用集气瓶收集
 气体并倒置在水槽中,然后缓慢通入适量
气体并倒置在水槽中,然后缓慢通入适量 ,如图2所示。一段时间后,集气瓶中充满溶液。
,如图2所示。一段时间后,集气瓶中充满溶液。①写出该过程总反应的化学方程式
②假设该实验条件下,气体摩尔体积为
 ,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
您最近一年使用:0次
名校
5 . 硝酸是重要的化工原料。工业制硝酸的原理示意图可简略表示如下(反应条件和部分生成物已略去):___________ 。
(2)物质A是___________ 。向吸收塔中通入A的作用是___________ 。
(3)硝酸能溶解铜,请写出铜和稀硝酸反应的离子方程式:___________ ,在该反应中硝酸体现了___________ 性。
(4)用绿色氧化剂(10%H2O2和20%稀硝酸的混合液)溶解铜,基本无氮氧化物排放,写出Cu与绿色氧化剂反应的离子反应方程式___________ 。
(5)硝酸工业尾气中的 会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知
会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知 用碳酸钠溶液吸收时会生成CO2、
用碳酸钠溶液吸收时会生成CO2、 和另一种化合物,写出反应的离子方程式
和另一种化合物,写出反应的离子方程式___________ 。
(2)物质A是
(3)硝酸能溶解铜,请写出铜和稀硝酸反应的离子方程式:
(4)用绿色氧化剂(10%H2O2和20%稀硝酸的混合液)溶解铜,基本无氮氧化物排放,写出Cu与绿色氧化剂反应的离子反应方程式
(5)硝酸工业尾气中的
 会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知
会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知 用碳酸钠溶液吸收时会生成CO2、
用碳酸钠溶液吸收时会生成CO2、 和另一种化合物,写出反应的离子方程式
和另一种化合物,写出反应的离子方程式
您最近一年使用:0次
2024-05-03更新
|
140次组卷
|
2卷引用:贵州省贵阳市清华中学、安顺一中等校2023-2024学年高一下学期第一次联考化学试题
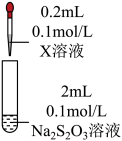
6 . 某小组同学探究硫代硫酸钠(Na2S2O3)溶液与某些常见金属离子的反应。
已知:i.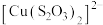 (淡绿色)、
(淡绿色)、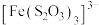 (紫黑色)、
(紫黑色)、 (无色)
(无色)
ii. 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。
iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是___________ 。
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
①取I中的浊液,离心分离,经检验,沉淀是Cu2S和S的混合物,清液中存在 。
。
i.补全I中生成黑色沉淀的总反应的离子方程式:___________
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+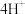
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是___________ 。
②Ⅱ中, 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了 ,理由是
,理由是___________ 。
ii.补全实验方案证实上述结论:将沉淀1洗净,___________ 。
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是___________ 。
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸, 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,___________ 是更软的酸。
已知:i.
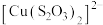 (淡绿色)、
(淡绿色)、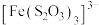 (紫黑色)、
(紫黑色)、 (无色)
(无色)ii.
 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
| 序号 | X溶液 | 现象 |
| I | CuCl2溶液 | 溶液变为淡绿色,水浴加热至50℃以上,逐渐析出黑色沉淀 | |
| Ⅱ | FeCl3溶液 | 溶液变为紫黑色,片刻后溶液变为无色 | |
| Ⅲ | AgNO3溶液 | 逐滴加入AgNO3溶液,生成白色沉淀,振荡后沉淀溶解,得无色溶液 |
 。
。i.补全I中生成黑色沉淀的总反应的离子方程式:
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+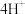
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是
②Ⅱ中,
 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。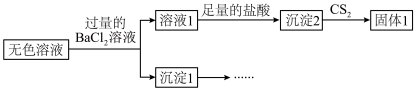
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了
 ,理由是
,理由是ii.补全实验方案证实上述结论:将沉淀1洗净,
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸,
 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
您最近一年使用:0次
名校
7 . 下列有关推理中得到的结论与事实不相符合的是
A.Cu可以还原 得到 得到 ,所以Fe也可以还原 ,所以Fe也可以还原 生成 生成 |
B.常温条件下,Cu与浓硝酸剧烈反应放出 气体,所以Fe和浓硝酸反应将更加剧烈 气体,所以Fe和浓硝酸反应将更加剧烈 |
C. 与NaOH溶液反应生成碳酸盐, 与NaOH溶液反应生成碳酸盐, 也与NaOH溶液反应生成亚硫酸盐 也与NaOH溶液反应生成亚硫酸盐 |
| D.亚硫酸的酸性强于碳酸,所以硫酸的酸性也强于碳酸 |
您最近一年使用:0次
2024高三·全国·专题练习
8 . 除去废水中Cr( )的方法有多种。请按要求回答下列问题。
)的方法有多种。请按要求回答下列问题。
(1)NaHSO3与熟石灰除Cr( )法:向酸性废水中加入NaHSO3,再加入熟石灰,使Cr3+沉淀。
)法:向酸性废水中加入NaHSO3,再加入熟石灰,使Cr3+沉淀。
①实验中NaHSO3的作用是___________ 。
②Cr( )在水溶液中的存在形态分布如图1所示。当pH>12时,Cr(
)在水溶液中的存在形态分布如图1所示。当pH>12时,Cr( )去除率下降的原因可用离子方程式表示为
)去除率下降的原因可用离子方程式表示为___________ 。
用硫酸盐还原菌(SRB)处理含Cr( )的废水时,Cr(
)的废水时,Cr( )去除率随温度的变化如图2所示。55 ℃时,Cr(Ⅵ)去除率很低的原因是
)去除率随温度的变化如图2所示。55 ℃时,Cr(Ⅵ)去除率很低的原因是___________ 。
①“酸浸、还原”时,反应的化学方程式为___________ 。
该步骤若pH过低,则消耗Na2S2O5的量比理论值高出许多,其原因是___________ (文字叙述)。
②“沉铬”时所发生反应的离子方程式为___________ 。能不能将纯碱改为足量NaOH溶液?___________ 。(给出结论,并结合离子方程式给出理由)
 )的方法有多种。请按要求回答下列问题。
)的方法有多种。请按要求回答下列问题。(1)NaHSO3与熟石灰除Cr(
 )法:向酸性废水中加入NaHSO3,再加入熟石灰,使Cr3+沉淀。
)法:向酸性废水中加入NaHSO3,再加入熟石灰,使Cr3+沉淀。①实验中NaHSO3的作用是
②Cr(
 )在水溶液中的存在形态分布如图1所示。当pH>12时,Cr(
)在水溶液中的存在形态分布如图1所示。当pH>12时,Cr( )去除率下降的原因可用离子方程式表示为
)去除率下降的原因可用离子方程式表示为
用硫酸盐还原菌(SRB)处理含Cr(
 )的废水时,Cr(
)的废水时,Cr( )去除率随温度的变化如图2所示。55 ℃时,Cr(Ⅵ)去除率很低的原因是
)去除率随温度的变化如图2所示。55 ℃时,Cr(Ⅵ)去除率很低的原因是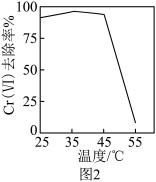

①“酸浸、还原”时,反应的化学方程式为
该步骤若pH过低,则消耗Na2S2O5的量比理论值高出许多,其原因是
②“沉铬”时所发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
9 . 已知反应: ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是
 ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是A.转移电子数为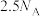 |
B.断裂的 键数为 键数为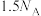 |
| C.还原产物比氧化产物多0.5mol |
D.将生成物配制成1L水溶液,溶液中 |
您最近一年使用:0次
10 . 硒(Se,原子序数为34)在电子工业中可用作光电管、太阳能电池等。某工业提取过程将阳极泥(硒主要以Se单质和Cu2Se的形式存在)在空气中煅烧,可得铜、硒的氧化物,用二氧化硫还原SeO2可得硒。Cu2Se晶胞结构如图所示,下列说法错误的是
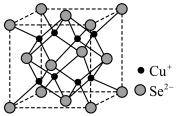
| A.Cu2Se晶胞中Se2-的配位数为8 |
| B.SeO2分子是直线形分子 |
| C.还原时,生成1molSe反应转移4mol电子 |
D.煅烧时,Cu2Se可能发生反应: |
您最近一年使用:0次
2024-04-27更新
|
297次组卷
|
2卷引用:2024届湘豫名校联考高三下学期第三次模拟考试理综试题-高中化学