解题方法
1 . N-羧基丙氨酸酸酐广泛用于生物领域,用碳酸二甲酯 和丙氨酸
和丙氨酸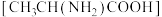 为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
 和丙氨酸
和丙氨酸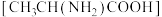 为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
为原料可以制备N-羧基丙氨酸酸酐,其反应机理如图所示。下列说法错误的是
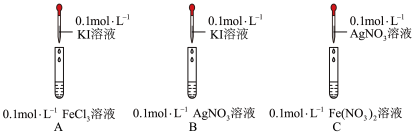
| A.在强酸性环境不利于反应进行 |
B.该过程中 元素的化合价发生改变 元素的化合价发生改变 |
C.反应过程中有 的断裂和形成 的断裂和形成 |
D.用甘氨酸 代替丙氨酸,可制得 代替丙氨酸,可制得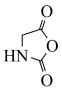 |
您最近一年使用:0次
2024-04-01更新
|
358次组卷
|
4卷引用:提升练03 反应历程探究与催化原理-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
(已下线)提升练03 反应历程探究与催化原理-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)2024届东北三省四市教研联合体高三下学期高考模拟(二)化学试卷 2024届湖南省岳阳市高三下学期第二次教学质量监测(二模)化学试题东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
名校
解题方法
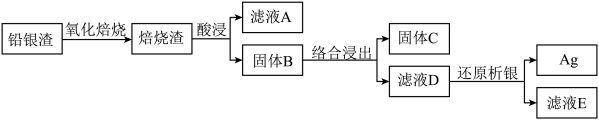
2 . 从铅银渣(含Pb、Ag、Cu等金属元素)中提取银的流程如下: 形成[Ag(SO3)2]3−。
形成[Ag(SO3)2]3−。
(1)“酸浸”时,使用H2SO4、NaCl和NaNO3的混合液作为浸出剂。
①加入NaNO3的作用___________ 。
②固体B含有___________ 。
(2)用氨水和水合肼(N2H4·H2O)进行“络合浸出”和“还原析银”。
①氨水“络合浸出”的化学方程式是___________ 。
②将水合肼“还原析银”反应的离子方程式补充完整:___________ 。
□ ___________+ N2H4·H2O =N2↑ + H2O + □ ___________ + □ ___________ + □ NH3↑
(3)用Na2SO3和甲醛进行“络合浸出”和“还原析银”。
①亚硫酸钠“络合浸出”时,银浸出率和溶液pH、浸出时间的关系分别如下图所示,解释银浸出率随溶液pH增大先升高后降低的原因___________ ;分析浸出时间超过4 h,银浸出率降低的原因___________ 。___________ 。
 形成[Ag(SO3)2]3−。
形成[Ag(SO3)2]3−。(1)“酸浸”时,使用H2SO4、NaCl和NaNO3的混合液作为浸出剂。
①加入NaNO3的作用
②固体B含有
(2)用氨水和水合肼(N2H4·H2O)进行“络合浸出”和“还原析银”。
①氨水“络合浸出”的化学方程式是
②将水合肼“还原析银”反应的离子方程式补充完整:
□ ___________+ N2H4·H2O =N2↑ + H2O + □ ___________ + □ ___________ + □ NH3↑
(3)用Na2SO3和甲醛进行“络合浸出”和“还原析银”。
①亚硫酸钠“络合浸出”时,银浸出率和溶液pH、浸出时间的关系分别如下图所示,解释银浸出率随溶液pH增大先升高后降低的原因

您最近一年使用:0次
2024-04-01更新
|
518次组卷
|
5卷引用:北京市石景山区2024届高三期中考试(一模)化学试卷
北京市石景山区2024届高三期中考试(一模)化学试卷(已下线)提升练07 工艺流程综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)(已下线)北京市西城区2024届高三下学期第三次模拟测试化学试题北京市第一六六中学2023-2024学年高三下学期高考模拟测试(三模)化学试题
名校
3 . 某兴趣小组探究高锰酸钾和氨水的反应,实验如下:
注:实验中c(KMnO4) = 0.01 mol·L-1。
下列说法不正确 的是
| 序号 | 试剂 | 实验现象 |
| ① | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水+0.5 mL蒸馏水 | 溶液完全褪色所需时间:③<②<①。实验均产生棕褐色固体(经检验为MnO2),都伴有少量气泡产生(经检验为N2)。 |
| ② | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水 + 0.5 mL 1 mol·L-1稀硫酸 | |
| ③ | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水 + 0.5 mL 1 mol·L-1 Na2SO4溶液 | |
| ④ | 2 mL KMnO4溶液 + 1 mL 5 mol·L-1 (NH4)2SO4溶液 + 0.5 mL蒸馏水 | 无明显变化 |
下列说法
A.实验①中发生了反应2 MnO + 2NH3 = 2MnO2 + N2↑ + 2OH- + 2H2O + 2NH3 = 2MnO2 + N2↑ + 2OH- + 2H2O |
B.溶液完全褪色所需时间② < ①的主要原因:c(H+)增大,MnO 的氧化性增强 的氧化性增强 |
C.对比实验③④可得出,还原性:NH3 > NH |
| D.在实验④的试剂中,逐滴加入浓NaOH溶液,可观察到溶液褪色 |
您最近一年使用:0次
2024-04-01更新
|
675次组卷
|
6卷引用:北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题
北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题(已下线)通关练03 常考化学实验基础知识-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)北京市北京师范大学燕化附属中学2023-2024学年高一下学期期中考试化学试卷 北京市京郊绿色联盟2023-2024学年高一下学期四校期中联考化学试题江西省宜春市宜丰中学2023-2024学年高一下学期4月期中考试化学试题山东省潍坊一中2023-2024学年高一下学期期中模拟检测化学试题
名校
解题方法
4 . 25℃时,利用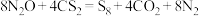 (反应Ⅰ)获得:
(反应Ⅰ)获得: (
( ),同时将生成的
),同时将生成的 溶于水形成
溶于水形成 的溶液Ⅱ,设
的溶液Ⅱ,设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.反应Ⅰ中转移电子的数目为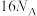 | B.反应Ⅰ中形成 键的数目为 键的数目为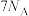 |
C.反应Ⅰ产物中 电子的数目为 电子的数目为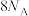 | D.溶液Ⅱ中含 的数目为 的数目为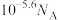 |
您最近一年使用:0次
2024-04-01更新
|
825次组卷
|
4卷引用:辽宁省鞍山市2024届高三第二次质量监测化学试题
辽宁省鞍山市2024届高三第二次质量监测化学试题(已下线)化学(辽宁卷01)-2024年高考押题预测卷(已下线)压轴题02 氧化还原反应的概念及规律(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)黑龙江省哈尔滨工业大学附属中学校2024届高三下学期五模化学试题
名校
5 . 碲(Te)是半导体、红外探测等领域的重要战略元素。从阳极泥或冶炼烟尘中提取的粗二氧化碲中含有 、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
(1)“浸出”步骤中,碲和硒两种元素分别转化为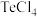 和
和 。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是
。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是___________ 。
(2)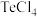 的沸点(387℃)高于
的沸点(387℃)高于 的沸点(191.4℃),原因是
的沸点(191.4℃),原因是___________ 。
(3)“净化”步骤中产生的滤渣主要含___________ (写化学式)和少量硒单质。
(4)化学反应的吉布斯自由能变 。
。 还原
还原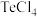 和
和 的
的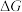 随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过
随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过___________ K,该步骤控制在此温度以下的原因是___________ 。___________ 。
(6)“还原”后的酸性还原尾液中含有少量未被还原的碲,加入还原剂R进行“尾还原”,可以产生粗碲,提高碲的回收率。综合还原效率、工艺成本和环保因素,最合适的还原剂是___________ (填标号)。
A.铁粉 B.氢气 C.硫化钠
 、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。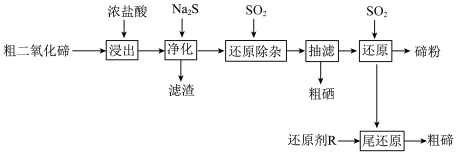
(1)“浸出”步骤中,碲和硒两种元素分别转化为
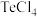 和
和 。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是
。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是(2)
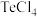 的沸点(387℃)高于
的沸点(387℃)高于 的沸点(191.4℃),原因是
的沸点(191.4℃),原因是(3)“净化”步骤中产生的滤渣主要含
(4)化学反应的吉布斯自由能变
 。
。 还原
还原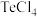 和
和 的
的 随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过
随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过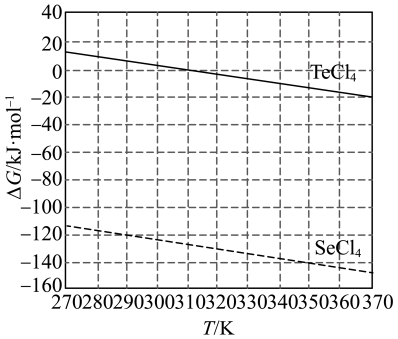
(6)“还原”后的酸性还原尾液中含有少量未被还原的碲,加入还原剂R进行“尾还原”,可以产生粗碲,提高碲的回收率。综合还原效率、工艺成本和环保因素,最合适的还原剂是
A.铁粉 B.氢气 C.硫化钠
您最近一年使用:0次
2024-04-01更新
|
473次组卷
|
4卷引用:河南省周口市2024届高三二模理综-化学试题
河南省周口市2024届高三二模理综-化学试题河南省2024届高三下学期第二次质量检测(二模)理综-化学试卷2024届河南省许昌市禹州市高级中学高三下学期第三次专题考试理综试题-高中化学(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
解题方法
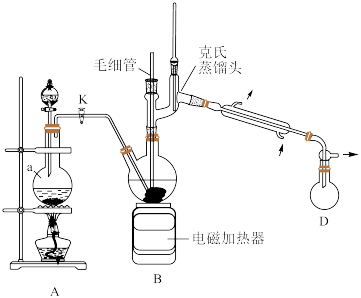
6 . 叠氮化钠(NaN3)是一种重要的化学分析试剂,已知NaN3无色无味,微溶于醇、易溶于水,在40℃以上会发生分解。实验室模仿工业“亚硝酸甲酯-水合肼法”制备NaN3,装置如图所示,基本操作如下:
步骤2:生成的亚硝酸甲酯(CH3ONO)蒸气通入到水合肼(N2H4·H2O)的烧碱溶液中,通过电磁加热器加热,生成叠氮化钠;
步骤3:减压蒸馏,回收甲醇;
步骤4:蒸馏后所得母液,冷却结晶、过滤、洗涤、干燥,得到叠氮化钠。
回答下列问题:
(1)仪器a的名称为___________ ;写出装置A中生成CH3ONO的化学方程式:___________ 。
(2)写出装置B中生成NaN3的化学方程式:___________ 。
(3)装置B反应结束后需采用减压蒸馏回收甲醇,不宜直接蒸馏的原因是___________ ;减压蒸馏中使用毛细管的优点是___________ 。
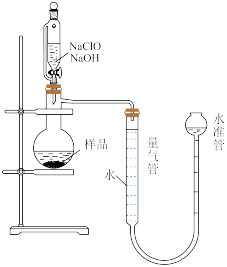
(4)量气法可有效测定产品的纯度,装置如图所示。___________ ;反应结束后水准管中液面会高于量气管,此时需要将水准管慢慢向下移动,则量气管中的液面会___________ (填“上移”“下移”或“不移动”),该产品的纯度(质量分数)为___________ (用含m、V的表达式表示)。
步骤2:生成的亚硝酸甲酯(CH3ONO)蒸气通入到水合肼(N2H4·H2O)的烧碱溶液中,通过电磁加热器加热,生成叠氮化钠;
步骤3:减压蒸馏,回收甲醇;
步骤4:蒸馏后所得母液,冷却结晶、过滤、洗涤、干燥,得到叠氮化钠。
回答下列问题:
(1)仪器a的名称为
(2)写出装置B中生成NaN3的化学方程式:
(3)装置B反应结束后需采用减压蒸馏回收甲醇,不宜直接蒸馏的原因是
(4)量气法可有效测定产品的纯度,装置如图所示。
您最近一年使用:0次
名校
解题方法
7 . 化学是一门以实验为基础的学科。某学习小组探究 、
、 能否将
能否将 氧化,开展如下活动。
氧化,开展如下活动。
(1)用 固体配制
固体配制 溶液,下列仪器中用到的有
溶液,下列仪器中用到的有_______ (填名称)。
A中反应的离子方程式为_______ ,说明氧化性: 。
。
(3)甲同学依据B中现象得出 不能氧化
不能氧化 ,乙同学表示不同意,依据是
,乙同学表示不同意,依据是_______ 。
(4)已知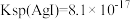 。将
。将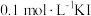 和
和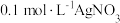 溶液等体积混合,混合后溶液中
溶液等体积混合,混合后溶液中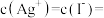
_______  。预测可能是
。预测可能是 、
、 浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。
浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。
(5)乙同学设计了如图实验:_______ (填“ ”或“
”或“ ”)。
”)。
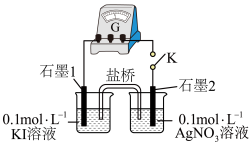
②K闭合时,指针偏转,“石墨1”电极反应为_______ 。
③丙同学测得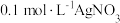 溶液的
溶液的 ,认为可能是
,认为可能是 氧化了
氧化了 。设计实验验证该猜想,将上述
。设计实验验证该猜想,将上述_______ (填“左烧杯”或“右烧杯”)中的溶液换成_______ 指针不偏转,丙同学猜想不成立。
综上所述: 、
、 都能将
都能将 氧化,但
氧化,但 与
与 直接接触时主要发生沉淀反应。
直接接触时主要发生沉淀反应。
 、
、 能否将
能否将 氧化,开展如下活动。
氧化,开展如下活动。(1)用
 固体配制
固体配制 溶液,下列仪器中用到的有
溶液,下列仪器中用到的有
| 实验现象 |
| A中溶液呈棕黄色,滴加淀粉溶液,变蓝 | |
| B中产生黄色沉淀,滴加淀粉溶液,未变蓝 | |
C中产生黑色沉淀,滴加 溶液,变红 溶液,变红 |
 。
。(3)甲同学依据B中现象得出
 不能氧化
不能氧化 ,乙同学表示不同意,依据是
,乙同学表示不同意,依据是(4)已知
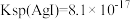 。将
。将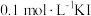 和
和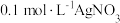 溶液等体积混合,混合后溶液中
溶液等体积混合,混合后溶液中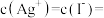
 。预测可能是
。预测可能是 、
、 浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。
浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。(5)乙同学设计了如图实验:
 ”或“
”或“ ”)。
”)。②K闭合时,指针偏转,“石墨1”电极反应为
③丙同学测得
 溶液的
溶液的 ,认为可能是
,认为可能是 氧化了
氧化了 。设计实验验证该猜想,将上述
。设计实验验证该猜想,将上述综上所述:
 、
、 都能将
都能将 氧化,但
氧化,但 与
与 直接接触时主要发生沉淀反应。
直接接触时主要发生沉淀反应。
您最近一年使用:0次
2024-03-31更新
|
787次组卷
|
3卷引用:广东省广州市天河区普通高中2023-2024学年高三毕业班综合测试(二)化学试题
广东省广州市天河区普通高中2023-2024学年高三毕业班综合测试(二)化学试题(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)广东省佛山市三水区三水中学2024届高三下学期全真模拟考试化学试题
解题方法
8 . 丙烷催化氧化是制备丙烯的常见方法,如图为采用羰基催化剂催化氧化丙烷的机理,下列说法正确的是

| A.该机理中,有非极性键的断裂.无非极性键的形成 |
| B.羰基催化剂的活性温度高 |
C.若 参与反应,最终催化剂中含有 参与反应,最终催化剂中含有 |
D.理论上消耗1mol 可制得2mol 可制得2mol |
您最近一年使用:0次
2024-03-31更新
|
388次组卷
|
4卷引用:压轴题04?化学反应机理、历程、能垒图分析(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
(已下线)压轴题04?化学反应机理、历程、能垒图分析(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)2024届湖北省武汉市黄陂区第七高级中学高三下学期一模化学试题 2024届湖南省九校联考高三下学期二模考试化学试题(已下线)单项选择题6-10
名校
解题方法
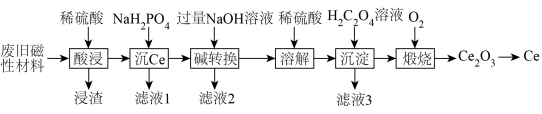
9 . 稀土金属(RE)属于战略性金属,我国的稀土提炼技术位于世界领先地位。一种从废旧磁性材料[主要成分为铈(Ce)、Al、Fe和少量不溶于酸的杂质]中回收稀土金属Ce的工艺流程如图所示。
(1)为提高酸浸的速率,可采取的措施为___________ (写一条即可)。
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为___________ 。
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为___________ ,“滤液2”中铝元素的存在形式为___________ (填化学式)。
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为___________ 。
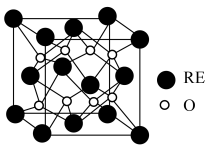
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为___________ ,距离RE原子最近的O原子有___________ 个。若M(晶胞)=Mg/mol,晶胞边长为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g/cm3(列出计算式)。
(1)为提高酸浸的速率,可采取的措施为
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为
您最近一年使用:0次
2024-03-31更新
|
1157次组卷
|
5卷引用:2024届广东省肇庆市高三上学期二模化学试题
2024届广东省肇庆市高三上学期二模化学试题(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题(已下线)化学(广东卷02)-2024年高考押题预测卷湖南省邵阳市邵东市创新高级中学2023-2024学年高三下学期第八次月考化学试题
名校
解题方法
10 . 零价铝是一种应用于环境修复的极有潜力的两性金属材料。构建微观腐蚀原电池体系(如图),实现了零价铝在近中性溶液中处理硝酸盐。下列叙述正确的是
A. 在 在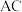 电极上发生氧化反应 电极上发生氧化反应 |
B.生成 的电极反应式: 的电极反应式: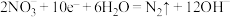 |
C.若 表面生成了致密的 表面生成了致密的 ,能提高去除率 ,能提高去除率 |
D.生成等物质的量的 和 和 ,转移的电子数之比为1∶5 ,转移的电子数之比为1∶5 |
您最近一年使用:0次
2024-03-30更新
|
613次组卷
|
5卷引用:辽宁省锦州市渤海大学附属高级中学2023-2024学年高三下学期3月摸底考试化学试题
辽宁省锦州市渤海大学附属高级中学2023-2024学年高三下学期3月摸底考试化学试题河北省邢台市五岳联盟2024届高三下学期模拟预测化学试题(已下线)通关练01 化学基本概念再回归-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河南省部分省示范高中2023-2024学年高三下学期3月联考理科综合试卷-高中化学贵州省安顺市部分学校2024届高三下学期二模考试化学试题