1 . 下列说法中正确的是
A. 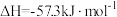 ,则含1molNaOH的氢氧化钠溶液与含1mol CH3COOH的醋酸溶液混合后放出57.3kJ的热量 ,则含1molNaOH的氢氧化钠溶液与含1mol CH3COOH的醋酸溶液混合后放出57.3kJ的热量 |
| B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1 |
C.反应 在室温下可自发进行,则该反应的△H>0 在室温下可自发进行,则该反应的△H>0 |
D.已知C(石墨,s)=C(金刚石,s) ,则金刚石比石墨稳定 ,则金刚石比石墨稳定 |
您最近半年使用:0次
2 . 下列化学用语正确的是
A. 的水解: 的水解: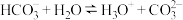 |
B.硫酸铝溶液跟偏铝酸钠溶液反应: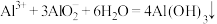 |
C.醋酸铵的电离: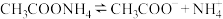 |
D. 的燃烧热为 的燃烧热为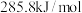 ,则表示 ,则表示 燃烧热的热化学方程式为: 燃烧热的热化学方程式为: 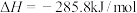 |
您最近半年使用:0次
解题方法
3 . 肼(N2H4)是一种良好的火箭推进剂,肼(N2H4)的燃烧热为624 kJ/mol。下列说法正确的是
A. 和NH3中的H—N—H键角前者大于后者 和NH3中的H—N—H键角前者大于后者 |
| B.N2H4分子中N原子轨道的杂化方式为sp2 |
C.肼在空气中燃烧的热化学方程式为:  |
| D.N2H4易液化是由于N2H4与H2O分子间形成氢键 |
您最近半年使用:0次
解题方法
4 . 下列有关热化学方程式的说法正确的是
A.甲烷的标准燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为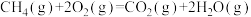  |
B.500℃、30MPa下,将0.5mol 和1.5mol 和1.5mol 置于密闭的容器中充分反应生成 置于密闭的容器中充分反应生成 ,放热19.3kJ,其热化学反应方程式为: ,放热19.3kJ,其热化学反应方程式为:  |
C.已知稀溶液中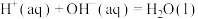 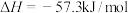 则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量 则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量 |
D.CO(g)的燃烧热是283.0kJ/mol,则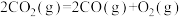 反应的 反应的 |
您最近半年使用:0次
5 . 按要求填空
(1) 是一种无色气体,在空气中能发生爆炸性自燃生成固态
是一种无色气体,在空气中能发生爆炸性自燃生成固态 和液态
和液态 。已知室温下
。已知室温下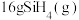 自燃放出热量713.5kJ。写出室温下
自燃放出热量713.5kJ。写出室温下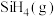 自燃的热化学方程式
自燃的热化学方程式__________ 。
(2)在101kPa时, 在
在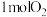 中完全燃烧生成2mol液态水,放出571.6kJ的热量,
中完全燃烧生成2mol液态水,放出571.6kJ的热量, 的燃烧热为
的燃烧热为__________ ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为__________ 。
(3)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量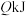 ,燃烧生成的
,燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得 沉淀,则在此条件下,1mol乙醇完全燃烧的
沉淀,则在此条件下,1mol乙醇完全燃烧的
__________ kJ/mol。
(4)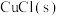 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应每转移
和一种黑色固体。在25℃、101kPa下,已知该反应每转移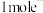 ,放热44.5kJ,该反应的热化学方程式
,放热44.5kJ,该反应的热化学方程式__________ 。
(5)已知反应: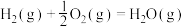

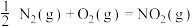



则反应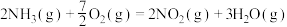 的
的 为
为__________ kJ/mol(用 ,
, ,
, 表示)
表示)
(1)
 是一种无色气体,在空气中能发生爆炸性自燃生成固态
是一种无色气体,在空气中能发生爆炸性自燃生成固态 和液态
和液态 。已知室温下
。已知室温下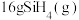 自燃放出热量713.5kJ。写出室温下
自燃放出热量713.5kJ。写出室温下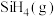 自燃的热化学方程式
自燃的热化学方程式(2)在101kPa时,
 在
在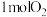 中完全燃烧生成2mol液态水,放出571.6kJ的热量,
中完全燃烧生成2mol液态水,放出571.6kJ的热量, 的燃烧热为
的燃烧热为 燃烧热的热化学方程式为
燃烧热的热化学方程式为(3)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量
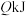 ,燃烧生成的
,燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得 沉淀,则在此条件下,1mol乙醇完全燃烧的
沉淀,则在此条件下,1mol乙醇完全燃烧的
(4)
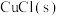 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应每转移
和一种黑色固体。在25℃、101kPa下,已知该反应每转移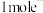 ,放热44.5kJ,该反应的热化学方程式
,放热44.5kJ,该反应的热化学方程式(5)已知反应:
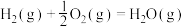

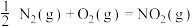



则反应
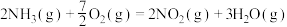 的
的 为
为 ,
, ,
, 表示)
表示)
您最近半年使用:0次
解题方法
6 . 下列依据热化学方程式得出的结论正确的是
| A.已知:4P(红磷,s)=P4(白磷,s) ΔH=+29.2kJ∙mol−1,则等质量的红磷比白磷所具有的能量高 |
| B.已知:2C2H4(g)+6O2(g)=4CO2(g)+4H2O(g) ΔH=-3200.8kJ·mol-1,则C2H4(g)的燃烧热ΔH=-1600.4kJ·mol-1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1;CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH2,则ΔH1>ΔH2 |
| D.已知:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ∙mol−1,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=−114.6kJ∙mol−1 |
您最近半年使用:0次
名校
解题方法
7 . 下列说法正确的是
A.燃烧热和中和热的数值都会随反应物的用量不同而改变,故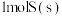 和 和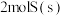 的燃烧热不相等 的燃烧热不相等 |
| B.燃烧热和中和热是反应热的种类之一 |
C.甲烷的燃烧热为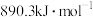 ,则表示甲烷燃烧热的热化学方程式为: ,则表示甲烷燃烧热的热化学方程式为:  |
D.25℃、 时,强酸与强碱的稀溶液发生中和反应的中和热为 时,强酸与强碱的稀溶液发生中和反应的中和热为 ,硫酸溶液与氢氧化钾溶液反应的热化学方程式为: ,硫酸溶液与氢氧化钾溶液反应的热化学方程式为: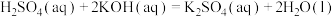  |
您最近半年使用:0次
名校
解题方法
8 . 硅是重要的半导体材料,构成现代电子工业的基础。磷及其化合物在工业中应用广泛,在国防和航天工业中亦有许多用途。在工业上,高纯硅可以通过下列流程制取:
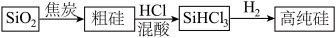
(1)基态硅原子核外电子的运动状态有___________ 种,占据的最高能层符号为___________ 。
(2)流程中由 制粗硅的反应不能说明碳的非金属性强于硅,原因是
制粗硅的反应不能说明碳的非金属性强于硅,原因是___________ 。请写出一个能说明碳的非金属性强于硅的化学方程式___________ 。
(3) 甲硅烷 是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,
是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下, 自燃放出热量
自燃放出热量 ,请写出其燃烧的热化学方程式:
,请写出其燃烧的热化学方程式:___________ 。
(4) 的热稳定性不如
的热稳定性不如 ,其原因是
,其原因是___________ 。
(5)工业上硅铁可以用于冶镁。以煅白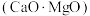 为原料与硅铁(含硅
为原料与硅铁(含硅 的硅铁合金)混合,置于密闭设备中于
的硅铁合金)混合,置于密闭设备中于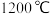 发生反应:
发生反应: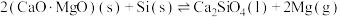 ,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:
,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:___________ 。
(6)有关碳和硅的有关化学键链能如下所示。
硅也有系列氢化物,如甲硅烷等。但硅烷在种类和数量上都远不如烷烃多,原因是___________ 。

(1)基态硅原子核外电子的运动状态有
(2)流程中由
 制粗硅的反应不能说明碳的非金属性强于硅,原因是
制粗硅的反应不能说明碳的非金属性强于硅,原因是(3) 甲硅烷
 是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,
是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下, 自燃放出热量
自燃放出热量 ,请写出其燃烧的热化学方程式:
,请写出其燃烧的热化学方程式:(4)
 的热稳定性不如
的热稳定性不如 ,其原因是
,其原因是(5)工业上硅铁可以用于冶镁。以煅白
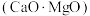 为原料与硅铁(含硅
为原料与硅铁(含硅 的硅铁合金)混合,置于密闭设备中于
的硅铁合金)混合,置于密闭设备中于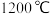 发生反应:
发生反应: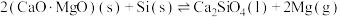 ,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:
,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:(6)有关碳和硅的有关化学键链能如下所示。
| 化学键 |  |  |  |  |  |  |
键能/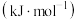 | 356 | 413 | 336 | 226 | 318 | 452 |
您最近半年使用:0次
名校
解题方法
9 .  元素可形成多种含氧酸,其中次磷酸
元素可形成多种含氧酸,其中次磷酸 为一元弱酸,
为一元弱酸, 为三元中强酸。雌黄
为三元中强酸。雌黄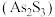 和
和 在盐酸中反应转化为雄黄
在盐酸中反应转化为雄黄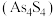 和
和 (沸点
(沸点 并放出
并放出 气体。下列化学反应表示正确的是
气体。下列化学反应表示正确的是
 元素可形成多种含氧酸,其中次磷酸
元素可形成多种含氧酸,其中次磷酸 为一元弱酸,
为一元弱酸, 为三元中强酸。雌黄
为三元中强酸。雌黄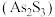 和
和 在盐酸中反应转化为雄黄
在盐酸中反应转化为雄黄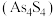 和
和 (沸点
(沸点 并放出
并放出 气体。下列化学反应表示正确的是
气体。下列化学反应表示正确的是A. 制 制 的离子方程式: 的离子方程式: |
B.次磷酸与足量 溶液反应: 溶液反应: |
C.肼燃烧的热化学方程式: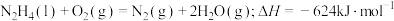 |
D.雌黄制备雄黄的化学方程式: |
您最近半年使用:0次
10 . 研究电解质在水溶液中的平衡能了解它的存在形式。已知部分弱酸的电离常数如下表:
(1)①常温下,pH相同的三种溶液HF、H2CO3、H2S,物质的量浓度最小的是_______ 。
②将少量H2S通入Na2CO3溶液,反应的离子方程式是_______ 。
③0.1mol·L-1的HF溶液,其电离百分数为8%,则该溶液的pH=_______ (已知lg2=0.3)
(2)25℃时,向足量的NaCN溶液中通入少量CO2,所发生反应的离子方程式为_______ 。
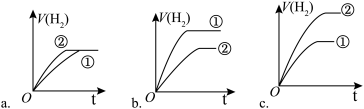
(3)pH相同、体积相同的盐酸和氢氟酸两种溶液盐酸分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______ (填字母)。(①表示盐酸,②表示氢氟酸)
(4)烟气中的SO2可引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过程中,溶液中H2SO3、 、
、 三者所占物质的量分数(a)随pH变化的关系如图所示。由图可知H2SO3第一级电离平衡常数Ka1=
三者所占物质的量分数(a)随pH变化的关系如图所示。由图可知H2SO3第一级电离平衡常数Ka1=_______ 。

(5)25℃,101KPa时,1g氢气完全燃烧生成液态水,放出142.9kJ热量,请写出氢气燃烧热的热化学方程式_______ (结果取整数)。
| 化学式 | HF | H2CO3 | H2S | HCN |
| 电离平衡常数K(25℃) | 7.2×10-4 | Ka1=4.4×10-7 Ka2=9.1×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-11 | K=4.9×10-10 |
(1)①常温下,pH相同的三种溶液HF、H2CO3、H2S,物质的量浓度最小的是
②将少量H2S通入Na2CO3溶液,反应的离子方程式是
③0.1mol·L-1的HF溶液,其电离百分数为8%,则该溶液的pH=
(2)25℃时,向足量的NaCN溶液中通入少量CO2,所发生反应的离子方程式为
(3)pH相同、体积相同的盐酸和氢氟酸两种溶液盐酸分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是

(4)烟气中的SO2可引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过程中,溶液中H2SO3、
 、
、 三者所占物质的量分数(a)随pH变化的关系如图所示。由图可知H2SO3第一级电离平衡常数Ka1=
三者所占物质的量分数(a)随pH变化的关系如图所示。由图可知H2SO3第一级电离平衡常数Ka1=
(5)25℃,101KPa时,1g氢气完全燃烧生成液态水,放出142.9kJ热量,请写出氢气燃烧热的热化学方程式
您最近半年使用:0次



